-
由于高复发率、浸润和转移,胃癌总体5年生存率仍然很低[1]。线粒体作为氧气传感器以及三磷酸腺苷(adenosine triphosphate,ATP)的产生者的重要性已成为癌症研究的重点[2-3]。有氧糖酵解涉及己糖激酶(hexokinase,HK)和磷酸果糖激酶(phosphofructokinase,PFK)[4],其在肿瘤中过表达,可被许多癌蛋白调节,从而促进肿瘤增殖、迁移和化学抗药性[5-6]。癌细胞的代谢和有氧糖酵解被认为是癌细胞的特异性靶标,为癌症治疗提供了新的视角[7]。癌细胞具有较高的糖酵解速率,因此阻断该能量产生途径似乎是有选择地杀死癌细胞的合理方法[8]。糖酵解产生的能量不如氧化磷酸化产生的能量有效,故癌细胞需要更多的葡萄糖来支持更高的糖酵解速率[9]。WZB117是一种合成的小分子葡萄糖运转蛋白抑制剂,其下调葡萄糖运转蛋白以及细胞内ATP和糖酵解酶的水平,从而发挥抗癌活性[10-11]。本研究即探讨糖酵解抑制剂WZB117诱导人胃癌细胞系MGC-803的凋亡的机制,以为临床诊治提供依据。
-
PRMI-1640培养基和胎牛血清(FBS)购自Gibco(Thermo Fisher科学公司,美国)。处于对数生长期的胃癌MGC-803用于本次实验。根据实验要求,将培养的细胞分为2组:对照组(正常培养的胃癌细胞,n=20),WZB117组(用20 μg/mL的葡萄糖运转蛋白抑制剂处理的胃癌细胞,n=20)。
-
使用CellTiter 96 AQueous One Solution细胞增殖测定法[(比色MTS测定试剂盒(Promega公司)]确定细胞的增殖能力。将MGC-803接种到含有5%FBS的改良培养基中的96孔板中,密度为每孔10 000个细胞,并在12 h后进行药物处理。分别在24 h时和72 h后,吸出培养基,将100 μL MTS的1∶5溶液添加到细胞培养基中的每个孔中,孵育1~4 h,并使用BioTek Synergy HT读板仪在490 nm下测量吸光度。实验结果取平均数。
-
为了进行细胞凋亡和生存力分析,将4×103细胞/孔接种到96孔板中,并在37 ℃和5%CO2的潮湿环境中培养。使用一步TUNEL细胞凋亡测定试剂盒(Beyotime公司)来检测凋亡细胞。细胞核用DAPI(蓝色)染色。通过荧光显微镜获得荧光图像。通过ImageJ软件获得TUNEL阳性细胞的定量,并通过GraphPad Prism版本5.0计算。细胞活力通过CCK-8测定法确定。用不同条件处理后,将100 μL含10%CCK-8溶液的新鲜培养基添加到每个孔中,并在37 ℃下孵育1.5 h。用SynergyTM HTX多模式酶标仪(Bio-Tek公司,美国)观察450 nm处的吸光度。根据制造商的协议计算细胞的相对生存力。
-
ATP分析按照制造商的说明进行。简而言之,将收获的培养细胞用裂解缓冲液裂解,在4 ℃以10 000 g离心2 min。最后,在6孔板中,通过将20 μL上清液与100 μL荧光素酶试剂混合来确定ATP的水平,该试剂可催化ATP和荧光素的发光。用单色仪微孔板读数器测量亮度。并使用BCA蛋白测定试剂盒确定每组的蛋白浓度。对于每个样品,准备一个包含上述成分以及10 μg/ mL寡霉素的重复试管。用单色仪微孔板读数器测量亮度。产生标准曲线,并使用BCA蛋白质测定试剂盒确定每个处理组的蛋白质浓度。总ATP水平表示为nmol/mg蛋白。
-
用RIPA溶液(赛默飞世尔公司,美国)提取蛋白质,并通过BCA测定法(默克公司,德国)测定蛋白质浓度。将20 μg待测蛋白质与加样缓冲液混合,变性并添加到10%SDS-PAGE凝胶的每个泳道中。电泳后,将转移到PVDF膜上的蛋白质在5%脱脂牛奶中于22 ℃封闭1 h,与抗人HK单克隆抗体和小鼠抗人PFK单克隆抗体、小鼠抗人Bcl-2单克隆抗体、小鼠抗人Bax单克隆抗体、小鼠抗人caspase-3单克隆抗体和小鼠抗人Cyt-c单克隆抗体,在4 ℃孵育过夜。第2天,将膜用TBST(0.3%Tween-20)洗涤,在室温下与PFK(稀释度为1∶1 000;目录号MBS435036;MyBioSource,Inc.)一起孵育2 h。随后将Immobilon®ECL Ultra Western HRP底物(Sigma公司,美国)铺展到膜进行转染和显色。
-
采用t检验。
-
24 h时和48 h时,WZB117组较对照组细胞增殖均降低,差异有统计学意义(P < 0.01)(见表 1)。
分组 n 24 h吸光度值 48 h吸光度值 对照组 20 168.16±28.37 235.74±45.11 WZB117组 20 129.33±12.28 145.29±19.87 t — 5.62 8.21 P — < 0.01 < 0.01 表 1 2组细胞增殖检测比较(x±s)
-
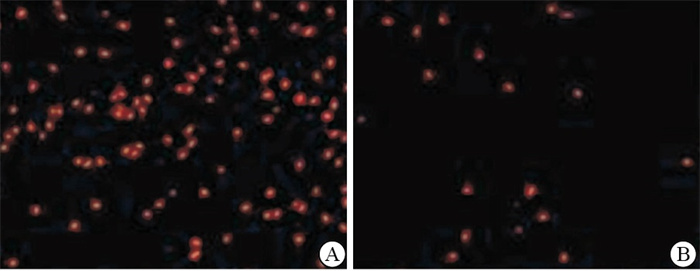
WZB117组较对照组细胞凋亡率升高,差异有统计学意义(P < 0.01),WZB117组较对照组细胞活力降低,差异有统计学意义(P < 0.01)。TUNEL分析显示,WZB117诱导的细胞的凋亡增加(见图 1、表 2)。
分组 n 细胞凋亡率/% 细胞活性/% 对照组 20 20.72±3.52 78.36±9.05 WZB117组 20 41.18±6.33 58.19±10.03 t — 12.63 6.68 P — < 0.01 < 0.01 表 2 细胞凋亡与活力测定(x±s)
-
评估糖酵解细胞中ATP产生,12 h和24 h时WZB117组较对照组ATP含量均降低,差异有统计学意义(P < 0.01)(见表 3)。
分组 n 12 h 24 h 对照组 20 316.47±64.58 354.37±55.18 WZB117组 20 164.22±25.69 91.35±26.47 t — 9.80 19.21 P — < 0.01 < 0.01 表 3 ATP含量检测(x±s;nmol/mg蛋白)
-
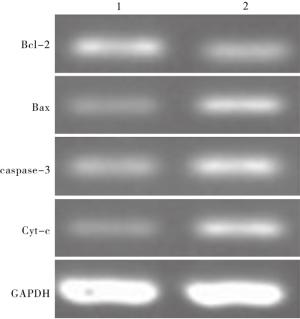
WZB117组较对照组Bcl-2表达降低,差异有统计学意义(P < 0.01),WZB117组较对照组Bax、caspase-3和Cyt-c表达升高,差异有统计学意义(P < 0.01)(见图 2、表 4)。
分组 n Bcl-2 Bax caspase-3 Cyt-c 对照组 20 1.95±0.36 1.06±0.12 1.14±0.18 1.08±0.14 WZB117组 20 1.17±0.15 1.84±0.31 1.79±0.24 1.83±0.25 t — 8.94 10.19 9.69 11.71 P — < 0.01 < 0.01 < 0.01 < 0.01 表 4 Bcl-2、Bax、caspase-3和Cyt-c蛋白的表达量(x±s;积分光密度值)
-
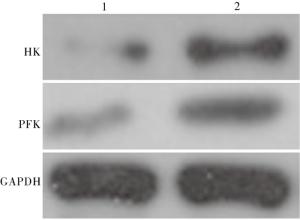
WZB117组较对照组HK和PFK表达均降低,差异有统计学意义(P < 0.01)(见图 3、表 5)。
分组 n HK PFK 对照组 20 1.71±0.25 1.85±0.31 WZB117组 20 0.94±0.12 1.01±0.15 t — 12.42 10.91 P — < 0.01 < 0.01 表 5 糖酵解酶HK和PFK蛋白表达量(x±s;积分光密度值)
-
胃癌是最恶性的肿瘤之一,具有很高的死亡率和发病率,但其启动和发展的分子机制尚不清楚。此外,仍然缺乏用于胃癌的临床治疗的有效治疗剂。因此,寻找具有更少不良反应的更有效的抗胃癌药物并探索其潜在机制是紧迫的目标。最近的许多论文表明,肿瘤中的线粒体缺陷很少见,并且通过糖酵解产生ATP并不是在每种类型的肿瘤中都必需的[12]。线粒体代谢对于多种癌细胞的快速增殖很重要,而用于肿瘤细胞生长的ATP是否源自有氧糖酵解或线粒体生物能学可能主要取决于微环境[13]。因此,靶向线粒体生物能学和糖酵解途径可能是抑制肿瘤细胞增殖的一种新颖有效的方法。
与正常细胞相比,大多数癌细胞优先依靠糖酵解产生ATP[14]。这种表型称为有氧糖酵解。此外,之前的实验和其他研究已经证实,胃癌利用糖酵解来满足能量需求[15]。因此,糖酵解抑制可能是抑制癌细胞生长和/或诱导细胞凋亡的合适靶标。HK和PFK是调节糖酵解速率的关键酶。HK与线粒体膜结合以催化糖酵解的第一个速率调节步骤,并增强细胞增殖及抑制细胞凋亡[16]。糖酵解和细胞凋亡均被视为对肿瘤细胞存活至关重要的独立途径。恶性细胞利用糖酵解作为主要的能量来源,与此同时,在此过程中产生了大量的乳酸和丙酮酸。然而,糖酵解的最终产物乳酸被输出到细胞外培养基中,并有助于肿瘤微环境的酸化,这有利于肿瘤的发展、侵袭,并抑制了抗癌的免疫防御[17]。此外有证据表明,乳酸可能在氧化磷酸化后进入间质和癌细胞中,并可能反过来产生丙酮酸作为肿瘤细胞的高能底物[18]。这项研究的数据表明,WZB117可以显著抑制细胞间ATP的产生。12 h时和24 h时检测WZB117组较对照组ATP含量降低,WZB117组较对照组HK和PFK表达降低,表明WZB117可通过抑制糖酵解关键酶的活性来抑制MGC-803细胞中的糖酵解通量,导致ATP消耗,从而导致能量补充不足以支持癌细胞有丝分裂,DNA修复,扩散和入侵。
然而,凋亡是程序性细胞死亡的自发过程,其可以由多种物理和化学因素诱导,并由生物体精确调控。尽管凋亡中存在三种主要的信号转导途径(线粒体、死亡受体和内质网),但凋亡信号的整合和扩增通常发生在线粒体水平,主要受Bcl-2家族基因调控。有证据[19]表明,Bcl-2可以防止导致细胞凋亡的多种信号,并且与线粒体外膜有关,后者是保护线粒体完整性和功能的关键部分,而Bax通过拮抗Bcl-2的功能诱导线粒体通透性转变。Bcl-2刺激线粒体释放凋亡相关的生物活性物质,例如Cyt-c,后者激活caspase-3/caspase-9并启动caspase信号级联并诱导凋亡。
caspase-3是caspase蛋白家族最重要的成员之一,是细胞凋亡的关键执行者。当被外部细胞凋亡信号激活时,caspase-3可以通过许多其他蛋白酶的相互作用诱导细胞凋亡信号通路[20]。我们从流式细胞仪观察到的结果表明,WZB117可以明显诱导MGC-803细胞凋亡。同时WZB117下调Bcl-2的蛋白表达,而上调Bax蛋白的表达,同时增加Cyt-c和caspase-3的表达。上面的结果表明,WZB117具有诱导Bcl-2下调和Bax上调的能力,这破坏了线粒体的完整性并释放了Cyt-c到细细胞质中,激活了caspase-3,促进MGC-803细胞最终凋亡。
综上所述,WZB117可抑制MGC-803细胞的生长和增殖,并阻断糖酵解途径,并调节Bcl-2家族基因诱导线粒体调节细胞凋亡。
糖酵解抑制剂通过抑制糖酵解和促进线粒体调节的途径诱导胃癌细胞凋亡
Glycolysis inhibitor induces apoptosis of gastric cancer cells by inhibiting glycolysis and promoting mitochondria-regulated pathway
-
摘要:
目的探究糖酵解抑制剂WZB117通过抑制糖酵解和促进线粒体调节的凋亡途径诱导人胃癌细胞系MGC-803的凋亡的机制。 方法处于对数生长期的胃癌MGC-803细胞用于实验。根据实验要求,将培养的细胞分为2组:对照组(正常培养的胃癌细胞),WZB117组(用20 μg/mL的葡萄糖运转蛋白抑制剂处理的胃癌细胞)。通过MTS测定试剂盒检测细胞的增殖能力;通过CCK-8测定细胞活力,TUNEL分析细胞细胞凋亡;通过测定ATP含量检测线粒体功能;通过免疫印迹分析Bcl-2、Bax、caspase-3和Cyt-c蛋白和糖酵解相关酶己糖激酶(HK)和磷酸果糖激酶(PFK)蛋白的表达。 结果24 h时和48 h时WZB117组较对照组细胞增殖降低(P < 0.01)。WZB117组较对照组细胞凋亡率升高(P < 0.01),WZB117组较对照组细胞活力降低(P < 0.01)。12 h时和24 h时WZB117组较对照组ATP含量均降低(P < 0.01)。WZB117组较对照组Bcl-2蛋白表达降低(P < 0.01),WZB117组较对照组Bax、caspase-3和Cyt-c的蛋白表达升高(P < 0.01)。WZB117组较对照组HK和PFK表达降低(P < 0.01)。 结论WZB117通过抑制糖酵解途径和减少线粒体的ATP产能诱导胃癌细胞系MGC-803的凋亡。 Abstract:ObjectiveTo investigate the mechanism of glycolysis inhibitor WZB117-induced apoptosis in human gastric cancer cell line MGC-803 by inhibiting glycolysis and promoting mitochondria-regulated apoptotic pathway. MethodsGastric cancer cell line MGC-803 was used in this study, and exponential growth cells were used in the experiment.According to the experimental requirements, the cultured cells were divided into control group(normally cultured cells) and WZB117 group(cells treated with 20 μg/mL glucose transporter inhibitor).The proliferation of cells was detected by MTS kit.Cell viability was measured by CCK-8 and apoptosis was analyzed by TUNEL.Mitochondrial function was detected by ATP content.The expression of Bcl-2, Bax, caspase-3, Cyt-c and glycolysis-related enzymes cells in hexokinase(HK) and cells in phosphofructokinase(PFK) were analyzed by Western blotting. ResultsThe proliferation of WZB117 group was lower than that in control group at 24 h and 48 hours(P < 0.01).The apoptosis rate in WZB117 group was higher than that in control group(P < 0.01), and the cell viability in WZB117 group was lower than that in control group(P < 0.01).The ATP content in WZB117 group was lower than that in control group at 12 h and 24 h(P < 0.01).The expression of Bcl-2 protein in WZB117 group was lower than that in control group(P < 0.01), and the expression of Bax, caspase-3 and Cyt-c protein in WZB117 group was higher than that in control group(P < 0.01).The expression of HK and PFK in WZB117 group was lower than that in control group(P < 0.01), indicating that WZB117 could inhibit the expression of enzymes related to glycolysis. ConclusionsWZB117 induces apoptosis of gastric cancer cell line MGC-803 by inhibiting glycolysis pathways and reducing mitochondrial ATP production. -
Key words:
- gastric neoplasms /
- WZB117 /
- glycolysis /
- energy metabolism /
- mitochondria
-
表 1 2组细胞增殖检测比较(x±s)
分组 n 24 h吸光度值 48 h吸光度值 对照组 20 168.16±28.37 235.74±45.11 WZB117组 20 129.33±12.28 145.29±19.87 t — 5.62 8.21 P — < 0.01 < 0.01 表 2 细胞凋亡与活力测定(x±s)
分组 n 细胞凋亡率/% 细胞活性/% 对照组 20 20.72±3.52 78.36±9.05 WZB117组 20 41.18±6.33 58.19±10.03 t — 12.63 6.68 P — < 0.01 < 0.01 表 3 ATP含量检测(x±s;nmol/mg蛋白)
分组 n 12 h 24 h 对照组 20 316.47±64.58 354.37±55.18 WZB117组 20 164.22±25.69 91.35±26.47 t — 9.80 19.21 P — < 0.01 < 0.01 表 4 Bcl-2、Bax、caspase-3和Cyt-c蛋白的表达量(x±s;积分光密度值)
分组 n Bcl-2 Bax caspase-3 Cyt-c 对照组 20 1.95±0.36 1.06±0.12 1.14±0.18 1.08±0.14 WZB117组 20 1.17±0.15 1.84±0.31 1.79±0.24 1.83±0.25 t — 8.94 10.19 9.69 11.71 P — < 0.01 < 0.01 < 0.01 < 0.01 表 5 糖酵解酶HK和PFK蛋白表达量(x±s;积分光密度值)
分组 n HK PFK 对照组 20 1.71±0.25 1.85±0.31 WZB117组 20 0.94±0.12 1.01±0.15 t — 12.42 10.91 P — < 0.01 < 0.01 -
[1] AGGARWAL H, NAIR J, SHARMA P, et al. Aegle marmelos differentially affects hepatic markers of glycolysis, insulin signalling pathway, hypoxia, and inflammation in HepG2 cells grown in fructose versus glucose-rich environment[J]. Mol Cell Biochem, 2018, 438(1/2): 1. [2] 陈惠丽, 马平, 陈艳丽, 等. 二甲双胍对K562细胞增殖、凋亡及糖酵解的影响[J]. 中国实验血液学杂志, 2019, 27(5): 1387. [3] HUA S, LEI L, DENG L, et al. miR-139-5p inhibits aerobic glycolysis, cell proliferation, migration, and invasion in hepatocellular carcinoma via a reciprocal regulatory interaction with ETS1[J]. Oncogene, 2018, 37(12): 1624. doi: 10.1038/s41388-017-0057-3 [4] 沈花, 常怡, 陆薇, 等. Lewis肺癌细胞培养上清液通过调控糖酵解途径增强小鼠髓源性抑制细胞的免疫抑制功能[J]. 细胞与分子免疫学杂志, 2019, 35(6): 491. [5] 熊璟, 何元春, 刘杰, 等. 白藜芦醇通过调控雷帕霉素靶蛋白/M2型丙酮酸激酶轴抑制口腔鳞状细胞癌细胞的糖酵解作用[J]. 口腔医学研究, 2019, 35(6): 573. [6] KUANG Y, HAN X, XU M, et al. Oxaloacetate induces apoptosis in HepG2 cells via inhibition of glycolysis[J]. Cancer Med, 2018, 7(4): 1416. doi: 10.1002/cam4.1410 [7] 郝杰, 陈建芳, 李甫, 等. 果糖-1, 6-二磷酸酶1抑制结肠癌SW480细胞的侵袭以及有氧糖酵解[J]. 第三军医大学学报, 2019, 41(9): 823. [8] 段艺菲, 赵清喜, 荆雪. 长链非编码RNA对原发性肝癌中糖酵解途径的影响机制[J]. 临床肝胆病杂志, 2019, 35(6): 1374. doi: 10.3969/j.issn.1001-5256.2019.06.043 [9] WU J, ZHANG X, WANG Y, et al. Licochalcone A suppresses hexokinase 2-mediated tumor glycolysis in gastric cancer via downregulation of the Akt signaling pathway[J]. Oncol Rep, 2018, 39(3): 1181. [10] LIN YH, WU MH, HUANG YH, et al. Taurine up-regulated gene 1 functions as a master regulator to coordinate glycolysis and metastasis in hepatocellular carcinoma[J]. Hepatology, 2018, 67(1): 188. doi: 10.1002/hep.29462 [11] 周新媛, 洪佳馨, 何少兵, 等. 姜黄素对食管癌KYSE410细胞的生长抑制与氧化调节[J]. 高等学校化学学报, 2019, 40(7): 1405. [12] YU T, LI L, LIU W, et al. Silencing of NADPH Oxidase 4 attenuates hypoxia resistance in neuroblastoma cells SH-SY5Y by inhibiting PI3K/Akt-dependent glycolysis[J]. Oncol Res, 2019, 27(5): 525. doi: 10.3727/096504018X15179668157803 [13] 钟晨怡, 冒韵东. 长非编码RNA在肿瘤细胞有氧糖酵解中的调控作用[J]. 国际肿瘤学杂志, 2019, 46(3): 170. doi: 10.3760/cma.j.issn.1673-422X.2019.03.008 [14] WANG CH, SHYU RY, WU CC, et al. Tazarotene-induced gene 1 interacts with DNAJC8 and regulates glycolysis in cervical cancer cells[J]. Mol Cells, 2018, 41(6): 562. [15] DUTCHAK PA, ESTILL-TERPACK SJ, PLEC AA, et al. Loss of a negative regulator of mTORC1 induces aerobic glycolysis and altered fiber composition in skeletal muscle[J]. Cell Reports, 2018, 23(7): 1907. doi: 10.1016/j.celrep.2018.04.058 [16] CHEN Z, LIU M, LI L, et al. Involvement of the Warburg effect in non-tumor diseases processes[J]. J Cell Physiol, 2018, 233(4): 2839. doi: 10.1002/jcp.25998 [17] 蔡尚霞, 姜海英, 杨浩. 宫颈、阴道分泌物和血清PKM2检测在子宫内膜癌、宫颈癌诊断中的意义[J]. 中国实验诊断学, 2020, 24(4): 622. doi: 10.3969/j.issn.1007-4287.2020.04.025 [18] OKUNO R, ITO Y, EID N, et al. Upregulation of autophagy and glycolysis markers in keloid hypoxic-zone fibroblasts: Morphological characteristics and implications[J]. Histol Histopathol, 2018, 33(10): 1075. [19] SINGH KB, HAHM ER, RIGATTI LH, et al. Inhibition of glycolysis in prostate cancer chemoprevention by phenethyl isothiocyanate[J]. Cancer Prev Res, 2018, 11(6): 337. doi: 10.1158/1940-6207.CAPR-17-0389 [20] LOSCHINSKI R, BÖTTCHER M, STOLL A, et al. IL-21 modulates memory and exhaustion phenotype of T-cells in a fatty acid oxidation-dependent manner[J]. Oncotarget, 2018, 9(17): 13125. doi: 10.18632/oncotarget.24442 -





 下载:
下载: