-
弥漫性大B细胞淋巴瘤(DLBCL)是世界范围内最常见的非霍奇金淋巴瘤(NHL),占所有NHL病例的30%~40%。DLBCL年发病率8/10万,近年来其发病率有逐渐增加的趋势[1]。虽然化疗及免疫疗法改善了DLBCL病人的总体缓解率,延长病人的无进展生存时间和总生存时间,但仍有约30%病人出现疾病复发或难治,预后不良[2]。因此有必要深入研究DLBCL发生发展的分子机制,寻找有效的诊断治疗靶点。微小RNA(miR)是长度为18~25个核苷酸的RNA分子,可结合靶基因mRNA的3′非翻译区(UTR),调控靶基因蛋白表达,影响细胞的胚胎发育、血管生成、细胞分化及增殖和凋亡等过程。在肝癌[3]、乳腺癌[4]等多种肿瘤中均存在多种miR的异常表达,通过调控下游癌基因及抑癌基因表达影响肿瘤的发生发展的过程。人类miR-17-5p基因位于染色体13q31.3,是miR-17家族成员之一。miR-17-5p作为一种癌基因,可通过调控多种癌基因,如c-MYC的表达,激活丝裂原激活的蛋白激酶途径等机制,发挥促进肿瘤细胞增殖、凋亡抑制及促进肿瘤浸润转移的作用[5]。磷酸酶张力蛋白同系物(PTEN)基因位于人类染色体10q23.31上,该基因编码蛋白具有特异性磷酸酯酶的活性,负性调节磷脂酰肌醇3激酶(PI3K)的信号转导,抑制肿瘤细胞的无限增殖及迁移能力[6]。研究[7]表明,PTEN是miR-17-5p潜在作用靶点,即miR-17-5p可能通过抑制PTEN的表达发挥肿瘤促进的作用。但目前在DLBCL中miR-17-5p及PTEN的表达及临床意义尚不清楚,本研究通过检测癌组织中miR-17-5p及PTEN表达,探讨两者在DLBCL发生发展中的作用及临床意义。现作报道。
-
选取2015年1月至2016年1月期间于我院诊治的82例DLBCL病人的临床病理资料。纳入标准:(1)经病理检查明确诊断为DLBCL,由2位病理科医生独立阅片判断。(2)均为初次诊治,既往无化疗、放射治疗等抗肿瘤治疗的病史。(3)所有病人临床病理资料和随访资料完整。排除标准:(1)合并严重的心血管、呼吸系统及神经系统疾病。(2)合并其他系统恶性肿瘤。(3)年龄≤18岁。82例病人中男43例,女39例;年龄24~78岁,平均年龄(58.1±7.2)岁;肿瘤分期:其中Ⅰ~Ⅱ期46例,Ⅲ~Ⅳ期36例;组织学分类:中心母细胞型48例,免疫母细胞型18例,间变性大细胞型10例,富于T细胞或组织细胞型6例;原发部位:结外13例,结内69例;乳酸脱氢酶(LDH):≤245 U/L 40例,>245 U/L 42例;血β-Ⅱ型微球蛋白(B2M):≤3 mg/L 50例,>3 mg/L 32例;分子分型:生发中心型31例,非生发中心型51例;参考2004年Hans分型标准[8]:GCB亚型13例,non-GCB亚型69例;国际预后指数评分(IPI): 0~2分53例,3~4分29例。以30例同期经病理检查明确为淋巴结反应性增生的病人的淋巴结组织作为正常对照组。所有病人自术后第1天开始随访,随访时间3~36个月,以门诊或电话的方式进行随访,每3个月一次,内容包括生存情况、疾病复发等,随访终止时间为随访结束或出现死亡。
-
收集术中新鲜获取(离体30 min以内)的组织,置于冻存管内液氮中转运,后置于-80 ℃冰箱保存待测。切取30~50 mg组织,加入1 mL的Trizol裂解组织细胞,分别用三氯甲烷及异丙醇沉淀蛋白及RNA,加1 mL 75%乙醇溶解残留异丙醇,12 000 r/min离心5 min后弃上清液,RNA沉淀干燥后应用DEPC水溶解,紫外分光光度计鉴定RNA的浓度及纯度。以总RNA为模板,进行反转录为cDNA。以cDNA为模板进行反应,miR-17-5p正向引物序列:5′-CAA AGU GCU UAC AGU GCA GGU AG-3′,反向引物序列:5′-CUA CCU GCA CUG UAA GCA CUU UG-3′,内参基因β-actin正向序列: 5′-AGA GCT ACG AGC TGC CTG AC-3′,反向序列: 5′-AGC ACT GTG TTG GCG TAC AG-3′;PTEN正向引物序列: 5′-TGG ATT CGA CTT AGA CTT GAC CT-3′,下游引物序列: 5′-GGT GGG TTA TGG TCT TCA AAA GG-3′,以GAPDH作为内参照,上游引物序列: 5′-ACA ACT TTG GTA TCG TGG AAG G-3′,下游引物序列: 5′-GCC ATC ACG CCA CAG TTT C-3′。反应条件为:96 ℃ 2 min,96 ℃变性15 s,62 ℃退火30 s,70 ℃延伸10 s,变性退火延伸共40个循环。采用相对Ct值方法进行数据分析,目的基因miR-17-5p及PTEN的表达水平分别相对于内参基因β-actin、GAPDH的比值为2-△Ct,计算公式△Ct=Ct目的基因-Ct内参。
-
选取SU-DHL-8细胞系,应用含10%的胎牛血清的RPMI-1640培养基进行细胞培养。miR-17-5p抑制剂和抑制剂对照由上海吉玛公司设计合成。使用lipofectamine2000试剂进行转染,转染步骤参照lipofectamine2000试剂盒说明书(Invitrogen公司,美国)。MTT法检测细胞转染后细胞增殖检测:将SU-DHL-8和SU-DHL-10两种细胞系以1×104个接种于96孔板,培养24、48、72及96 h每孔加入MTT然料50 μL,5 h后离心去上清液,加入二甲基亚砜150 μL溶解,用酶标仪在波长490 nm进行比色分析。转让侵袭能力检测:转染48 h后,将细胞接种于Transwell上室,下室加入胎牛血清,孵育24 h后,收集下层培养液,流式细胞计数细胞量。
-
采用t检验、方差分析、Pearson线性相关分析和Kaplan-Meier生存分析。
-
肿瘤组织中miR-17-5p的相对表达量(5.415±0.486)高于正常组织(1.235±0.210)(t=45.48,P < 0.01);肿瘤组织中PTEN的相对表达量(0.547±0.131)低于正常组织(1.220±0.201)(t=20.67,P < 0.01)。Pearson线性相关分析结果表明,肿瘤组织中miR-17-5p与PTEN的表达呈负相关(r=-0.612,P < 0.01)。
-
病人肿瘤原发部位为节内、LDH≤245 U/L、临床分期为Ⅰ~Ⅱ期miR-17-5p表达高于节外、LDH>245 U/L、Ⅲ~Ⅳ期,PTEN表达低于节外、LDH>245、Ⅲ~Ⅳ期,差异均有统计学意义(P < 0.05~P < 0.01),不同性别、年龄、组织学分类、B2M、分子分型、Hans分型及IPI评分病人,miR-17-5p、PTEN表达差异无统计学意义(P>0.05)(见表 1)。
临床病理特征 n miR-17-5p PTEN 性别 男 43 5.460±0.488 0.541±0.130 女 39 5.365±0.481 0.554±0.132 t — 0.89 0.45 P — >0.05 >0.05 年龄/岁 ≤60 44 5.435±0.489 0.544±0.129 >60 38 5.392±0.482 0.551±0.134 t — 0.40 0.24 P — >0.05 >0.05 组织学分类 中心母细胞型 48 5.420±0.487 0.549±0.130 免疫母细胞型 18 5.413±0.486 0.546±0.129 其他 16 5.402±0.483 0.542±0.128 F — 0.02 0.03 P — >0.05 >0.05 MS组内 — 0.236 0.017 原发部位 结内 69 5.319±0.482 0.562±0.133 结外 13 5.924±0.489 0.447±0.127 t — 4.14 2.88 P — < 0.01 < 0.01 LDH/(U/L) ≤245 40 5.136±0.480 0.595±0.135 >245 42 5.681±0.491 0.501±0.129 t — 5.08 3.22 P — < 0.01 < 0.01 B2M/(mg/L) ≤3 50 5.420±0.487 0.541±0.130 >3 32 5.407±0.485 0.556±0.132 t — 0.12 0.51 P — >0.05 >0.05 临床分期 Ⅰ~Ⅱ期 40 4.787±0.480 0.564±0.135 Ⅲ~Ⅳ期 45 5.612±0.491 0.495±0.127 t — 7.81 2.43 P — < 0.01 < 0.05 IPI评分/分 0~2 53 5.404±0.483 0.551±0.133 3~4 29 5.435±0.488 0.540±0.130 t — 0.28 0.36 P — >0.05 >0.05 Hans分型 GCB 13 5.411±0.490 0.551±0.137 非GCB 69 5.416±0.485 0.546±0.130 t — 0.03 0.13 P — >0.05 >0.05 分子分型 生发中心型 31 5.423±0.489 0.554±0.140 非生发中心型 51 5.410±0.485 0.543±0.135 t — 0.12 0.35 P — >0.05 >0.05 表 1 不同临床病理特征病人肿瘤组织中miR-17-5p、PTEN表达(x±s)
-
SU-DHL-8细胞系转染miR-17-5p抑制剂和抑制剂对照48 h后,PCR检测miR-17-5p和PTEN mRNA表达,结果与转染抑制剂对照相比,转染miR-17-5p抑制剂的SU-DHL-8细胞miR-17-5p表达较低(5.212±0.475和1.012±0.181,t=26.13,P < 0.01),而PTEN表达较高(0.503±0.136和1.890±0.211,t=17.47,P < 0.01)。MTT增殖实验中,与转染抑制剂对照相比,转染miR-17-5p抑制剂的SU-DHL-8细胞在第96小时增殖能力均明显下降(P < 0.01)(见表 2)。Transwell小室实验中,与转染抑制剂对照组细胞穿膜细胞数(71.5±10.6)比较,转染miR-17-5p抑制剂组(50.3±7.6)明显减少(t=3.63,P < 0.05)。
分组 0 h 48 h 72 h 96 h 抑制剂组 0.73±0.12 1.12±0.26 1.97±0.39 2.25±0.36 抑制剂对照组 0.71±0.13 1.35±0.28 2.19±0.41 3.16±0.44 t 0.25 1.35 0.87 3.58 P >0.05 >0.05 >0.05 < 0.01 表 2 各组细胞增殖能力(吸光度)比较(x±s)
-
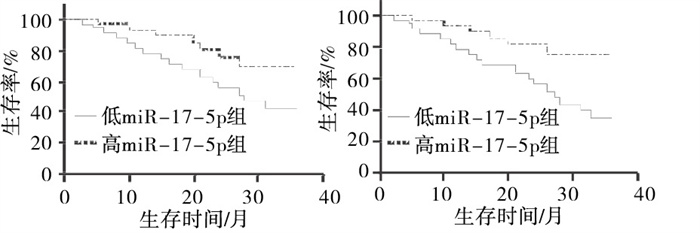
以miR-17-5p的平均数5.415为截点,分为高miR-17-5p表达组和低表达组,3年总体生存率(OS)分别为42.5%(17/40)、71.4%(30/42),Kaplan-Meier分析(log-rank检验)表明高miR-17-5p组病人3年OS低于低miR-17-5p表达组病人,差异有统计学意义(χ2=3.87,P < 0.05)。以PTEN平均数0.547为截点,高PTEN表达组41例,低PTEN表达组41例,3年OS分别为37.5%(15/41)、78.0%(32/41),低PTEN表达组病人病人3年OS低于高PTEN表达组病人,差异有统计学意义(χ2=6.12,P < 0.05)(见图 1)。
-
DLBCL是B淋巴细胞恶性增生性疾病。随着我国步入老龄化社会,DLBCL的发病率、死亡率有逐渐上升的趋势,威胁人们健康[9]。深入研究DLBCL发生发展的分子机制,对DLBCL的诊断和治疗具有重要的临床意义[10]。miR是长度19~25个核苷酸的非编码RNA分子。在RNA聚合酶的作用下mi基因转录为初始miR,在RNA聚合酶Ⅱ和Dicer酶作用后形成成熟的miR,形成RNA诱导的沉默复合物后,与靶基因信使RNA的3′非编码区特异性结合,影响靶基因mRNA翻译。miR-17-5p在肺癌[11]、鼻咽癌[12]等多种肿瘤中存在异常表达上调的现象,通过直接影响癌基因如P21等的表达,影响肿瘤细胞的增殖、凋亡和浸润转移等过程。本研究中,DLBCL肿瘤组织中miR-17-5p的相对表达量明显高于正常组织,表明DLBCL肿瘤组织中miR-17-5p表达增加。其表达增加的机制可能与肿瘤发生时长链非编码RNA(LncRNA)H19通过对miR-17-5p基因表达及功能调控有关。LncRNA H19能够作为内源竞争性RNA表达抑制miR-17-5p的表达及功能,进而抑制miR-17-5p下游癌基因如YES1基因的表达,而肿瘤发生时LncRNA H19表达降低,导致miR-17-5p表达增加,促进肿瘤细胞的增殖[13]。本研究中,Ⅲ~Ⅳ期病人肿瘤组织中miR-17-5p表达明显高于Ⅰ~Ⅱ期癌组织,表明miR-17-5p表达与肿瘤分期有关。其机制可能与miR-17-5p的表达对抑癌基因表达的抑制作用有关。研究[14-15]表明,miR-17-5p能直接结合并抑制抑癌基因Rb信使RNA表达,导致与Rb结合的转录因子E2F1水平增加,通过促进下游癌基因的表达,促进肿瘤细胞的增殖、浸润和转移。本研究在DLBCL体外细胞实验中进一步证实,通过miR-17-5p抑制剂抑制miR-17-5p表达后,肿瘤细胞的增殖和侵袭能力明显减弱,表明miR-17-5p可能是影响DLBCL增殖和浸润的关键因子。本研究中进一步分析不同miR-17-5p表达水平病人3年OS的差别,结果高表达组病人3年OS明显低于低表达组病人,表明miR-17-5p能够成为提示DLBCL病人预后的肿瘤标志物。
PTEN是人类癌症中最常见的突变肿瘤抑制基因之一。其编码的PTEN蛋白属于蛋白酪氨酸磷酸酶家族的成员,能去除肌醇环中的磷酸基团,如PTEN能使磷脂酰肌醇-3, 4, 5-三磷酸(PIP3)去磷酸化为磷脂酰肌醇(4, 5)二磷酸酯。PIP3作为细胞中的重要脂质第二信使,能够激活下游Akt和其他信号分子,促进细胞增殖、血管生成、细胞迁徙等生物学行为[16]。乳腺癌[17]、黑素瘤[18]等恶性肿瘤中发现PTEN表达降低的现象,促进肿瘤的发生发展,与PTEN基因突变、染色体杂合型缺失及转录后调控异常等因素有关。本研究中,肿瘤组织中PTEN表达明显降低,其机制可能与PTEN基因启动子区的表观遗传学修饰,如甲基化、乙酰化修饰有关。如PTEN基因启动子区甲基化导致PTEN表达降低,导致PI3K/Akt信号通路的过度激活,促进肿瘤细胞的恶性增殖[19]。此外,PTEN基因的表达与DLBCL肿瘤分期有关,Ⅲ~Ⅳ期病人肿瘤组织中PTEN基因的表达明显较低,其机制可能是高分期肿瘤组织中调控PTEN表达的miR表达升高更为明显。研究表明,高分期肿瘤中miR-106b、miR-93等多种微小RNA表达升高更为显著,miR-106b、miR-93等通过结合并降低PTEN信使RNA的稳定性,导致PTEN表达水平显著降低[20-21]。本研究中,DLBCL癌组织中miR-17-5p与PTEN表达明显呈负相关,在体外细胞实验中,转染miR-17-5p抑制剂的DLBCL细胞miR-17-5p表达下降的同时,PTEN的相对表达量明显升高,表明PTEN的表达可能受到miR-17-5p的调控。有研究[22]报道,卵巢癌中miR-17-5p能够结合PTEN的信使RNA3′UTR区,进而促进PTEN信使RNA的降解,而应用shRNA抑制miR-17-5p表达后,PTEN表达升高,结果抑制肿瘤的恶性进展。
综上所述,DLBCL肿瘤组织中miR-17-5p表达升高,而PTEN表达降低,两者与DLBCL的肿瘤分期及预后有关,可能参与DLBCL的发生发展的过程,但两者的相互作用机制及临床意义尚需要进一步深入研究。
miR-17-5p及PTEN在弥漫性大B细胞淋巴瘤中的表达及其意义
Expression and significance of miR-17-5p and PTEN in diffuse large B-cell lymphoma
-
摘要:
目的研究弥漫大B细胞淋巴瘤(DLBCL)中微小RNA(miR)-17-5p及磷酸酶张力蛋白同系物(PTEN)表达及其临床意义。 方法应用荧光实时定量PCR检测82例DLBCL肿瘤组织及30例淋巴结反应性增生组织(对照组)中miR-17-5p及PTEN的表达,统计学分析组间表达差异及两者与临床病理特征之间的关系。根据miR-17-5p序列合成miR-17-5p抑制剂和抑制剂对照,并转染至DLBCL细胞系中,MTT细胞增殖实验及Transwell小室实验观察对肿瘤细胞增殖和侵袭能力的影响。采用Kaplan-Meier生存分析观察不同miR-17-5p及PTEN的表达水平与病人预后之间的差异。 结果肿瘤组织中miR-17-5p的相对表达量高于正常组织(P < 0.01);肿瘤组织中PTEN的相对表达量低于正常组织(P < 0.01)。Pearson线性相关分析结果表明,肿瘤组织中miR-17-5p与PTEN的表达呈负相关(r=-0.612,P < 0.01)。病人肿瘤原发部位为节内、乳酸脱氢酶(LDH)≤ 245 U/L、临床分期为Ⅰ~Ⅱ期miR-17-5p表达高于节外、LDH>245 U/L、Ⅲ~Ⅳ期,PTEN表达低于节外、LDH>245 U/L、Ⅲ~Ⅳ期,差异均有统计学意义(P < 0.05~P < 0.01)。与转染抑制剂对照相比,转染miR-17-5p抑制剂的SU-DHL-8细胞miR-17-5p表达较低,而PTEN表达较高(P < 0.01)。与转染抑制剂对照相比,转染miR-17-5p抑制剂的SU-DHL-8细胞在第96小时增殖能力均明显下降(P < 0.05);Transwell小室实验中,与转染抑制剂对照组细胞穿膜细胞数比较,转染miR-17-5p抑制剂组明显减少(P < 0.05)。高miR-17-5p组病人3年总生存率低于低miR-17-5p组病人(P < 0.05),低PTEN表达组病人病人3年总生存率低于高PTEN表达组病人(P < 0.05)。 结论DLBCL肿瘤组织中miR-17-5p表达升高,而PTEN表达降低,两者共同参与DLBCL的发生发展过程,有可能成为新的DLBCL诊断和治疗的肿瘤标志物。 -
关键词:
- 弥漫大B细胞淋巴瘤 /
- 微小RNA-17-5p /
- 磷酸酶张力蛋白
Abstract:ObjectiveTo investigate the expression levels of microRNA(miR)-17-5p and phosphotase and tensin homolog(PTEN) in diffuse large B-cell lymphoma(DLBCL), and their clinical significance. MethodsThe expression levels of miR-17-5p and PTEN in 82 cases of DLBCL carcinoma tissues and 30 cases of lymph node reactive hyperplasia tissues(control group) were detected using real-time quantitative PCR.The differences of the expression levels of miR-17-5p and PTEN between groups, and their relationship with clinicopathological features were analyzed.According to miR-17-5p sequence, the miR-17-5p inhibitors and inhibitor controls were synthesized, and transfected into the DLBCL cell lines.The MTT cell proliferation assay and Transwell chamber assay were used to observe the effects on the proliferation and invasion ability of tumor cells.The Kaplan-Meier survival analysis was used to analyze the differences between the different expression levels of miR-17-5p and PTEN and prognosis of patients. ResultsThe relative expression level of miR-17-5p in tumor tissues was higher than that in normal tissues(P < 0.01).The relative expression level of PTEN in tumor tissue was lower than that in normal tissue(P < 0.01).The results of Pearson linear correlation analysis showed that the expression level of miR-17-5p was negatively correlated with the PTEN expression in tumor tissues(r=-0.612, P < 0.01).The expression level of miR-17-5p in patients with primary tumor site locating intra-ganglia, lactic dehydrogenase(LDH) ≤ 245 U/L and clinical stagesⅠ-Ⅱ were higher than that in patients with primary tumor site locating extra ganglia, LDH>245 U/L and clinical stage Ⅲ-Ⅳ, and the expression level of PTEN in patients with primary tumor site locating intra-ganglia, LDH ≤ 245 U/L and clinical stagesⅠ-Ⅱ was lower than that in extra ganglia, LDH>245 and linical stage Ⅲ-Ⅳ(P < 0.05 to P < 0.01).Compared with the transfection inhibitor control, the expression levels of miR-17-5p and PTEN in SU-DHL 8 cells transfected with miR-17-5p inhibitor were lower and higher, respectively(P < 0.01).Compared with the transfection inhibitor control, the proliferation and invasion ability of DLBCL cells transfected with miR-17-5p inhibitor after 96 h was significantly attenuated(P < 0.05).In Transwell chamber assay, the number of transmembrane cells transfected with miR-17-5p inhibitor was significantly reduced compared with the transfection inhibitor control group(P < 0.05).The 3-year overall survival rate of patients with high miR-17-5p was lower than that of patients with low miR-17-5p(P < 0.05), and that of patients with low PTEN expression was lower than that of patients with high PTEN expression(P < 0.05). ConclusionsThe expression level of miR-17-5p increases, while the expression level of PTEN decreases in patients with DLBCL.Both of them are involved in the occurrence and development of DLBCL, and may become a new tumor marker for DLBCL diagnosis and treatment. -
Key words:
- diffuse large B-cell lymphoma /
- miR-17-5p /
- phosphatase tensin
-
表 1 不同临床病理特征病人肿瘤组织中miR-17-5p、PTEN表达(x±s)
临床病理特征 n miR-17-5p PTEN 性别 男 43 5.460±0.488 0.541±0.130 女 39 5.365±0.481 0.554±0.132 t — 0.89 0.45 P — >0.05 >0.05 年龄/岁 ≤60 44 5.435±0.489 0.544±0.129 >60 38 5.392±0.482 0.551±0.134 t — 0.40 0.24 P — >0.05 >0.05 组织学分类 中心母细胞型 48 5.420±0.487 0.549±0.130 免疫母细胞型 18 5.413±0.486 0.546±0.129 其他 16 5.402±0.483 0.542±0.128 F — 0.02 0.03 P — >0.05 >0.05 MS组内 — 0.236 0.017 原发部位 结内 69 5.319±0.482 0.562±0.133 结外 13 5.924±0.489 0.447±0.127 t — 4.14 2.88 P — < 0.01 < 0.01 LDH/(U/L) ≤245 40 5.136±0.480 0.595±0.135 >245 42 5.681±0.491 0.501±0.129 t — 5.08 3.22 P — < 0.01 < 0.01 B2M/(mg/L) ≤3 50 5.420±0.487 0.541±0.130 >3 32 5.407±0.485 0.556±0.132 t — 0.12 0.51 P — >0.05 >0.05 临床分期 Ⅰ~Ⅱ期 40 4.787±0.480 0.564±0.135 Ⅲ~Ⅳ期 45 5.612±0.491 0.495±0.127 t — 7.81 2.43 P — < 0.01 < 0.05 IPI评分/分 0~2 53 5.404±0.483 0.551±0.133 3~4 29 5.435±0.488 0.540±0.130 t — 0.28 0.36 P — >0.05 >0.05 Hans分型 GCB 13 5.411±0.490 0.551±0.137 非GCB 69 5.416±0.485 0.546±0.130 t — 0.03 0.13 P — >0.05 >0.05 分子分型 生发中心型 31 5.423±0.489 0.554±0.140 非生发中心型 51 5.410±0.485 0.543±0.135 t — 0.12 0.35 P — >0.05 >0.05 表 2 各组细胞增殖能力(吸光度)比较(x±s)
分组 0 h 48 h 72 h 96 h 抑制剂组 0.73±0.12 1.12±0.26 1.97±0.39 2.25±0.36 抑制剂对照组 0.71±0.13 1.35±0.28 2.19±0.41 3.16±0.44 t 0.25 1.35 0.87 3.58 P >0.05 >0.05 >0.05 < 0.01 -
[1] CHIAPPELLA A, CASTELLINO A, NICOLOSI M, et al. Diffuse large B-cell lymphoma in the elderly: standard treatment and new perspectives[J]. Expert Rev Hematol, 2017, 10(4): 289. doi: 10.1080/17474086.2017.1305264 [2] KUBUSCHOK B, HELD G, PFREUNDSCHUH M. Management of diffuse large B-cell lymphoma(DLBCL)[J]. Cancer Treat Res, 2015, 165: 271. [3] CUI X, LI Q, HE Y. miR-3117 regulates hepatocellular carcinoma cell proliferation by targeting PHLPPL[J]. Mol Cell Biochem, 2017, 424(1/2): 195. [4] MCGUIRE A, BROWN JA, KERIN MJ. Metastatic breast cancer: the potential of miRNA for diagnosis and treatment monitoring[J]. Cancer Metastasis Rev, 2015, 34(1): 145. doi: 10.1007/s10555-015-9551-7 [5] 吴莹莹, 高波, 丁跃明, 等. miR-17-5p在肿瘤中作用的研究进展[J]. 中国肿瘤临床, 2016, 43(3): 130. doi: 10.3969/j.issn.1000-8179.2016.03.491 [6] JEFFERIES MT, COX AC, SHORNING BY, et al. PTEN loss and activation of K-RAS and β-catenin cooperate to accelerate prostate tumourigenesis[J]. J Pathol, 2017, 243(4): 442. doi: 10.1002/path.4977 [7] 任妮丽, 胡俊华, 吴方毅. miR-17-5p通过靶定PTEN调节结肠癌细胞增殖、侵袭和迁移能力的研究[J]. 解放军医药杂志, 2015(7): 56. doi: 10.3969/j.issn.2095-140X.2015.07.015 [8] HANS CP, WEISENBURGER DD, GREINER TC, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J]. Blood, 2004, 103(1): 275. doi: 10.1182/blood-2003-05-1545 [9] 佟丹江. 弥漫大B细胞淋巴瘤的流行病学分析[J]. 中国现代药物应用, 2016, 10(8): 46. [10] COIFFIER B, SARKOZY C. Diffuse large B-cell lymphoma: R-CHOP failure-what to do?[J]. Hematology Am Soc Hematol Educ Program, 2016(1): 366. [11] ZHANG W, LIN J, WANG P, et al. miR-17-5p down-regulation contributes to erlotinib resistance in non-small cell lung cancer cells[J]. J Drug Target, 2017, 25(2): 125. doi: 10.1080/1061186X.2016.1207647 [12] CHEN C, LU Z, YANG J, et al. MiR-17-5p promotes cancer cell proliferation and tumorigenesis in nasopharyngeal carcinoma by targeting p21[J]. Cancer Med, 2016, 5(12): 3489. doi: 10.1002/cam4.863 [13] LIU L, YANG J, ZHU X, et al. Long noncoding RNA H19 competitively binds miR-17-5p to regulate YES1 expression in thyroid cancer[J]. FEBSJ, 2016, 283(12): 2326. [14] CONKRITE K, SUNDBY M, MUKAI S, et al. miR-17~92 cooperates with RB pathway mutations to promote retinoblastoma[J]. Genes Dev, 2011, 25(16): 1734. doi: 10.1101/gad.17027411 [15] TAN W, LI Y, LIM SG, et al. miR-106b-25/miR-17-92 clusters: polycistrons with oncogenic roles in hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(20): 5962. doi: 10.3748/wjg.v20.i20.5962 [16] KECHAGIOGLOU P, PAPI RM, PROVATOPOULOU X, et al. Tumor suppressor PTEN in breast cancer: heterozygosity, mutations and protein expression[J]. Anticancer Res, 2014, 34(3): 1387. [17] NGEOW J, SESOCK K, ENG C. Breast cancer risk and clinical implications for germline PTEN mutation carriers[J]. Breast Cancer Res Treat, 2017, 165(1): 1. doi: 10.1007/s10549-015-3665-z [18] DANKORT D, CURLEY DP, CARTLIDGE RA, et al. Braf(V600E)cooperates with Pten loss to induce metastatic melanoma[J]. Nat Genet, 2009, 41(5): 544. doi: 10.1038/ng.356 [19] TEKCHAM DS, GUPTA S, SHRIVASTAV BR, et al. Epigenetic downregulation of PTEN in gallbladder cancer[J]. J Gastrointest Cancer, 2017, 48(1): 110. doi: 10.1007/s12029-017-9919-8 [20] LI N, MIAO Y, SHAN Y, et al. MiR-106b and miR-93 regulate cell progression by suppression of PTEN via PI3K/Akt pathway in breast cancer[J]. Cell Death Dis, 2017, 18;8(5): e2796. [21] 肖长艳, 郭子健, 曹磊, 等. Mir-106b表达与食管鳞状细胞癌的关系[J]. 南方医科大学学报, 2016, 36(12): 1667. doi: 10.3969/j.issn.1673-4254.2016.12.13 [22] FANG Y, XU C, FU Y. MicroRNA-17-5p induces drug resistance and invasion of ovarian carcinoma cells by targeting PTEN signaling[J]. J Biol Res(Thessalon), 2015, 22: 12. -





 下载:
下载: