-
阿尔兹海默病是一种临床较为常见的神经系统疾病,具有发病隐蔽、进行性发展的特点[1-2]。阿尔兹海默病的发生发展与遗传因素、头部外伤、甲状腺疾病史、免疫系统疾病史等因素有关,但是目前临床医学尚未将阿尔兹海默病症状的发病机制研究透彻[3]。目前临床常使用抗精神疾病症状以及改善认知功能的药物对阿尔兹海默病病人进行治疗,但是临床疗效并不理想。因此,有学者开始致力于使用中医药对阿尔兹海默病进行干预的研究。丹参酮是一种自丹参中提取出来的脂溶性成分,具有促进成纤维细胞的增殖分裂的作用,有学者在研究中对丹参酮提取物药理作用进行研究,发现其具有抗炎、抗氧化、调节免疫等诸多药理作用[4],但是关于使用丹参酮对阿尔兹海默病进行干预的研究还鲜有报道。本研究探讨丹参酮提取物对阿尔兹海默病模型大鼠的干预效果及作用机制。现作报道。
-
研究动物:选取40只SD健康雄性大鼠,由潍坊医学院实验动物中心提供,月龄7~9个月,体质量220~238 g。在相对湿度30%~35%、温度(23.8±1.5)℃的环境中喂养大鼠1周,光照12 h/d。本研究获我院伦理委员会批准。主要试剂:小鼠抗大鼠hs-CRP抗体(Selleck公司);兔抗大鼠TNF-α抗体(Sigma公司);小鼠抗大鼠IL-4抗体(BD公司);兔抗大鼠Bcl-2、Bax抗体(Dako公司);小鼠抗大鼠caspase3抗体(Invitrogen公司)。
-
随机选取30只大鼠建立阿尔兹海默病模型:使用45 mg/kg亚硝酸钠以及120 mg/kg D-半乳糖对大鼠进行颈背部皮下注射,每天1次,连续干预至大鼠表现为痴呆状态。大鼠抓耳挠腮等自主活动增多、出现痴呆表现视为建模成功,30只大鼠全部建模成功。将30只阿尔兹海默病模型大鼠随机分为模型组、低剂量组、高剂量组各10只,其余10只为正常组。参照仇淑君等[5]研究中干预方法,并作出适当改动,使用不同剂量丹参酮提取物溶液对阿尔兹海默病大鼠进行干预:低剂量组、高剂量组大鼠分别使用10 g/L、30 g/L丹参酮提取物溶液进行灌胃,正常组、模型组大鼠使用0.9%氯化钠溶液进行灌胃。
-
建造圆形水池,直径设置为1.5 m、高为0.5 m,水深设置为0.25 m,池中水温控制在27 ℃左右。水池中间放置直径0.1 m,高0.3 m平台,并于池壁之上设置4个入水点位,水池外环境保持不变。将已设置的4个点位作为入水区,统计大鼠自此游至所设平台时间,120 s内未游至平台则将其引至平台,潜伏期记为120 s。于平台之上留置0.5 min,再次将其自不同入水点放入水中测试。所有大鼠均进行4 d测试,于第5天撤除平台,自入水区将大鼠放入水中,统计60 s内大鼠穿越原平台位置次数。
-
对各组大鼠进行全麻处理,采用断头法处死,取大鼠海马区脑组织,液氮冷冻后常规脱水、透明、石蜡包埋,间距5 mm做连续切片。将切片烤干后进行脱蜡处理,之后顺序置入100%、95%、80%、75%浓度的乙醇中各复水3 min。使用苏木精染色15 min后清洗3次,使用盐酸乙醇分化处理30 s,充分清洗之后使用1%伊红染色,使用乙醇脱水处理后进行脱蜡处理,封片后使用显微镜进行观察。
-
取50 mm碳酸盐包缓冲液对抗原进行稀释,将其加入聚苯乙烯的反应孔中,加盖处理后,在温度4 ℃的条件下放置24 h,次日洗涤3次后,抛干,在每孔中均加入稀释液(pH值为7.4,0.02 mol/L Tris-HCl缓冲液)稀释的待测标本0.1 mL,并加入阳性和阴性对照标本,在温度为42 ℃的条件下放置60 min,将液体移除并洗涤3次后,抛干,在每孔中加入IL-4、hs-CRP、TNF-α抗体0.1 mL,再次放置60 min,将液体移除并洗涤3次,抛干,并在每孔中加入低物液(0.1 mol/L Na2HPO4,0.05 mol/L枸橼酸)混匀,且加入0.1 mL邻苯二胺,遮光20 min,再次加入2 mol/L H2SO4 0.05 mL放置各孔内,终止反应。使用酶标仪检测A450值,分析IL-4、hs-CRP、TNF-α水平。
-
将待测标本接种于6孔板上,每浓度设置3复孔,细胞贴壁生长后使用不同浓度丹参酮提取物溶液对细胞进行处理,2 d后对细胞进行清洗后使用胰蛋白酶进行消化,2 000 r/min离心机离心处理5 min后进行清洗,添加Annexin-V、PI染色,60 min之内检测。
-
使用PBS缓冲液对标本冲洗之后裂解30 min,测定蛋白浓度。取每孔20 μg蛋白质,添加蛋白缓冲液后进行电泳,10 min后将电转膜置于10%的牛奶中浸泡,常温环境下封闭90 min。之后结合一抗、稀释,孵育1 d,取出后使用TBST液冲洗,结合二抗,60 min后清洗、显色,对Bcl-2、Bax、caspase-3相对表达量进行检测。
-
采用单因素方差分析和q检验。
-
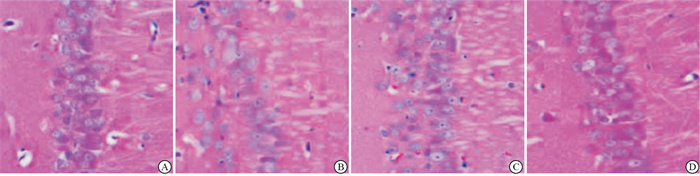
模型组大鼠脑组织神经细胞排列较为杂乱,细胞脱落、坏死现象较为严重;低剂量组、高剂量组大鼠脑组织神经细胞脱落、坏死现象得到明显缓解,高剂量组大鼠脑组织神经细胞数量明显上升,且排列较整齐(见图 1)。
-
模型组逃避潜伏期长于正常组(P < 0.01),穿越平台次数低于正常组(P < 0.01);高剂量组大鼠逃避潜伏期低于模型组和低剂量组(P < 0.01),穿越平台次数多于模型组和低剂量组(P < 0.01和P < 0.05)(见表 1)。
分组 n 逃避潜伏期/s 穿越平台次数 第1天 第2天 第3天 第4天 正常组 10 38.03±3.21 34.78±3.06 27.55±2.73 23.11±2.54 1.92±0.51 模型组 10 49.92±3.74** 45.11±3.42** 38.20±3.16** 34.16±2.96** 0.82±0.21** 低剂量组 10 47.22±3.62** 42.33±3.39** 35.77±3.07** 31.02±2.82**△ 1.28±0.29**△ 高剂量组 10 41.22±3.51△△## 37.03±3.32△△## 30.16±2.85△△## 25.51±2.63△△## 1.71±0.43△△# F — 23.80 20.65 27.61 33.85 16.59 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 12.429 10.894 8.747 7.521 0.143 q检验:与正常组比较**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01;与低剂量组比较#P < 0.05,## P < 0.01 表 1 各组大鼠学习记忆能力比较(x±s)
-
hs-CRP、TNF-α、IL-4水平在4组之间差异均有统计学意义(P < 0.01),4组之间3个指标的水平由高到低的排序依次均为:模型组、高剂量组、低剂量组和正常组(P < 0.01)(见表 2)。
分组 n hs-CRP/(ng/mL) TNF-α/(ng/L) IL-4/(pg/mL) 正常组 10 5.21±1.03 3.37±0.89 12.37±2.34 模型组 10 15.23±1.77** 9.76±1.74** 27.26±3.81** 低剂量组 10 12.31±1.62**△△ 7.61±1.35**△△ 22.33±3.26**△△ 高剂量组 10 7.82±1.36**△△## 4.56±0.93△△## 15.36±2.51**△△## F — 92.76 51.84 49.15 P — < 0.01 < 0.01 < 0.01 MS组内 — 2.167 1.627 9.230 q检验:与正常组比较**P < 0.01;与模型组比较△△P < 0.01;与低剂量比较##P < 0.01 表 2 各组大鼠hs-CRP、TNF-α、IL-4水平比较(x±s)
-
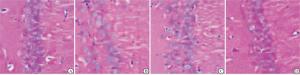
不同时间点海马区细胞凋亡率在4组之间差异均有统计学意义(P < 0.01),在4组之间不同时间点海马区细胞凋亡率由高到低的排序依次均为:模型组、低剂量组、高剂量组和正常组(P < 0.01)(见表 3、图 2)。
分组 n 24 h 48 h 72 h 正常组 10 2.43±0.51 2.39±0.53 2.46±0.49 模型组 10 32.16±3.45** 39.11±3.69** 45.21±3.92** 低剂量组 10 28.37±2.76**△△ 25.16±2.43**△△ 20.68±2.29**△△ 高剂量组 10 20.75±2.36**△△## 16.54±1.75**△△## 11.31±1.23**△△## F — 275.48 414.82 607.62 P — < 0.01 < 0.01 < 0.01 MS组内 — 6.338 5.716 5.591 q检验:与正常组比较** P < 0.01;与模型组比较△△P < 0.01;与低剂量比较##P < 0.01 表 3 各组大鼠不同时间点海马区细胞凋亡率比较(x±s;%)
-
Bcl-2、Bax与caspase-3的表达量在4组之间差异均具有统计学意义(P < 0.01);Bcl-2的表达量在4组之间由高到低的排序依次为:正常组、高剂量组、低剂量组和模型组(P < 0.01);Bax与caspase-3的表达量在4组之间由高到低的排序依次均为:模型组、低剂量组、高剂量组和正常组(P < 0.01)(见表 4)。
分组 n Bcl-2 Bax caspase-3 正常组 10 1.12±0.11 1.03±0.09 0.39±0.04 模型组 10 0.35±0.03** 1.68±0.17** 0.98±0.12** 低剂量组 10 0.53±0.04**△△ 1.45±0.14**△△ 0.83±0.10**△△ 高剂量组 10 0.91±0.09**△△## 1.12±0.10△△## 0.56±0.07**△△## F — 216.67 54.17 90.87 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.006 0.017 0.008 q检验:与正常组比较** P < 0.01;与模型组比较△△P < 0.01;与低剂量比较## P < 0.01 表 4 凋亡蛋白Bcl-2、Bax、caspase-3相对表达量对比(x±s)
-
阿尔兹海默病症状的发生发展会对机体记忆能力、认知功能造成严重的影响[6]。王颖等[7]在研究中建立阿尔兹海默病大鼠模型,结果发现阿尔兹海默病的发生发展会对大鼠空间学习记忆能力造成严重的影响。本研究结果显示,相比正常大鼠,阿尔兹海默病模型大鼠逃避潜伏期较长,穿越平台次数较少,说明阿尔兹海默病的发生发展严重损害机体学习记忆能力,与上述研究结论保持一致。使用丹参酮提取物进行干预后,阿尔兹海默病模型大鼠逃避潜伏期缩短,穿越平台次数明显上升,说明使用丹参酮提取物对阿尔兹海默病模型大鼠进行干预,能够减轻其神经功能受损程度,提升学习记忆能力。
阿尔兹海默病症状的发生发展通常伴随着机体脑组织炎症反应[8-9]。hs-CRP、TNF-α、IL-4是临床较为常用的评价机体炎症反应的指标。hs-CRP是一种主要由肝脏组织合成的C反应蛋白,是一种广谱的机体炎症反应的标志物[10-11];TNF-α一种多功能炎症细胞因子,能够刺激IL-6、IL-8等因子的生成,从而使机体产生持续存在的炎症反应[12-13];IL-4能够刺激肥大细胞释放炎症介质,与机体炎症反应密切相关[14-15]。王锡麟等[16]在研究表明,脑组织炎症反应与阿尔兹海默病症状的发生发展密切相关,抑制炎症反应是治疗阿尔兹海默病的关键。本文研究结果显示,使用丹参酮提取物对阿尔兹海默病模型大鼠进行干预,hs-CRP、TNF-α、IL-4水平出现明显的下降,说明丹参酮提取物能够下调炎症因子hs-CRP、TNF-α、IL-4水平,从而发挥抑制大鼠脑组织炎症反应的作用,从而发挥干预效果。
阿尔兹海默病症状的发生发展、机体神经功能受损严重程度与脑组织神经细胞凋亡情况具有密切联系[17]。田强等[18]在研究中建立阿尔兹海默病大鼠模型,并对海马区细胞凋亡情况进行检测,结果显示,随着阿尔兹海默病的发展,出现海马区细胞凋亡情况。本研究显示,阿尔兹海默病的发生发展伴随着神经细胞凋亡,使用丹参酮提取物对阿尔兹海默病模型大鼠进行干预,海马区细胞凋亡率明显下降,说明使用丹参酮提取物进行干预能够抑制海马区神经细胞凋亡,从而起到神经元保护作用。出现这一研究结果的原因可能是丹参酮提取物对细胞凋亡通路相关蛋白的表达起到了调控作用。
Bcl-2、Bax、caspase-3蛋白的表达与细胞凋亡情况密切相关[19-20]。本文研究中对阿尔兹海默病模型大鼠脑组织Bcl-2、Bax、caspase-3蛋白表达进行检测,结果显示,使用丹参酮提取物进行干预,Bcl-2表达出现上调,Bax、caspase-3表达出现下调,说明丹参酮提取物能够通过调控凋亡蛋白Bcl-2、Bax、caspase-3的表达而起到抑制阿尔兹海默病模型大鼠海马区细胞凋亡的作用。
综上所述,使用丹参酮提取物对阿尔兹海默病模型大鼠进行干预,能够提升阿尔兹海默病大鼠学习记忆能力,减轻脑组织炎症反应,调控细胞凋亡相关蛋白Bcl-2、Bax、caspase-3相对表达量,抑制阿尔兹海默病大鼠海马区细胞凋亡,具有一定神经元保护作用,为阿尔兹海默病的临床治疗提供理论依据。
丹参酮提取物对阿尔茨海默病模型大鼠的干预效果及作用机制研究
Study on the intervention effects of tanshinone extract on Alzheimer's disease model rats and its mechanism
-
摘要:
目的探究丹参酮提取物对阿尔茨海默病模型大鼠的干预效果及作用机制。 方法选取40只SD健康雄性大鼠,随机选取10只作为正常组,其余30只建立阿尔兹海默病模型,并分为模型组、低剂量组、高剂量组。低剂量组、高剂量组大鼠分别使用10 g/L、30 g/L丹参酮提取物溶液进行灌胃,正常组、模型组大鼠使用0.9%氯化钠溶液进行灌胃。对各组大鼠学习记忆能力进行测试,酶联免疫吸附实验法检测白细胞介素(IL)-4、高敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)水平,流式细胞仪检测各组大鼠海马区细胞凋亡情况,Western blotting法检测Bcl-2、Bax、caspase-3表达。 结果模型组逃避潜伏期长于正常组(P < 0.01),穿越平台次数低于正常组(P < 0.01);高剂量组大鼠逃避潜伏期低于模型组和低剂量组(P < 0.01),穿越平台次数多于模型组和低剂量组(P < 0.01和P < 0.05)。hs-CRP、TNF-α、IL-4水平由高到低的排序依次均为:模型组、高剂量组、低剂量组和正常组(P < 0.01)。4组之间不同时间点海马区细胞凋亡率由高到低的排序依次为:模型组、低剂量组、高剂量组和正常组(P < 0.01)。Bcl-2的表达量在4组之间由高到低的排序依次为:正常组、高剂量组、低剂量组和模型组(P < 0.01);Bax与caspase-3的表达量在4组之间由高到低的排序依次均为:模型组、低剂量组、高剂量组和正常组(P < 0.01)。 结论使用丹参酮提取物对阿尔兹海默病模型大鼠进行干预,能够提升阿尔兹海默病大鼠学习记忆能力,减轻脑组织炎症反应,调控细胞凋亡相关蛋白Bcl-2、Bax、caspase-3相对表达量,抑制阿尔兹海默病大鼠海马区细胞凋亡,具有一定神经元保护作用。 Abstract:ObjectiveTo explore the intervention effects of tanshinone extract on Alzheimer's disease model rats and its mechanism. MethodsForty healthy male SD rats were randomly divided into the normal group, model group, low-dose group and high-dose group(10 rats in each group).The low-dose group and high-dose group were given 10 g/L and 30 g/L tanshinone extract by intragastric administration, respectively.The normal group and model group were given 0.9% sodium chloride solution by intragastric administration.The learning and memory ability in each group were tested.The levels of interleukin4(IL-4), high-sensitivity C-reactive protein(hs-CRP) and tumor necrosis factor-α(TNF-α) were detected using enzyme-linked immunosorbent assay, the apoptosis of hippocampal cells in each group was detected using flow cytometry, and the protein expression levels of Bcl-2, Bax and caspase-3 were detected using Western blotting. ResultsThe latency of escape in model group was longer than that in normal group(P < 0.01), and the number of crossing platform in model group was lower than that in normal group(P < 0.01).The escape latency in high-dose group was lower than that in model group and low-dose group(P < 0.01), and the number of crossing platform in high-dose group was more than that in model group and low-dose group(P < 0.01 and P < 0.05).The order of hs-CRP, TNF-α and IL-4 levels from high to low was as follows: model group, high-dose group, low-dose group and normal group(P < 0.01).The order of apoptosis rate of hippocampal cells at different time points was as follows: model group, low-dose group, high-dose group and normal group(P < 0.01).The order of Bcl-2 expression in the four groups from high to low was the normal group, high-dose group, low-dose group and model group(P < 0.01).The expression levels of Bax and caspase-3 were in descending order among the four groups: model group, low-dose group, high-dose group and normal group(P < 0.01). ConclusionsThe intervention of tanshinone extract on Alzheimer's disease model rats can improve the learning and memory ability, alleviate the inflammatory reaction of brain tissue, regulate the relative expression of apoptosis-related proteins, Bcl-2, Bax and caspase-3, and inhibit the apoptosis of hippocampal cells, which has certain neuronal protection effect in Alzheimer's disease rats. -
Key words:
- Alzheimer's disease /
- tanshinone extract /
- inflammatory reaction /
- apoptosis /
- rats
-
表 1 各组大鼠学习记忆能力比较(x±s)
分组 n 逃避潜伏期/s 穿越平台次数 第1天 第2天 第3天 第4天 正常组 10 38.03±3.21 34.78±3.06 27.55±2.73 23.11±2.54 1.92±0.51 模型组 10 49.92±3.74** 45.11±3.42** 38.20±3.16** 34.16±2.96** 0.82±0.21** 低剂量组 10 47.22±3.62** 42.33±3.39** 35.77±3.07** 31.02±2.82**△ 1.28±0.29**△ 高剂量组 10 41.22±3.51△△## 37.03±3.32△△## 30.16±2.85△△## 25.51±2.63△△## 1.71±0.43△△# F — 23.80 20.65 27.61 33.85 16.59 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 12.429 10.894 8.747 7.521 0.143 q检验:与正常组比较**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01;与低剂量组比较#P < 0.05,## P < 0.01 表 2 各组大鼠hs-CRP、TNF-α、IL-4水平比较(x±s)
分组 n hs-CRP/(ng/mL) TNF-α/(ng/L) IL-4/(pg/mL) 正常组 10 5.21±1.03 3.37±0.89 12.37±2.34 模型组 10 15.23±1.77** 9.76±1.74** 27.26±3.81** 低剂量组 10 12.31±1.62**△△ 7.61±1.35**△△ 22.33±3.26**△△ 高剂量组 10 7.82±1.36**△△## 4.56±0.93△△## 15.36±2.51**△△## F — 92.76 51.84 49.15 P — < 0.01 < 0.01 < 0.01 MS组内 — 2.167 1.627 9.230 q检验:与正常组比较**P < 0.01;与模型组比较△△P < 0.01;与低剂量比较##P < 0.01 表 3 各组大鼠不同时间点海马区细胞凋亡率比较(x±s;%)
分组 n 24 h 48 h 72 h 正常组 10 2.43±0.51 2.39±0.53 2.46±0.49 模型组 10 32.16±3.45** 39.11±3.69** 45.21±3.92** 低剂量组 10 28.37±2.76**△△ 25.16±2.43**△△ 20.68±2.29**△△ 高剂量组 10 20.75±2.36**△△## 16.54±1.75**△△## 11.31±1.23**△△## F — 275.48 414.82 607.62 P — < 0.01 < 0.01 < 0.01 MS组内 — 6.338 5.716 5.591 q检验:与正常组比较** P < 0.01;与模型组比较△△P < 0.01;与低剂量比较##P < 0.01 表 4 凋亡蛋白Bcl-2、Bax、caspase-3相对表达量对比(x±s)
分组 n Bcl-2 Bax caspase-3 正常组 10 1.12±0.11 1.03±0.09 0.39±0.04 模型组 10 0.35±0.03** 1.68±0.17** 0.98±0.12** 低剂量组 10 0.53±0.04**△△ 1.45±0.14**△△ 0.83±0.10**△△ 高剂量组 10 0.91±0.09**△△## 1.12±0.10△△## 0.56±0.07**△△## F — 216.67 54.17 90.87 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.006 0.017 0.008 q检验:与正常组比较** P < 0.01;与模型组比较△△P < 0.01;与低剂量比较## P < 0.01 -
[1] XU H, YUE C, CHEN L. Post-transcriptional regulation of soluble guanylate cyclase that governs neuropathic pain in Alzheimer's disease[J]. J Alzheimers Dis, 2019, 71(4): 1331. doi: 10.3233/JAD-190743 [2] 郑妍, 刘舒, 宋凤瑞, 等. 基于Aβ25-35诱导的PC12细胞损伤模型研究定志小丸治疗阿尔兹海默病的作用机制及配伍机制[J]. 分析化学, 2018, 46(11): 1724. doi: 10.11895/j.issn.0253-3820.181318 [3] GUO E, HU Y, DU T, et al. Effects of picrasma quassioides and its active constituents on Alzheimer's disease in vitro and in vivo[J]. Bioorg Chem, 2019, 92: 103258. doi: 10.1016/j.bioorg.2019.103258 [4] 任陈, 杜莎莎. 丹参酮ⅡA减轻海马神经元细胞的放射性损伤[J]. 广东医学, 2018, 39(6): 807. doi: 10.3969/j.issn.1001-9448.2018.06.002 [5] 仇淑君, 王忠良, 李广意, 等. 丹参对AD模型小鼠学习记忆及脑内和血清内乙酰胆碱酯酶含量的影响[J]. 实验动物科学, 2014, 31(4): 11. doi: 10.3969/j.issn.1006-6179.2014.04.003 [6] 李汉文, 武衡. 金帕龙对阿尔茨海默病大鼠记忆功能的改善作用及分子机制研究[J]. 中华神经医学杂志, 2019, 18(4): 331. doi: 10.3760/cma.j.issn.1671-8925.2019.04.002 [7] 王颖, 李忠辉. 海参磷脂对阿尔兹海默病模型大鼠认知功能的影响[J]. 中国临床研究, 2019, 32(7): 915. [8] 张楠, 王莉智, 杨桂姣, 等. 自主跑轮运动对阿尔兹海默病模型小鼠认知、情绪以及杏仁核炎性因子表达的影响[J]. 神经解剖学杂志, 2017, 33(6): 741. [9] 孙永存, 谢莉红. AD患者脑电图δ+θ/α+β比值与炎症因子的相关性分析[J]. 西南国防医药, 2016, 26(10): 1199. doi: 10.3969/j.issn.1004-0188.2016.10.040 [10] 郭敏, 金迪, 王培福, 等. 阿尔茨海默病患者认知功能与其血清IL-6、hs-CRP、Hcy、CysC水平相关性分析[J]. 医学临床研究, 2019, 36(2): 280. [11] 田怡, 欧阳松, 王家祺, 等. Hcy, hs-CRP与急性脑梗死患者颈动脉粥样硬化关系的研究[J]. 现代生物医学进展, 2016, 16(20): 3853. [12] 贺毅, 李恒, 张凤, 等. 与脐血多能干细胞共培养的小鼠淋巴细胞对AD小鼠的免疫调节作用[J]. 基础医学与临床, 2017, 37(8): 1072. doi: 10.3969/j.issn.1001-6325.2017.08.002 [13] 陈魁敏, 周恒伟, 邹丹等. 水飞蓟宾改善AD小鼠认知障碍及机制[J]. 中国公共卫生, 2015, 31(6): 754. [14] 张勇, 宋赞, 孙晓倩, 等. 睡眠剥夺小鼠海马中BDNF、IL-4变化的研究[J]. 中风与神经疾病杂志, 2019, 36(7): 621. [15] 叶樱泽, 熊晓星, 古丽娟, 等. IL-4基因敲除小鼠脑外伤后脑水肿程度及血清HMGB1和S100B水平变化[J]. 中华行为医学与脑科学杂志, 2018, 27(5): 385. doi: 10.3760/cma.j.issn.1674-6554.2018.05.001 [16] 王锡麟, 刘若兰, 沈沉, 等. 低频电针对阿尔茨海默病大鼠炎症因子表达的影响[J]. 中国老年学杂志, 2018, 38(7): 1701. doi: 10.3969/j.issn.1005-9202.2018.07.070 [17] 李佳芮, 聂文博, 张佳悦, 等. 五味子乙素对阿尔茨海默病小鼠学习记忆能力及神经细胞凋亡的影响[J]. 中国老年学杂志, 2017, 37(14): 3390. doi: 10.3969/j.issn.1005-9202.2017.14.005 [18] 田强, 贾军, 屈兴汉, 等. 神经调节素对阿尔茨海默病大鼠模型海马细胞凋亡和核转录因子κB表达的影响[J]. 中华行为医学与脑科学杂志, 2012, 21(1): 26. doi: 10.3760/cma.j.issn.1674-6554.2012.01.009 [19] 孙缦利, 邓海峰, 李明华, 等. 美满霉素对阿尔茨海默病大鼠认知损伤及海马BDNF、Bcl-2和Bax表达的影响[J]. 天津医药, 2016, 44(9): 1088. [20] 陈雪, 孙婧霞, 刘源劼, 等. β-淀粉样蛋白1-42寡聚体诱导的阿尔茨海默病大鼠海马的Bcl-2表达和caspase-3活性变化[J]. 解剖学杂志, 2014, 37(2): 181. doi: 10.3969/j.issn.1001-1633.2014.02.013 -




 下载:
下载: