-
乳腺癌是女性最常见恶性肿瘤之一,其发病率在女性恶性肿瘤中一直高居首位;在我国,乳腺癌死亡率高居女性恶性肿瘤致死率的第2位[1]。腋窝淋巴结转移(axillary lymph node metastasis,ALNM)不仅是乳腺癌预后的重要影响因素之一,而且与病人的手术方案制定有密切联系[2]。因此,术前准确判断乳腺癌病人有无ALNM具有重要临床意义。然而,目前常用的方式均为有创方式,包括腋窝淋巴结清扫术(axillary lymph node dissection,ALND)和前哨淋巴结清扫术(sentinel lymph node dissection,SLND),这些方式可能具有一定的并发症风险,如神经和血管损伤、感染、血肿等[3-4]。由于MRI的无创性、无电离辐射、多序列成像、高软组织分辨率等优势,其在术前无创评估ALNM中具有巨大的应用潜力。然而既往研究[5-6]显示单一的MRI序列在评估ALNM中的能力有限。影像组学可以将数字医学图像转换为可挖掘的数据,分析数据,提取特征,并利用这些特征来直观、定量地描述病灶的生物学特点,全面评估肿瘤的异质性,从而提高诊断、预后和预测准确性,近年来被广泛应用于辅助疾病诊断、预测肿瘤病人的治疗疗效、预后等方面[7]。因此,本文旨在将一种基于双模态MRI的影像组学用于术前预测浸润性乳腺癌ALNM,以协助乳腺癌病人治疗方式的制定,改善病人预后。
-
收集蚌埠医学院第一附属医院2018年11月至2020年11月期间,经手术病理证实的209例浸润性乳腺癌病人。纳入标准:(1)经病理证实为浸润性乳腺癌,且明确ALNM情况;(2)病人在肿瘤切除或活检前均行MRI检查。排除标准:(1)临床病理资料或MRI检查资料不完整;(2)图像质量差无法完成有效图像分割。最终纳入168例浸润性乳腺癌病人进行回顾性分析研究,64例有ALNM(ALN+),104例无ALNM(ALN-);病人均为女性,年龄23~68(48.67 ± 9.12)岁。
-
采用Philips Achieva 3.0 T磁共振及SENSE 7通道矩阵乳腺专用线圈;主要序列及扫描参数如下:横断位T1WI序列(TR 400 ms,TE 10 ms,层厚5 mm,层间距1 mm,FOV 350×350,矩阵216×194,激励次数2,FA 90°);横断位T2WI_SPAIR序列(TR 5 000 ms,TE 60 ms,层厚5 mm,层间距1 mm,FOV 350×350,矩阵260×274,激励次数1,FA 90°);动态增强扫描(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)序列(TI 90 ms,TR 4.8 ms,TE 2.4 ms,层厚5 mm,层间距1 mm,FOV 350×350,矩阵252×339,激励次数1,FA 10°),第1次扫描即预扫后注射钆对比剂(Gd-DTPA,0.2 mmol/kg,2 mL/s),接着注射20 mL 0.9%氯化钠溶液(1.5 mL/s),完成注射同时开始连续无间断扫描5次,每次扫描时间60 s,总共6期。
-
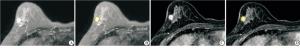
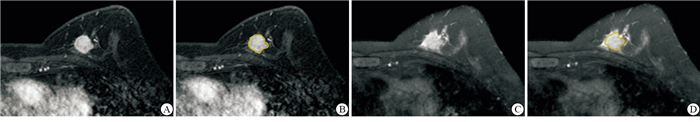
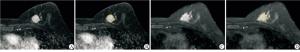
将所有病人的图像导入医准-达尔文科研平台(http://www.yizhun-ai.com)。分别在T2WI和DCE两个序列图像上,采用手动勾画感兴趣区(region of interest,ROI)的方式进行图像分割,在T2WI序列图像上选取肿瘤最大层面进行勾画,DCE上,根据时间-信号强度(TIC)曲线选取最高峰值信号的期相进行勾画,避开血管和坏死(见图 1、2)。所有图像均由2名有丰富经验的影像医师共同进行勾画分割图像。根据分割图像后提取的组学特征采用相关系数(intraclass correlation coefficient,ICC)进行组间一致性分析。
-
T2WI和DCE两个序列图像ROI各提取出939个特征,包括一阶特征、形状特征、纹理特征及小波特征,共1 878个影像组学特征,随机将病人按8∶2分为训练组(n=134)和验证组(n=34)。在训练组中,运用最小最大值归一化将每一维度特征线性拉伸至(0,1)之间,再使用Select K best、最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归算法及迭代筛选特征对这些高维组学特征中进行降维,筛选出与浸润性乳腺ALNM高度相关的影像组学特征。利用logistic回归构建浸润性乳腺癌ALNM的影像组学预测模型,分别为T2WI、DCE和T2WI联合DCE预测模型。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析每个模型在训练组和验证组中的表现,通过曲线下面积(area under curve,AUC)评价模型的预测效能,以最优模型生成影像组学列线图(nomogram),使预测模型能更直观,有效地应用于临床。
-
采用t检验和χ2检验。
-
淋巴结转移组病人的肿瘤长径大于无淋巴结转移组(P < 0.01),年龄和病理分级差异无统计学意义(P > 0.05);年龄、肿瘤长径及病理分级在训练组和验证组病人之间差异均无统计学意义(P > 0.05)(见表 1)。
分组 n 年龄
(x±s)/岁肿瘤长径
(x±s)/cm病理分级 Ⅰ Ⅱ Ⅲ ALN+ 64 47.88±9.67 2.82±1.98 12 30 22 ALN- 104 49.24±8.75 2.02±0.7 26 53 25 t — 0.94 3.12 2.33* P — > 0.05 < 0.01 > 0.05 训练组 134 48.68±8.98 2.34±1.53 34 63 37 验证组 34 48.62±9.76 2.29±0.81 3 20 11 t — 0.04 0.16 1.35* P — > 0.05 > 0.05 > 0.05 *示χ2值 表 1 不同组间临床病理资料的比较
-
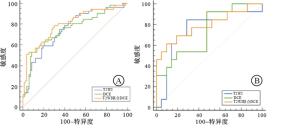
MRI图像中提取的影像组学特征共1 878个。用最小最大值归一化、Select K best和LASSO回归算法及迭代筛选特征进行特征筛选,筛选出与浸润性乳腺癌ALNM相关的影像组学特征:T2WI序列4个特征(1个一阶特征、1个形状特征、1个纹理和1个小波特征);DCE-MRI序列4个特征(1个形状特征、1个纹理特征和2个小波特征);T2WI联合DCE序列5个特征(1个一阶特、1个形状特征、1个纹理特征和2个小波特征)。运用logistic回归构建的T2WI、DCE和T2WI联合DCE影像组学预测模型在训练组中的AUC和95%CI分别为0.75(0.63,0.88)、0.75(0.63,0.86)、0.80(0.68,0.92);在验证组中分别为0.75(0.51,1.00)、0.73(0.44,0.99)、0.79(0.58,1.00);T2WI联合DCE的AUC在训练组及验证组中均最高,高于单独T2WI和单独DCE预测模型,T2WI联合DCE预测模型在预测浸润性乳腺癌ALNM中预测效能最佳(见图 3)。依据最优模型生成列线图(见图 4),该列线图可以实现浸润性乳腺癌病人发生ALNM的个体化预测,计算出的数值越高,病人发生ALNM的可能性越高。
-
乳腺癌病人在治疗前获得ALNM状态,对临床分期、治疗方案选择和预后评估至关重要[8]。乳腺MR现虽已广泛用于术前评估乳腺癌病人的ALNM状态,但乳腺表面线圈区域大小和腋窝空气界面的磁敏感伪影均限制了MRI对腋窝淋巴结的直接评估,而且单一序列图像的评估效能有一定局限性[9]。影像组学将影像图像资料数据化并深度挖掘、分析,可以显示出肉眼难以识别的肿瘤组织解剖学的微小变化,从而达到精准诊断[10]。目前,影像组学方法已被报道用于肺癌、结直肠癌、膀胱癌等恶性肿瘤术前淋巴结转移的预测[11-13],然而对乳腺癌术前ALNM的预测尚属于初步探索阶段。因此,本研究聚焦于在MR图像上分割乳腺癌原发病灶提取影像组学特征预测ALNM状态。
本研究中ALNM组64例,无ALNM组104例,2组临床病理资料的病灶长径差异有统计学意义(P < 0.01),与既往研究[14-15]结果一致;目前,病理分级与ALNM状态的关系仍有很多争论,本研究中病理分级与ALNM状态的差异无统计学意义(P > 0.05),与CHAI等[16]研究结果一致,而与LIU等[17]研究结果不一致,这可能与样本中组织学分型及浸润性乳腺癌的临床分期有关系。本研究临床资料在训练组和验证组间差异无统计学意义,这也反映了本研究随机分组的合理性。
logistic回归简便易行,一般用于二分类预测模型构建,也可用于多分类预测模型,是目前影像组学研究中较为常用的建模方法[18],故本研究使用logistics回归基于T2WI、DCE-MRI提取的高度相关的影像组学特征,构建T2WI、DCE和T2WI联合DCE三个影像组学预测模型。T2WI加权图像可较好地反映正常组织结构和病灶形态,可以更准确地显示乳腺肿块。本研究中T2WI影像组学预测模型的AUC(训练组0.75、验证组0.75),对ALNM具有一定的预测效能,但低于TAN等[4](训练组0.880、验证组0.819)利用T2WI序列的放射组学特征预测ALNM中的研究(n=329),这可能与本研究的样本量较少有关。DCE-MRI通过评价肿瘤的形态和血流动力学是诊断乳腺癌的有效手段,该方法能够提供高时间分辨率、高空间分辨率和高信噪比的图像。DCE-MRI有多期扫描期相,而目前选取特定的期相提取病灶特征能提供最好的预测效能还没有共识。本研究中DCE影像组学预测模型在训练组的AUC(0.75)低于LIU等[19]应用从原发肿瘤第一强化期提取的放射学特征预测前哨淋巴结转移,AUC值为0.806,该研究与本研究选取ROI方式相同,均选取最高强化峰值信号图像勾画ROI;然而也有研究[20]采用第二期图像进行勾画ROI,而AUC(0.86)高于上述研究,因此关于DCE-MRI图像勾画ROI的最佳期相选择有待于更多的研究来证实。本研究以T2WI联合DCE作为最优模型建立影像组学列线图,训练组AUC为0.80,验证组为0.79,在预测ALNM方面体现了较好的预测价值;MAO等[21]基于对比度增强光谱乳腺X线摄影建立影像组学列线图预测乳腺癌ALNM,验证组AUC为0.79;QIU等[22]使用了基于超声成像提取的21个纹理特征来预测乳腺癌淋巴结转移,验证组的AUC为0.759。本研究中, 基于双模态MRI影像组学特征构建的列线图显示相当或更好的性能,并且可在术前通过无创方式获得,在预测淋巴结转移方面具有可接受的价值。
本研究的不足之处:(1)本研究为样本量尚小的回顾性研究,可能存在不可避免的选择性偏倚,且为单中心实验,后续仍需大样本、多中心的实验进一步验证。(2)本研究只分析了肿瘤图像的最大层面,特征提取不算全面;(3)放射科医师手工勾画乳腺癌病灶的ROI轮廓,主观经验影响较大。(4)本研究因DWI图像空间分辨率较低未纳入研究,旨在未来优化图像质量后,将DWI纳入研究。
综上,基于T2WI和DCE-MRI提取原发病灶的影像组学特征对浸润性乳腺癌ALNM具有较好的预测效能,可更好地协助临床、指导治疗。
基于双模态MRI影像组学术前预测浸润性乳腺癌腋窝淋巴结转移
The preoperative prediction value based on dual-mode MRI image omics in axillary lymph node metastasis of invasive breast cancer
-
摘要:
目的探讨T2WI联合DCE-MRI的影像组学特征术前预测浸润性乳腺癌腋窝淋巴结转移的价值。 方法回顾性分析经手术病理证实的168例浸润性乳腺癌病人的临床病理资料及MRI图像资料。根据手术病理结果,将其分为淋巴结转移组(n=64)和无淋巴结转移组(n=104),并按8:2的比例将病人随机分为训练组(n=134)与验证组(n=34)。在T2WI和DCE两个序列手动勾画ROI进行图像分割和影像组学特征提取,利用Select K Best、LASSO回归及迭代筛选特征对高维组学特征进行降维,保留与腋窝淋巴结转移高度相关的特征。采用logistic回归建立T2WI、DCE和T2WI联合DCE三个影像组学预测模型,利用ROC曲线下面积(AUC)评估模型的效能,并以最优模型生成列线图。 结果T2WI、DCE和T2WI联合DCE的影像组学预测模型在训练组的AUC分别为0.75、0.75和0.80;验证组的AUC分别为0.75、0.73和0.79。T2WI联合DCE模型的预测效能最佳。 结论T2WI联合DCE影像组学预测模型在术前对浸润性乳腺癌腋窝淋巴结转移的预测具有一定的价值,能够无创、准确地预测腋窝淋巴结转移状态。 Abstract:ObjectiveTo investigate the value of T2WI combined with DCE-MRI radiomics features in the preoperative prediction of axillary lymph node metastasis of invasive breast cancer. MethodsThe clinicopathological and MRI data of 168 patients with invasive breast cancer confirmed by surgical pathology were retrospectively analyzed. According to the pathological results, the patients were divided into the lymph node metastasis group(n=64) and non-lymph node metastasis group(n=104), and randomly divided into the training group(n=134) and verification group(n=34) in an 8:2 ratio. The ROI was manually delineated on T2WI and DCE sequences for image segmentation and image omics feature extraction. The Select K Best, LASSO regression and iterative screening features were used to reduce the dimensionality of high-dimensional omics features and retain the high associated features with axillary lymph node metastasis. The three imaging omics prediction models of T2WI, DCE and T2WI combined WITH DCE were established using the logistic regression. The area under the ROC curve(AUC) was used to evaluate the effectiveness of models, and the optimal model was used to generate a column chart. ResultsThe AUC of T2WI, DCE, and T2WI combined with DCE in the training group was 0.75, 0.75, 0.80, respectively. The AUC of T2WI, DCE, and T2WI combined with DCE in the validation group was 0.75, 0.73 and 0.79, respectively. The predictive performance in T2WI combined with DCE predictive model was the best. ConclusionsThe predictive model of T2WI combined with DCE has certain value in the preoperative prediction of axillary lymph node metastasis of invasive breast cancer. It can accurately and noninvasively predict the status of axillary lymph node metastasis. -
Key words:
- invasive breast cancer /
- T2WI /
- DCE-MRI /
- radiomics /
- axillary lymph node
-
表 1 不同组间临床病理资料的比较
分组 n 年龄
(x±s)/岁肿瘤长径
(x±s)/cm病理分级 Ⅰ Ⅱ Ⅲ ALN+ 64 47.88±9.67 2.82±1.98 12 30 22 ALN- 104 49.24±8.75 2.02±0.7 26 53 25 t — 0.94 3.12 2.33* P — > 0.05 < 0.01 > 0.05 训练组 134 48.68±8.98 2.34±1.53 34 63 37 验证组 34 48.62±9.76 2.29±0.81 3 20 11 t — 0.04 0.16 1.35* P — > 0.05 > 0.05 > 0.05 *示χ2值 -
[1] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7. doi: 10.3322/caac.21551 [2] PARK KU, CAUDLE A. Management of the axilla in the patient with breast cancer[J]. Surg Clin N Am, 2018, 98(4): 747. doi: 10.1016/j.suc.2018.04.001 [3] GIULIANO AE, BALLMAN KV, MCCALL L, et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis[J]. JAMA, 2017, 318(10): 918. doi: 10.1001/jama.2017.11470 [4] TAN H, GAN F, WU Y, et al. Preoperative prediction of axillary lymph node metastasis in breast carcinoma using radiomics features based on the fat-suppressed T2 sequence[J]. Acad Radiol, 2020, 27(9): 1217. doi: 10.1016/j.acra.2019.11.004 [5] HYUN SJ, KIM EK, MOON HJ, et al. Preoperative axillary lymph node evaluation in breast cancer patients by breast magnetic resonance imaging(MRI): can breast MRI exclude advanced nodal disease?[J]. Eur Radiol, 2016, 26(11): 3865. doi: 10.1007/s00330-016-4235-4 [6] LIANG X, YU J, WEN B, et al. MRI and FDG-PET/CT based assessment of axillary lymph node metastasis in early breast cancer: a meta-analysis[J]. Clin Radiol, 2017, 72(4): 295. doi: 10.1016/j.crad.2016.12.001 [7] GILLIES RJ, KINAHAN PE, HRICAK H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563. [8] GRADISHAR WJ, ANDERSON BO, BALASSANIAN R, et al. NCCN guidelines insights: breast cancer, version 1.2017[J]. J Natl Compr Canc Netw, 2017, 15(4): 433. [9] HUANG SY, SEETHAMRAJU RT, PATEL P, et al. Body MR Imaging: artifacts, k-space, and solutions[J]. Radiographics, 2015, 35(5): 1439. [10] LAMBIN P, RIOS-VELAZQUEZ E, LEIJENAAR R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. Eur J Cance, 2012, 48(4): 441. [11] HUANG Y, LIU Z, HE L, et al. Radiomics signature: A potential biomarker for the prediction of disease-free survival in early-stage(Ⅰor Ⅱ) non-small cell lung cancer[J]. Radiology, 2016, 281(3): 947. [12] HUANG YQ, LIANG CH, HE L, et al. Development and validation of a radiomics nomogram for preoperative prediction of lymph node metastasis in colorectal cancer[J]. J Clin Oncol, 2016, 34(18): 2157. [13] WU S, ZHENG J, LI Y, et al. A radiomics nomogram for the preoperative prediction of lymph node metastasis in bladder cancer[J]. Clin Cancer Res, 2017, 23(22): 6904. [14] 翁剑华, 钟鸣, 黄卓雅, 等. 乳腺癌腋窝淋巴结转移危险因素的研究[J/CD]. 中华普外科手术学杂志: 电子版, 2016, 10(6): 490. [15] 郭斌. 乳腺癌病人腋窝淋巴结转移相关因素分析[J]. 蚌埠医学院学报, 2021, 46(2): 206. [16] CHAI R, MA H, XU M, et al. Differentiating axillary lymph node metastasis in invasive breast cancer patients: A comparison of radiomic signatures from multiparametric breast MR sequences[J]. J Magn Reson Imaging, 2019, 50(4): 1125. [17] LIU J, SUN D, CHEN L, et al. Radiomics analysis of dynamic contrast-enhanced magnetic resonance imaging for the prediction of sentinel lymph node metastasis in breast cancer[J]. Front Oncol, 2019, 9: 980. [18] 吴佩琪. 影像组学在乳腺癌淋巴结转移中的研究进展[J]. 分子影像学杂志, 2020, 43(1): 31. [19] LIU C, DING J, SPUHLER K, et al. Preoperative prediction of sentinel lymph node metastasis in breast cancer by radiomic signatures from dynamic contrast-enhanced MRI[J]. J Magn Resonance Imag, 2019, 49: 131. [20] CUI X, WANG N, ZHAO Y, et al. Preoperative prediction of axillary lymph node metastasis in breast cancer using radiomics features of DCE-MRI[J]. Sci Rep, 2019, 9(1): 2240. [21] MAO N, YIN P, LI Q, et al. Radiomics nomogram of contrast-enhanced spectral mammography for prediction of axillary lymph node metastasis in breast cancer: a multicenter study[J]. Eur Radiol, 2020, 30(12): 6732. [22] QIU X, JIANG Y, ZHAO Q, et al. Could ultrasound based radiomics noninvasively predict axillary lymph node metastasis in breast cancer?[J]. J Ultrasound Med, 2020, 39(10): 1897. -




 下载:
下载: