-
脑卒中病人数正在逐年上涨,其严重的后遗症极大地影响了病人的生存质量[1]。缺血性脑卒中相对于脑出血发病率更高,在临床上也更为常见[2]。脑卒中常见的治疗方法是通过溶栓或机械再通来恢复脑部的血流供应,这也是拯救有活力的脑细胞的第一步,但疏通血管、恢复血流后可能会加重之前缺血的损伤,称为脑缺血再灌注损伤(ischemia and reperfusion injury,I/R)[3]。脑卒中发生时伴有炎症产生,炎症反应亦会加速脑卒中的进展。
核苷酸结合寡聚化结构域受体蛋白3(NLRP3)炎症小体是介导缺血/再灌注后炎症反应的重要靶向蛋白[4]。NLRP3属于NLRs家族蛋白,在小胶质细胞、星形胶质细胞、神经元细胞、内皮细胞等神经元细胞内存在不同程度表达[5-7],能够被高糖、高脂、炎症因子、氧化应激等致病要素所激活,NLRP3被激活后与caspase-1前体和凋亡相关斑点样蛋白共同构成了炎症小体,随后被活化切割的caspase-1会招募活化更多的白细胞介素-1β(IL-1β)和IL-18[8],进一步加重了炎症反应[9]。乙醛脱氢酶2(ALDH2)作为线粒体中的关键酶蛋白[10],具有清除4-羟基壬烯醛(4-HNE)的作用,同时ALDH2可抑制NLRP3炎症小体的生成[11]。有研究[12]发现,ALDH2的活性下降后,大鼠的神经功能受损,脑梗死面积增加,加重了缺血再灌注对脑神经的损伤。ALDH2过表达可以减轻心肌细胞纤维化,减少炎症因子的生成,从而对心肌起到保护作用[13]。通过激活ALDH2在脑神经元中的表达是否可抑制神经元炎症反应发挥保护作用,目前相关报道较少。Bax介导的细胞色素c释放抑制剂(Bax channel blocker,Bcb)通过调控Bax通道抑制细胞色素c从线粒体释放,常作为凋亡抑制剂用于减轻细胞凋亡的发生[14-15]。抑制线粒体细胞色素c释放是否可通过调控炎症反应改变I/R,Bcb是否可调控脑组织ALDH2的表达目前鲜见报道。
本研究拟通过给予Bcb和ALDH2激动剂,观察此法干预对大鼠全脑I/R产生的作用,分析线粒体色素c释放抑制剂在调控线粒体ALDH2和炎症反应中发挥的保护作用。现作报道。
-
雄性SD大鼠体质量280~320 g,购于济南鹏悦实验动物繁育有限公司,动物许可证号SCXK(鲁)20190003。大鼠分笼饲养,室温控制在(25±1)℃,保持环境整洁,空气相对湿润,光线可自动控制,12 h明暗交替,给予充足的饮食、饮水。
-
ALDH2激动剂Alda-1及Bcb均购于APEX BIO。NLRP3抗体购于Affinity公司,4-HNE和ALDH2抗体购于Abcam公司;IL-1β和IL-18抗体购于R & D System公司。
-
参照Pulsinelli的四血管阻断法[16-17]模拟全脑缺血再灌注情况造模。大鼠于造模前12 h禁止进食和饮水,准备造模所需手术器械,腹腔注射10%的水合氯醛,麻醉成功后将大鼠固定于立体定位仪上,头部无偏移,剃毛消毒,确定位置在背后颈部做正中切口,玻璃分针分离第一颈椎,确定横突翼后,找到双侧横突孔位置,将加温至灼热的电烙铁头(直径0.5 mm)与切面成45°插入翼状孔,深度为2~3 mm,电凝双侧椎动脉5 s,以造成永久性闭塞。用手术线缝合,消毒。取下大鼠以仰卧位放置,剃毛消毒,在颈部正中做切口,分离双侧颈总动脉,埋线后缝合切口。结束后将大鼠放置于恒温箱恢复24 h。次日用棉球蘸取少许异氟烷,于密封箱内进行麻醉,仰卧位打开颈部切口,用动脉夹夹闭双侧颈动脉实施大鼠的全脑缺血,在20 min后取下动脉夹恢复脑部血流供应。术中大鼠的肛温控制在(37±0.5)℃。大鼠脑缺血成功的标准是瞳孔放大、发白,四肢伸直无苏醒表现。术中癫痫发作、状况不良的大鼠去除。
将大鼠共分4组,每组12只。假手术组(Sham组):大鼠封闭椎动脉,不夹闭双侧颈动脉,缺血前1 h侧脑室注射6 μL 0.9%氯化钠溶液;缺血再灌注组(I/R组):缺血前1 h侧脑室注射6 μL 0.9%氯化钠溶液,缺血20 min后恢复脑部血流供应;Alda-1+I/R组:缺血前1 h给予6 mL Alda-1(10 mg/mL)[18]侧脑室注射,全脑缺血20 min后恢复脑血流;Bcb+I/R组:缺血前1 h给予6 μL Bcb(20 mg/mL)侧脑室注射,全脑缺血20 min后恢复脑血流。采用侧脑室给药观察药物对大鼠脑I/R的影响。通过脑立体定位仪,固定大鼠,剃去毛发后在头顶正中做切口暴露颅骨确定好前囟位置。在前囟后侧0.92 mm,右侧1.5 mm用小型颅骨钻钻孔,微量进针器进针深3.5 mm。相应组别大鼠于缺血前1 h侧脑室分别注射相关药物,注射速度0.5 μL/min。注射完毕后停针5 min后将进针器缓慢拔出,缝合切口。
-
每组选取8只大鼠,7 d后,4%水合氯醛麻醉,昏迷后固定好大鼠四肢,剪开胸腔暴露心脏,将灌注针插入大鼠左心室,注入200 mL PBS溶液灌流直至大鼠眼球发白,再用200 mL 4%多聚甲醛灌流至大鼠四肢僵硬后,断头取脑,取视交叉后1~5 mm的冠状切片,取下的新鲜脑组织用组织固定液固定,48 h后梯度乙醇脱水,后放入透明剂二甲苯中透明,石蜡包埋,将组织蜡块放入切片机上,在海马平面行连续冠状切片,厚度约3 mm,在蜡块上做好编号。HE染色后的切片置于光学显微镜下观察并计数海马CA1区每毫米长度内存活的神经元数量,计算存活神经元与总细胞的比例。
-
取I/R 7 d的石蜡标本,脱蜡后再放入不同浓度乙醇中水化每次10 min,清水冲洗5 min,PBS冲洗后,80%甲醇孵育10 min,枸橼酸缓冲液在微波炉里加热至沸腾后将玻片放入10 min,等待自然冷却后PBS冲洗,重复一次待到冷却到室温。PBS冲洗2次,每次5 min。加入血清封闭液,室温孵育20 min后分别滴加一抗:NLRP3(1∶50~1∶200)和ALDH2(1∶50~1∶100),室温静置1 h后PBS冲洗3次,每次5 min。滴加二抗,PBS溶液冲洗3次,每次10 min,DAB显色10 min,在显微镜下观察确保染色成功后,双蒸水冲洗10 min终止反应,苏木精复染,流水冲洗10~15 min,最后用二甲苯脱蜡,中性树脂封片。用CaseViewer2.4软件打开后选取大鼠的海马区域200倍成像,保证背景一致无偏差。成像完成后使用Image-Pro Plus 6.0软件进行分析,统一以像素面积pixel作为标准单位,分别测量每张切片中3个视野阳性的累积吸光度值。
-
取每组4只大鼠的脑组织,大鼠在I/R 48 h后麻醉断头,放在冰面上快速分离海马CA1区,剪刀剪碎组织后加入适量的组织蛋白裂解液及适量PMSF蛋白酶抑制剂,后用匀浆器冰上研磨,冰上静置30 min后4 ℃ 14 000 g离心15 min后吸取上清液,提好的组织蛋白分装标记放入-80 ℃保存。采取BCA蛋白测定试剂盒来检测细胞总蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,转膜,封闭结束后加入一抗稀释液ALDH2(1∶6 000)、4-HNE(1∶3 000)、NLRP3(1∶500)、IL-1β(1∶1 000)、IL-18(1∶1 000),4 ℃条件下孵育24 h,加入TBST清洗3次,每次10 min,加入二抗稀释液(1∶5 000),室温孵育1 h,加入TBST清洗3次,每次10 min。滴加ECL化学发光级,曝光,显影,用Image J软件分析各条带灰度值。
-
采用单因素方差分析和q检验。
-
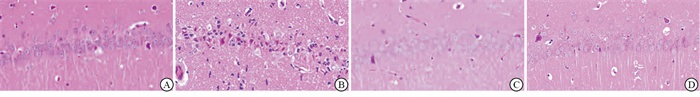
HE染色结果表明,Sham组大鼠海马CA1区神经元排列整齐,细胞核为圆形或椭圆形。核膜核仁结构完整,明显,细胞质体积较小,呈淡红色。与Sham组比较,I/R组再灌注7 d后,神经元细胞排列散乱,细胞核固缩深染,海马CA1区界限不明显,神经元的存活率明显下降(见图 1)。与I/R组比较,Alda-1+I/R组、Bcb+I/R组海马CA1区神经元存活率提高(P < 0.01)(见表 1)。
分组 n 神经元存活率/% Sham组 8 0.936±0.028 I/R组 8 0.130±0.031** Alda+I/R-1组 8 0.793±0.084**△△ Bcb+I/R组 8 0.731±0.081**△△## F — 264.28 P — < 0.01 MS组内 — 0.004 q检验:与Sham组比较**P < 0.01;与I/R组比较△△P < 0.01;与Alda-1+I/R组比较##P < 0.01 表 1 各组大鼠脑I/R后海马CA1区神经元存活率的比较(x±s)
-
与Sham组比较,I/R组7 d后,海马CA1区组织中NLRP3棕黄色阳性染色明显加深,ALDH2棕黄色阳性染色明显减弱,提示NLRP3蛋白表达增加,ALDH2蛋白表达下降(见图 2)。与I/R组比较,Alda-1+I/R组、Bcb+I/R组海马CA1区组织中NLRP3蛋白表达下降,ALDH2蛋白表达增加(P < 0.01)(见表 2)。
分组 n NLRP3 IDO ALDH2 IDO Sham组 8 0.000±0.000 0.003±0.000 I/R组 8 0.004±0.001** 0.000±0.000** Alda-1+I/R组 8 0.001±0.000*△△ 0.002±0.001△△ Bcb+I/R组 8 0.001±0.000*△△ 0.001±0.000**△△## F — 40.257 32.996 P — < 0.01 < 0.01 MS组内 — 0.000 0.000 q检验:与Sham组比较*P < 0.05,**P < 0.01;与I/R组比较△△P < 0.01;与Alda-1+I/R组比较##P < 0.01 表 2 各组大鼠脑I/R后海马CA1区NLRP3和ALDH2蛋白吸光度变化的比较(x±s)
-
Western blotting结果显示,与Sham组对比,脑I/R 48 h后海马CA1区NLRP3、IL-1β、IL-18蛋白表达增加(P < 0.01);与I/R组相比,Alda-1+I/R组、Bcb+I/R组的海马CA1区NLRP3、IL-1β、IL-18蛋白表达减少(P < 0.01),提示激动ALDH2、抑制线粒体细胞色素c释放均可引起NLRP3炎症小体和相继的炎症反应减轻(见图 3、表 3)。
分组 n IL-1β IL-18 NLRP3 ALDH2 4-HNE Sham组 8 0.486 2±0.073 3 0.246 6±0.030 9 0.508 0±0.006 4 0.787 7±0.067 4 0.739 4±0.089 5 I/R组 8 0.847 0±0.037 7** 0.615 4±0.029 1** 1.022 3±0.102 9** 0.403 6±0.050 2** 1.417 2±0.180 5** Alda-1+I/R组 8 0.650 0±0.080 9**△△ 0.381 5±0.038 4**△△ 0.642 0±0.096 4*△△ 1.068 6±0.091 3**△△ 0.491 5±0.118 8*△△ Bcb+I/R组 8 0.636 7±0.066 2**△△ 0.475 3±0.053 1**△△## 0.739 8±0.078 2**△△ 0.783 0±0.081 5△△## 0.393 6±0.063 0**△△ F — 19.77 63.31 29.22 54.07 58.06 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.004 0.002 0.007 0.006 0.015 MS组间 — 0.088 0.097 0.190 0.298 0.851 q检验:与Sham组比较*P < 0.05,**P < 0.01;与I/R组比较△△P < 0.01;与Alda-1+I/R组比较##P < 0.01 表 3 各组大鼠脑I/R后海马CA1区炎症小体相关蛋白灰度值比较(x±s)
-
脑I/R是一个常见的器官血流中断后再灌注的损伤过程[19]。缺氧条件下,海马组织是脑缺血缺氧易损伤区域[20]。本研究中,脑缺血再灌注7 d的HE染色结果显示,海马CA1区的神经元死亡的细胞明显增多,提示全脑I/R会导致海马CA1区神经元发生损伤。
近年来,越来越多的证据表明炎症小体的激活可能导致脑缺血期间神经元死亡[21]。研究[22]发现,NLRP3炎症小体激活介导的神经炎症与神经系统的疾病存在一定的关联,当NLRP3炎症小体被激活后,活化的caspase-1会导致促炎性细胞因子IL-1β、IL-18的激活,进一步损伤组织器官。本研究中,我们观察到在大鼠全脑I/R 48 h后,海马CA1区组织中炎症小体相关蛋白NLRP3及下游的IL-1β及IL-18蛋白表达增多,进一步采用免疫组织化学观察到脑I/R 7 d后海马CA1区NLRP3的阳性染色增多,提示全脑I/R后NLRP3持续存在。
线粒体膜脂质参与维持线粒体膜的完整及保障线粒体的正常功能,而活性氧的产生主要也是来源于线粒体[23]。在大鼠局灶性脑I/R损伤模型中,Alda-1处理后可抑制I/R导的脑细胞凋亡的发生及4-HNE、MDA水平的升高[24]。此外,在本研究中,我们发现在全脑I/R 48 h过后大鼠海马CA1区组织中ALDH2蛋白表达降低的同时4-HNE蛋白表达增加,提示全脑I/R引起的细胞损伤还可能与ALDH2减少、醛类代谢产物4-HNE增加等有关。
有研究[25]发现,在短暂性脑缺血再灌注模型中,通过Bcb的干预可减轻缺血再灌注过程中对脑细胞的损伤,减少Ca2+堆积、抑制活性氧的生成。我们选择Bcb以及激动ALDH2的Alda-1分析对脑缺血再灌注的影响及分析相互联系。HE染色结果显示通过Alda-1激动ALDH2及Bcb均明显提高了海马CA1区的细胞存活率。Western blotting结果表明,Alda-1和Bcb显著上调了大鼠海马CA1区细胞内ALDH2蛋白水平,降低了4-HNE、NLRP3及炎症相关因子IL-1β、IL-18的蛋白水平,提示激动ALDH2和抑制细胞色素c均可通过抑制炎症反应而发挥保护作用。
本研究中我们还观察到,Bcb能促进ALDH2的表达、抑制炎症小体关键蛋白NLRP3的生成和炎症因子的释放,而激动ALDH2亦能抑制NLRP3的表达,提示Bcb可能通过促进ALDH2的表达减少NLRP3的释放,减轻炎症反应发挥保护作用,其相关的机制需要我们进一步深入探索。
综上所述,Bcb可能通过增加ALDH2的表达、抑制NLRP3的生成减轻全脑I/R中炎症反应而发挥保护作用。
线粒体细胞色素c释放抑制剂对大鼠全脑缺血再灌注损伤炎症反应的作用
Effect of mitochondrial cytochrome c release inhibitor on the inflammatory response of rats with global cerebral ischemia reperfusion injury
-
摘要:
目的探讨线粒体细胞色素c抑制剂对大鼠全脑缺血再灌注后脑损伤的作用,分析线粒体乙醛脱氢酶2(ALDH2)和炎症反应在其中的机制。 方法通过四血管阻断法模拟大鼠全脑缺血再灌注损伤(I/R)模型,雄性SD大鼠随机分为假手术组(Sham组)、I/R组、ALDH2激动剂Alda-1+I/R组、Bax介导的线粒体细胞色素c释放抑制剂(Bcb)+I/R组。HE染色观察海马CA1区细胞形态学的变化;免疫组织化学观察海马CA1区ALDH2及炎症小体关键蛋白NLRP3表达水平,Western blotting检测海马CA1区4-HNE、NLRP3、IL-1β、IL-18及ALDH2的蛋白水平变化。 结果与Sham组比较,I/R组再灌注7 d后,I/R组海马CA1区细胞存活率明显下降;与I/R组比较,Alda-1+I/R组、Bcb+I/R组的海马CA1区神经元存活率增高(P < 0.01)。与I/R组相比,Bcb+I/R组、Alda-1+I/R组海马CA1区ALDH2蛋白表达增加,海马CA1区NLRP3、IL-1β、IL-18、4-HNE蛋白表达下降(P < 0.01)。 结论大鼠全脑缺血再灌注损伤模型中,海马CA1区NLRP3表达增高;Bcb可以通过促进线粒体ALDH2的表达、降低炎症反应发挥保护作用。 -
关键词:
- 脑缺血再灌注损伤 /
- 线粒体细胞色素c抑制剂 /
- 核苷酸结合寡聚化结构域受体蛋白3 /
- 线粒体乙醛脱氢酶2 /
- 大鼠
Abstract:ObjectiveTo explore the effects of mitochondrial cytochrome c inhibitor on the cerebral injury in rats with global cerebral ischemia-reperfusion injury, and analyze the possible mechanisms of mitochondrial aldehyde dehydrogenase 2(ALDH2)and inflammatory response. MethodsThe rat model with global cerebral ischemia and reperfusion injury(I/R) was simulated by four-vessel occlusion.The male SD rats were randomly divided into the sham group, I/R group and ALDH2 agonist Alda-1+I/R group and Bax-mediated mitochondrial cytochrome c release inhibitor(Bcb)+I/R group.The HE staining was used to observe the morphological changes of hippocampal CA1 cells.The expressions of ALDH2 protein and inflammasome-related protein NLRP3 in hippocampal CA1 were observed by immunohistochemistry.The protein changes of 4-HNE, NLRP3, IL-1β, IL-18 and ALDH2 in hippocampal CA1 were detected by Western blotting. ResultsCompared with the sham group, the survival rate of hippocampal CA1 region cells in the I/R group decreased significantly after 7 d of reperfusion(P < 0.01).Compared with the I/R group, the survival rate of hippocampal CA1 neurons in ALDA-1 +I/R group and Bcb+I/R group increased(P < 0.01).Compared with the I/R group, the expression of ALDH2 protein increased in Bcb+I/R group and ALDA-1 +I/R group, while the expressions of NLRP3, IL-1β, IL-18 and 4-HNE proteins in hippocampal CA1 region decreased(P < 0.01). ConclusionsThe expression of NLRP3 in hippocampal CA1 increases in rats with global cerebral I/R injury model.The Bcb may play a protective role by promoting the mitochondrial ALDH2 expression and reducing inflammatory response. -
表 1 各组大鼠脑I/R后海马CA1区神经元存活率的比较(x±s)
分组 n 神经元存活率/% Sham组 8 0.936±0.028 I/R组 8 0.130±0.031** Alda+I/R-1组 8 0.793±0.084**△△ Bcb+I/R组 8 0.731±0.081**△△## F — 264.28 P — < 0.01 MS组内 — 0.004 q检验:与Sham组比较**P < 0.01;与I/R组比较△△P < 0.01;与Alda-1+I/R组比较##P < 0.01 表 2 各组大鼠脑I/R后海马CA1区NLRP3和ALDH2蛋白吸光度变化的比较(x±s)
分组 n NLRP3 IDO ALDH2 IDO Sham组 8 0.000±0.000 0.003±0.000 I/R组 8 0.004±0.001** 0.000±0.000** Alda-1+I/R组 8 0.001±0.000*△△ 0.002±0.001△△ Bcb+I/R组 8 0.001±0.000*△△ 0.001±0.000**△△## F — 40.257 32.996 P — < 0.01 < 0.01 MS组内 — 0.000 0.000 q检验:与Sham组比较*P < 0.05,**P < 0.01;与I/R组比较△△P < 0.01;与Alda-1+I/R组比较##P < 0.01 表 3 各组大鼠脑I/R后海马CA1区炎症小体相关蛋白灰度值比较(x±s)
分组 n IL-1β IL-18 NLRP3 ALDH2 4-HNE Sham组 8 0.486 2±0.073 3 0.246 6±0.030 9 0.508 0±0.006 4 0.787 7±0.067 4 0.739 4±0.089 5 I/R组 8 0.847 0±0.037 7** 0.615 4±0.029 1** 1.022 3±0.102 9** 0.403 6±0.050 2** 1.417 2±0.180 5** Alda-1+I/R组 8 0.650 0±0.080 9**△△ 0.381 5±0.038 4**△△ 0.642 0±0.096 4*△△ 1.068 6±0.091 3**△△ 0.491 5±0.118 8*△△ Bcb+I/R组 8 0.636 7±0.066 2**△△ 0.475 3±0.053 1**△△## 0.739 8±0.078 2**△△ 0.783 0±0.081 5△△## 0.393 6±0.063 0**△△ F — 19.77 63.31 29.22 54.07 58.06 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.004 0.002 0.007 0.006 0.015 MS组间 — 0.088 0.097 0.190 0.298 0.851 q检验:与Sham组比较*P < 0.05,**P < 0.01;与I/R组比较△△P < 0.01;与Alda-1+I/R组比较##P < 0.01 -
[1] XU Y, WANG J, SONG X, et al. RIP3 induces ischemic neuronal DNA degradation and programmed necrosis in rat via AIF[J]. Sci Rep, 2016, 6: 29362. doi: 10.1038/srep29362 [2] XU H, ZHANG Y, REN J. ALDH2 and stroke: a systematic review of the evidence[J]. Adv Exp Med Biol, 2019, 1193: 195. [3] HAUSBURG MA, BANTON KL, ROMAN PE, et al. Effects of propofol on ischemia-reperfusion and traumatic brain injury[J]. Crit Care, 2020, 56: 281. doi: 10.1016/j.jcrc.2019.12.021 [4] CAI W, ZHANG K, LI P, et al. Dysfunction of the neurovascular unit in ischemic stroke and neurodegenerative diseases: an aging effect[J]. Ageing Res Rev, 2017, 34: 77. doi: 10.1016/j.arr.2016.09.006 [5] LI X, CHENG S, HU H, et al. Progranulin protects against cerebral ischemia-reperfusion (I/R) injury by inhibiting necroptosis and oxidative stress[J]. Biochem Biophys Res Commun, 2020, 521(3): 569 doi: 10.1016/j.bbrc.2019.09.111 [6] GEORGE PM, STEINBERG GK. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments[J]. Neuron, 2015, 87(2): 297. doi: 10.1016/j.neuron.2015.05.041 [7] 董晓庆, 丁艳平, 张晋平, 等. NLRP3炎症小体在神经血管疾病中的作用[J]. 中国免疫学杂志, 2020, 36(1): 108. doi: 10.3969/j.issn.1000-484X.2020.01.021 [8] HE Y, HARA H, NUNEZ G. Mechanism and Regulation of NLRP3 Inflammasome Activation[J]. Trends Biochem Sci, 2016, 41(12): 1012. doi: 10.1016/j.tibs.2016.09.002 [9] KELLEY N, JELTEMA D, DUAN Y, et al. The NLRP3 inflammasome: an overview of mechanisms of activation and regulation[J]. Int J Mol Sci, 2019, 20(13): 3328. doi: 10.3390/ijms20133328 [10] ZHAO Y, WANG B, ZHANG J, et al. ALDH2(Aldehyde Dehydrogenase 2) protects against hypoxia-induced pulmonary hypertension[J]. Arterioscler Thromb Vasc Biol, 2019, 39(11): 2303. doi: 10.1161/ATVBAHA.119.312946 [11] 康品方, 戎李, 孙硕, 等. 血清ALDH2和NLRP3活性水平在冠心病不同血管病变程度中的变化[J]. 蚌埠医学院学报, 2020, 45(7): 854. [12] XIA P, ZHANG F, YUAN Y, et al. ALDH 2 conferred neuroprotection on cerebral ischemic injury by alleviating mitochondria-related apoptosis through JNK/caspase-3 signing pathway[J]. Int J Biol Sci, 2020, 16(8): 1303. doi: 10.7150/ijbs.38962 [13] PANISELLO-ROSELLO A, LOPEZ A, FOLCH-PUY E, et al. Role of aldehyde dehydrogenase 2 in ischemia reperfusion injury: An update[J]. World J Gastroenterol, 2018, 24(27): 2984. doi: 10.3748/wjg.v24.i27.2984 [14] CUI G, LI Y, DING K. Attribution of Bax and mitochondrial permeability transition pore on cantharidin-induced apoptosis of Sf9 cells[J]. Pestic Biochem Physiol, 2017, 142: 91. doi: 10.1016/j.pestbp.2017.01.010 [15] GOMEZ-CRISOSTOMO NP, LOPEZ-MARURE R, ZAPATA E. Bax induces cytochrome c release by multiple mechanisms in mitochondria from MCF7 cells[J]. J Bioenerg Biomembr, 2013, 45(5): 441. doi: 10.1007/s10863-013-9508-x [16] XU Y, WANG J, SONG X, et al. Protective mechanisms of CA074-me (other than cathepsin-B inhibition) against programmed necrosis induced by global cerebral ischemia/reperfusion injury in rats[J]. Brain Res Bull, 2016, 120: 97. doi: 10.1016/j.brainresbull.2015.11.007 [17] WANG W, LIU X, LU H, et al. A method for predicting the success of Pulsinell's four-vessel occlusion rat model by LDF monitoring of cerebral blood flow decline[J]. Neurosci Methods, 2019, 328: 108439 doi: 10.1016/j.jneumeth.2019.108439 [18] LI Y, LIU SL, QI SH. ALDH2 protects against ischemic stroke in rats by facilitating 4-hne clearance and AQP4 down-regulation[J]. Neurochem Res, 2018, 43(7): 1339. doi: 10.1007/s11064-018-2549-0 [19] SEKERDAG E, SOLAROGLU I, GURSOY-OZDEMIR Y. Cell death mechanisms in stroke and novel molecular and cellular treatment options[J]. Curr Neuropharmacol, 2018, 16(9): 1396. doi: 10.2174/1570159X16666180302115544 [20] 杨青丽, 陈彦锋. 槲皮素对缺氧缺血性脑损伤新生大鼠神经再生的影响[J]. 临床儿科杂志, 2017, 35(3): 218. doi: 10.3969/j.issn.1000-3606.2017.03.016 [21] ADURIS K, JURAJDA M. Evolutionary concept of inflammatory response and stroke[J]. Neurosci Res, 2020, 98(1): 98. doi: 10.1002/jnr.24392 [22] 曾雪, 王龙, 赖玉洁, 等. 木犀草素通过抑制Drp1活性改善自噬流过程减少脑缺血再灌注后氧化应激损伤[J]. 第三军医大学学报, 2020, 42(18): 1777. [23] WANG Y, ZHANG J, LI B. Proteomic analysis of mitochondria: biological and clinical progresses in cancer[J]. Expert Rev Proteomics, 2017, 14(10): 891. doi: 10.1080/14789450.2017.1374180 [24] FU SH, ZHANG HF, YANG ZB, et al. Alda-1 reduces cerebral ischemia/reperfusion injury in rat through clearance of reactive aldehydes[J]. Naunyn Schmiedebergs Arch Pharmacol, 2014, 387(1): 87. doi: 10.1007/s00210-013-0922-8 [25] ANDREYEV A, TAMRAKAR P, ROSENTHAL RE, et al. Calcium uptake and cytochrome c release from normal and ischemic brain mitochondria[J]. Neurochem Int, 2018, 117: 15 doi: 10.1016/j.neuint.2017.10.003 -





 下载:
下载: