-
前列腺癌(prostate cancer,PCa)是男性泌尿系统肿瘤中最常见的恶性肿瘤之一。据2018年全球癌症统计报告显示,新增PCa病人占男性癌症新发的13.5%[1]。早期发现和诊断PCa有利于病人的预后。临床中常用的直肠指检仅能初步判定前列腺大小及表面质地情况;前列腺特异性抗原(prostate-specific antigen,PSA)检测特异性不强,其在前列腺增生、前列腺炎中也有升高[2];经直肠超声引导活检则不良反应较大,多参数磁共振成像作为一种非
侵袭性的方法越来越受欢迎[3]。磁共振成像的软组织分辨力高,并且可以将形态学和功能成像结合起来从而提高PCa的诊断精确性[4]。PCa的风险评估对指导治疗方式具有重要意义,磁共振影像组学是借助计算机辅助诊断技术利用特征分析将传统医学影像转化为大量可挖掘的数据特征,通过机器学习算法建立分类模型,可以无创评估PCa进展风险。基于此,本研究对T2WI和ADC图的影像组学模型能否鉴别出高危和中低危PCa进行分析。现作报道。
-
回顾性收集蚌埠医学院第一附属医院2017年6月至2020年7月经病理证实的PCa病人265例。纳入标准:经穿刺或手术病理证实为PCa;采用同一台设备进行MRI检查。排除标准:合并有其他恶性肿瘤及相关病史;由于运动伪影导致的图像质量差;既往接受过激素、放射、冷冻或手术治疗病人。
根据美国国家综合癌症网络(national comprehensive cancer network,NCCN)指南,将临床分期≥T3a,PSA>20 ng/mL,或gleason评分≥8分定义为高危PCa[5]。本研究参照NCCN指南进行危险划分,其中高危PCa病人(高危组)155例,中低危PCa病人(中低危组)110例。高危组年龄53~84岁,PSA为14.3(8.6,29.5)ng/mL;中低危组年龄53~84岁,PSA为9.3(6.4,14.7)ng/mL,2组年龄和PSA水平具有可比性。
-
影像学设备:PHILIPS Achieva3.0T TX MR成像仪,16通道腹部相控阵线圈, Extended MR Work Space后处理工作站。(1)常规平扫:T1WI、T2WI采用TSE序列,扫描范围包括整个前列腺及精囊腺。横轴位T1WI:TR/TE=674 ms/20 ms;横轴位及冠状位压脂T2WI:TR/TE=4 682 ms/100 ms,层厚4.0 mm,层间距0,FOV=260 mm×260 mm。(2)DWI:单次激发自旋平面回波序列(EPI),b值选用0、1 000 s/mm2,TR/TE=3 000 ms/56 ms,层厚4.0 mm,层间距0,FOV=260 mm×260 mm,由b=800 s/mm2图像自动重建出ADC图。检查前准备:注意常规MR检查禁忌;检查前一天无需肠道准备;检查前适度充盈膀胱。
-
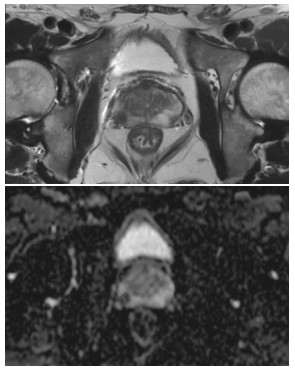
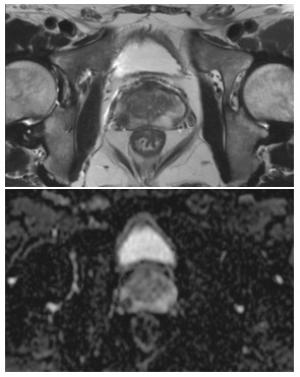
由一名三年以上工作经验的诊断医师对感兴趣区(ROI)进行手动分割,病灶的分割在达尔文智能科研平台(http://www.yizhun-ai.com)进行,勾画者事先对病人资料不了解。分别在T2WI和ADC图上对病灶最大层面沿病灶边缘勾画ROI(见图 1)。病灶的提取是在勾画完成后通过达尔文智能科研平台自动提取,包括直方图、熵值等一阶特征,灰度共生矩阵(GLCM)、灰度游程矩阵(GLRLM)等二阶纹理特征参数,通过对原始图像进行滤波处理,得到基于指数、LOG、平方、对数、小波变换等滤波器特征,每个序列各提取出939个特征,共计2 817个特征。
-
为了防止建立模型的过拟合,需要对提取出的特征进行降维。首先采取最小最大绝对值归一化进行数据的标准化预处理,将每一维度的特征值拉伸到[0, 1]之间。通过方差分析(ANOVA)的方法评价高危与中低危的线性相关性,保留排序在前100位的特征;使用LASSO-logistic回归对剩余特征进行筛选,通过5折交叉验证筛选出最优的10个特征。
-
采用随机分层抽样方法将病例按7∶ 3比例分为训练队列(n=182)和验证队列(n=83),对训练队列构建模型后,使用测试集做内部验证。考虑到2组样本量的差异,在训练分类模型时予以加权处理。将加权后的训练集数据通过支持向量机(support-vector machine,SVM)分别建立T2WI、ADC图及T2WI联合ADC图的影像组学模型,采用AUC值评价训练队列与验证队列模型的预测效能。
-
采用t检验、秩和检验和受试者工作特征(receiver operating characteristic,ROC)曲线分析。
-
训练队列病人182例(高危PCa 106例,中低危PCa 76例),验证队列83例(高危PCa 49例,中低危PCa 34例)。训练队列和验证队列病人年龄、PSA差异均无统计学意义(P>0.05)(见表 1)。
分组 n 年龄(x±s)/岁 PSA/(ng/mL) 高危组 训练队列 106 69.3±6.9 14.5(8.1,29.9) 验证队列 49 68.9±7.3 13.0(9.8,28.6) t — 0.33 0.24* P — >0.05 >0.05 中低危组 训练队列 76 68.4±7.0 9.5(6.9,15.1) 验证队列 34 66.2±8.3 8.5(5.7,14.1) t — 1.73 0.92* P — >0.05 >0.05 *示秩和检验 表 1 训练队列与验证队列病人一般资料比较[M(P25,P75)]
-
本研究提取高危和中低危PCa病人ADC图和T2WI序列各939个特征,利用LASSO回归模型最后得到10个影像组学特征用于构建组学模型,其中包括6个ADC特征,4个T2WI特征(见图 2)。
-
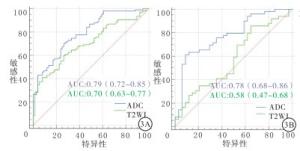
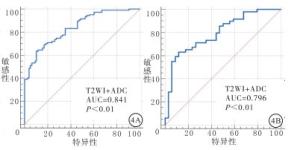
影像组学模型仅使用T2WI特征预测效能一般,训练队列ROC曲线下面积(AUC)为0.70(95%CI 0.63~0.77),验证队列为0.58(95%CI 0.47~0.68)。使用ADC图像预测效能较好,训练队列AUC为0.79(95%CI 0.72~0.85),验证队列AUC为0.78(95%CI 0.68~0.86)(见图 3)。T2WI联合ADC图构建的影像组学模型表现出最优的预测效能,训练队列AUC为0.84(95%CI 0.78~0.89),验证队列AUC为0.80(95%CI 0.69~0.88)(见图 4)。
-
近年来,PCa发病率有所增加,临床中高危PCa病人占17%~31%,与中低危PCa相比,高危PCa病人具有显著死亡风险,10年生存率约为28.8%[6]。中低危PCa病人中部分疾病进展缓慢,定期的直肠指检或PSA监测即可。前瞻性实验显示,主动监测具有较好的长期结果,且因癌症死亡或转移的风险较小,避免了治疗的不良反应,但具有不良风险的PCa病人需要进行积极治疗[7-11]。以往临床结果显示,中低危PCa通过根治性手术能达到较好的预后,但高危PCa由于根治性手术并发症较多,包括尿失禁、尿潴留、性功能损害、尿路感染和盆腔感染等[12],术后切缘阳性率及淋巴结转移率较高,所以一般不主张进行PCa根治术治疗,而是选择放疗或者内分泌治疗。放疗联合雄激素剥夺治疗作为高危PCa的标准治疗方式,是NCCN主要推荐治疗方式之一,可以有效达到控制高危PCa和提高整体生存率。近些年针对高危PCa病人倡导以手术治疗、放化疗和内分泌治疗相互结合的多元治疗方案。
本研究基于双参数MRI影像组学方法对PCa病人的危险程度进行预测,研究采用LASSO回归算法,对高通量的组学特征进行降维处理,将939个特征最终简化为10个潜在的影响因素,将选定的组学特征组合对PCa进行危险分类。本研究中,基于T2WI的影像组学模型预测效能一般,训练队列及验证队列均较低,这与GONG等[13]研究一致。这可能是由于T2WI主要反映前列腺的解剖结构,对肿瘤结构的异质性较难区分。但也有研究报道,T2WI上获得的对比度和同质性GLCM纹理特征,在与Gleason的相关性方面优于ADC参数[14]。ADC图训练的组学模型对高危PCa的预测效能较好,先前的研究中显示DWI建立的组学模型具有良好的结果[13]。由于ADC图来自DWI序列,主要反映了病变周围水分子的流动性,受细胞密度、膜完整性和微结构异质性等多种因素的影响,在反映前列腺病变中更精确[15]。T2WI和ADC图联合构建的组学模型诊断效能最高,训练组AUC为0.84,验证组AUC为0.80,本研究中筛选的10个特征中ADC熵是排在首位的,这反映了该特征与肿瘤的风险评估密切相关,熵值主要反映ROI区域内不同像素强度的数量,熵值越高疾病风险可能越高。研究中特征相关程度较高还有偏斜度,其通过测量ROI区域内像素强度直方图的不对称性表示平均值周围像素强度的对称性。从ADC和T2WI提取的纹理特征极大提高了分类性能,可对Gleason评分进行较为准确地划分,较高Gleason评分与相对较高的ADC熵和较低ADC能量相关[16]。有研究建立组学模型鉴别高危和非高危病人的PCa是否向外扩散,但是预测效能一般[17],这可能与研究采用随机森林算法相关,本研究采用SVM机器学习算法表现出较好的预测价值,基于SVM在Gleason分级(例如3级和4级)的优越性已经有报道[18]。影像组学可以通过双参数磁共振图像无创地量化肿瘤的异质性,对肿瘤发展的不同时期进行辅助评估,指导临床决策。
目前PCa的诊断是基于组织学和影像学表现的结合,磁共振图像影像组学提供了客观、非侵入性分层的可能性,但在前列腺成像中的效用证据有限,需要未来更大样本量的前瞻性研究来验证在PCa诊断和分层具有潜力的结构特征[19]。本研究亦存在一定的局限性:(1)研究采取单中心回顾性分析,没有采用外部数据验证;(2)仅采用了T2WI和ADC,对于联合其他序列的诊断价值需要进一步研究;(3)ROI手动勾画存在差异,应尽可能使用自动勾画减少差异;(4)未将PI-RADS评分纳入研究;(5)对DWI采用的b值为1 000 s/mm2,在未来的研究中,应考虑更高b值的诊断价值。
综上,本研究构建的影像组学模型可在一定程度上对中低危及高危PCa病人进行区分,为PCa的分期提供了一种无创的预测方式,有助于指导治疗方案的选择。
磁共振影像组学在鉴别中低危和高危前列腺癌中的应用
Application of magnetic resonance imaging in differentiating low-and medium-risk prostate cancer from high-risk prostate cancer
-
摘要:
目的建立基于支持向量机学习算法的影像组学模型,研究其鉴别高危前列腺癌与中低危前列腺癌的诊断效能。 方法回顾性分析265例经病理证实的前列腺癌病人,其中高危病人155例,中低危病人110例。所有病人术前均进行MRI检查。由两位放射医师使用达尔文智能科研平台手动勾画感兴趣区,从每例病人的T2WI和ADC图中分别提取影像组学特征,采用受试者工作特征(ROC)曲线及ROC曲线下面积(AUC)验证影像组学特征的鉴别效能,对比T2WI、ADC及T2WI+ADC的诊断价值。 结果共筛选出10个影像组学特征(6个ADC序列特征,4个T2WI序列特征)可以用来鉴别高危及中低危前列腺癌。仅使用T2WI获得的组学模型鉴别效能较低,训练队列AUC为0.70(95%CI 0.63~0.77),验证队列AUC为0.58(95%CI 0.47~0.68)。ADC图组学模型预测效能较好,训练队列AUC为0.79(95%CI 0.72~0.85),验证队列AUC为0.78(95%CI 0.68~0.86)。T2WI联合ADC图构建的影像组学模型表现出最优预测效能,训练队列AUC为0.84(95%CI 0.78~0.89),验证队列AUC为0.80(95%CI 0.69~0.88)。 结论本研究构建的基于T2WI和ADC图的影像组学模型在一定程度上对中低危及高危前列腺癌病人进行区分,为前列腺癌的分期提供了一种无创的预测方式,指导治疗方案的选择。 Abstract:ObjectiveTo establish a radiomic model based on SVM learning algorithm to evaluate the diagnostic efficiency in differentiating high-risk prostate cancer(PCa) from low-and medium-risk PCa. Methods265 patients with PCa confirmed by histopathologic results were analyzed retrospectively, including 155 high risk patients and 110 low-and medium-risk patients.All patients were examined by MRI before operation.Regions of interest(ROIs)were manually delineated by two radiologists using DARWIN research platform, and the radiomic features were extracted from each segmented ROI of the T2WI and ADC images.The Receiver Operating Characteristic(ROC) curve and the area under the ROC curve(AUC) were used to validate the differential diagnosticefficiency of radiomic features, and the diagnostic performance of T2WI, ADC and T2WI+ADC were compared. ResultsA total of 10 radiomic features were selected to identify high-risk, low-and medium-risk prostate cancer.The classification performance of the T2WI-based radiomic model was not satisfying with an AUC of 0.70(95%CI 0.63-0.77) in the training set and 0.58(95%CI 0.47-0.68) in the validation set.ADC-based model performed better with the training set achieved AUC of 0.79(95%CI 0.72-0.85) and 0.78(95%CI 0.68-0.86) of the validation set.The ensemble model constructed by both T2WI and ADC achieved the highest predictive AUCs, 0.84(95%CI 0.78-0.89) for training set and 0.80(95%CI 0.69-0.88) of the validation. ConclusionsThe radiomic model based on T2WI and ADC maps distinguished patients with different levels of prostate cancer risk to a certain extent, which provides a non-invasive prediction method for the classification and treatment guidance of Pca. -
Key words:
- prostate cancer /
- radiomics /
- magnetic resonance imaging /
- risk stratification /
- support vector machine
-
表 1 训练队列与验证队列病人一般资料比较[M(P25,P75)]
分组 n 年龄(x±s)/岁 PSA/(ng/mL) 高危组 训练队列 106 69.3±6.9 14.5(8.1,29.9) 验证队列 49 68.9±7.3 13.0(9.8,28.6) t — 0.33 0.24* P — >0.05 >0.05 中低危组 训练队列 76 68.4±7.0 9.5(6.9,15.1) 验证队列 34 66.2±8.3 8.5(5.7,14.1) t — 1.73 0.92* P — >0.05 >0.05 *示秩和检验 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. A Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394. doi: 10.3322/caac.21492 [2] GEORGE AK, TURKBEY B, VALAYIL SG, et al. A urologist's perspective on prostate cancer imaging: past, present, and future[J]. Abdom Radiol(NY), 2016, 41(5): 805. doi: 10.1007/s00261-016-0751-6 [3] OBERLIN DT, CASALINO DD, MILLER FH, et al. Dramatic increase in the utilization of multiparametric magnetic resonance imaging for detection and management of prostate cancer[J]. Abdom Radiol(NY), 2017, 42(4): 1255. doi: 10.1007/s00261-016-0975-5 [4] WANG S, BURTT K, TURKBEY B, et al. Computer aided-diagnosis of prostate cancer on multiparametric MRI: a technical review of current research[J]. Biomed Res Int, 2014, 2014: 789561. [5] MOHLER JL, ANTONARAKIS ES, ARMSTRONG AJ, et al. Prostate Cancer, Version 2.2019, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2019, 17(5): 479. doi: 10.6004/jnccn.2019.0023 [6] MORIS L, CUMBERBATCH MG, VAN DEN BROECK T, et al. Benefits and risks of primary treatments for high-risk localized and locally advanced prostate cancer: an international multidisciplinary systematic Review[J]. Eur Urol, 2020, 77(5): 614. doi: 10.1016/j.eururo.2020.01.033 [7] MOSCHINI M, CARROLL PR, EGGENER SE, et al. Parker C. Low-risk prostate cancer: identification, management, and outcomes[J]. Eur Urol, 2017, 72(2): 238. doi: 10.1016/j.eururo.2017.03.009 [8] SOSNOWSKI R, KAMECKI H, DANESHMAND S, et al. Active surveillance for low-risk prostate cancer-in pursuit of a standardized protocol[J]. Cent European J Urol, 2020, 73(2): 123. [9] TOSOIAN JJ, MAMAWALA M, EPSTEIN JI, et al. Active surveillance of grade group 1 prostate cancer: long-term outcomes from a large prospective cohort[J]. Eur Urol, 2020, 77(6): 675. doi: 10.1016/j.eururo.2019.12.017 [10] HAMDY FC, DONOVAN JL, LANE JA, et al. 10-year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer[J]. N Engl J Med, 2016, 375(15): 1415. doi: 10.1056/NEJMoa1606220 [11] BUTLER SS, MAHAL BA, LAMBA N, et al. Use and early mortality outcomes of active surveillance in patients with intermediate-risk prostate cancer[J]. Cancer, 2019, 125(18): 3164. doi: 10.1002/cncr.32202 [12] JANG TL, PATEL N, FAIENA I, et al. Comparative effectiveness of radical prostatectomy with adjuvant radiotherapy versus radiotherapy plus androgen deprivation therapy for men with advanced prostate cancer[J]. Cancer, 2018, 124(20): 4010. doi: 10.1002/cncr.31726 [13] GONG L, XU M, FANG M, et al. Noninvasive prediction of high-grade prostate cancer via biparametric MRI radiomics[J]. J Magn Reson Imaging, 2020, 52(4): 1102. doi: 10.1002/jmri.27132 [14] VIGNATI A, MAZZETTI S, GIANNINI V, et al. Texture features on T2-weighted magnetic resonance imaging: new potential biomarkers for prostate cancer aggressiveness[J]. Phys Med Biol, 2015, 60(7): 2685. doi: 10.1088/0031-9155/60/7/2685 [15] ALGOHARY A, SHIRADKAR R, PAHWA S, et al. Combination of peri-tumoral and intra-tumoral radiomic features on bi-parametric MRI accurately stratifies prostate cancer risk: a multi-site study[J]. Cancers(Basel), 2020, 12(8): 2200. [16] FEHR D, VEERARAGHAVAN H, WIBMER A, et al. Automatic classification of prostate cancer Gleason scores from multiparametric magnetic resonance images[J]. Proc Natl Acad Sci U S A, 2015, 112(46): E6265. doi: 10.1073/pnas.1505935112 [17] LOSNEGÅRD A, REISÆTER LAR, HALVORSEN OJ, et al. Magnetic resonance radiomics for prediction of extraprostatic extension in non-favorable intermediate- and high-risk prostate cancer patients[J]. Acta Radiol, 2020, 61(11): 1570. doi: 10.1177/0284185120905066 [18] SAHRAN S, ALBASHISH D, ABDULLAH A, et al. Absolute cosine-based SVM-RFE feature selection method for prostate histopathological grading[J]. Artif Intell Med, 2018, 87: 78. doi: 10.1016/j.artmed.2018.04.002 [19] PATEL N, HENRY A, SCARSBROOK A. The value of MR textural analysis in prostate cancer[J]. Clin Radiol, 2019, 74(11): 876. doi: 10.1016/j.crad.2018.11.007 -




 下载:
下载: