-
乳腺癌是女性常见的恶性肿瘤之一[1],近年来综合治疗方法如治疗乳腺癌的围手术期化疗和基因治疗蓬勃发展,乳腺癌的疗效有了很大提高,但是肿瘤转移和侵袭的存在导致病人的生存率依然不高,深入研究促进乳腺癌细胞增殖、迁移和转移的分子机制对病人的诊断和预后具有重要意义。microRNA(miRNA)的异常表达在肿瘤的发生与发展过程中起到重要作用,miRNA是一种非常小的RNA分子,通过直接作用于mRNA的3′-UTR来抑制其表达[2]。miRNA即可作为一种致癌因子也可作为一种抑癌因子[3],可以调控癌细胞的增殖、侵袭、迁移和凋亡等生物学活动[4]。miRNA-18b在结直肠癌[5]、卵巢癌[6]、乳腺癌[7]等肿瘤中异常表达的报道表明,其通过调节关键蛋白的表达,影响肿瘤的增殖与侵袭,但其在乳腺癌中的作用及其基本的分子机制目前尚不完全清楚。
外泌体是一种细胞分泌的直径40~100 nm的微小囊泡,可通过细胞分泌到受体,通过向靶细胞转移各种生物活性分子如膜受体、蛋白质、核酸(mRNA、miRNA及其他非编码RNA)[8]作为信号分子传递给其他细胞,特别是外泌体可以携带参与癌细胞增殖、分化和凋亡的miRNA[9],且外泌体中的特异性miRNA水平升高与癌症进展有关[10]。如乳腺癌来源外泌体miR-448通过靶向NEAT1促进乳腺癌细胞的迁移和侵袭[11]。但是,外泌体携带的miR-18b-5p在各类型癌症中的作用鲜见探究。靶基因预测软件发现神经前体细胞表达下调蛋白9(NEDD9)可能是miR-18b-5p的靶基因。已知NEDD9是一种转录因子,在多种类型的癌症如乳腺癌[12]、胶质瘤[13]等中发挥功能,抑制NEDD9表达会促进肿瘤发生[14]。本研究探讨乳腺癌细胞来源外泌体对乳腺癌细胞增殖、迁移和侵袭的影响,进一步验证乳腺癌细胞外泌体中的miRNA-18b-5p通过靶向调控NEDD9对乳腺癌细胞的增殖、迁移和侵袭的作用,从而为乳腺癌的治疗及预后提供实验依据。
-
乳腺癌上皮细胞MCF-10A和乳腺癌细胞株SKBR-3购自中国科学院细胞库;胎牛血清和DMEM高糖培养基购自Hlyclone公司;Trizol试剂和Lipofectamine2000购自Invitrogen公司;miR-18b-5p inhibitor、miR-18b-5p mimics和靶向NEDD9的过表达载体以及PCR所用引物均购自上海GenePharma公司;荧光定量聚合酶链反应(qRT-PCR)试剂购自Takara公司;所有引物合成由南京金斯瑞生物科技有限公司合成;荧光素酶试剂盒(Promega, 美国);BCA蛋白含量检测试剂盒和细胞凋亡试剂盒(凯基,中国);无外泌体血清(SBI,美国);一抗CD63、TSG101、NEDD9及二抗购自Affinity公司;CCK8试剂盒购自吉玛公司;Transwell小室购自Corning公司。
-
用紫杉醇诱导SKBR-3细胞耐药性的产生,使SKBR-3细胞处于25 μg/mL的浓度中稳定生长。乳腺癌细胞株接种于含10%胎牛血清的DMEM培养基中,在37℃、5% CO2和95%饱和湿度条件下的培养箱中培养。其乳腺癌细胞生长至细胞融合度达到60%~70%密度时,用无外泌体血清培养基培养,48 h后,收集细胞上清液并储存于-80 ℃直至实验使用。
-
正常乳腺癌上皮细胞MCF-10A及乳腺癌细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基置于37 ℃、5% CO2培养箱中传代培养。待细胞密度达到80%时,更换为无外泌体血清培养基。收集细胞培养上清液于室温2 000 g 4 ℃离心30 min;收集上清液继续在10 000 g 4 ℃离心30 min;最后得到上清液再100 000 g 4 ℃离心70 min。将沉淀重悬于1×PBS中,使用0.22 μm孔径过滤器过滤。继续100 000 g 4 ℃离心70 min。弃去上清液,1×PBS重悬,放入-80℃冰箱保存备用。采用Western blotting检测外泌体标志物CD63和TSG101的表达, 对所提取的外泌体进行分析。
-
SKBR-3/PR细胞转染miR-18b-5p inhibitor后,提取外泌体,与SKBR-3细胞共培养。分组为: NC组和miR-18b-5p inhibitor组。取不同分组细胞100 μl置于上室,下室加入含10%胎牛血清的DMEM 600 μL, 培养24 h取出小室,4%甲醛固定,吉姆萨染色并计数。
-
将处于对数生长期的SKBR-3细胞接种于96孔板(细胞密度为1×104个/孔),置于37 ℃恒温培养箱中培养24、48和72 h后向每孔加入10 mL CCK-8溶液,置于37 ℃恒温培养箱中连续培养3 d,根据CCK-8试剂盒说明书检测细胞增殖情况,酶标仪检测并记录450 nm波长处吸光度值。
-
qRT-PCR检测MCF-10A细胞和2种乳腺癌细胞SKBR-3和SKBR-3/PR中miR-18b-5p表达水平。上述细胞中加入Trizol裂解液获得总RNA。在提取总RNA时按照说明书进行实时荧光定量PCR法,95 ℃预变性10 min,95 ℃ 15 s, 60 ℃ 30 s,72 ℃ 34 s,40个循环。获得的数据运用2-ΔΔCt的方法计算表达量。以U6作为内参。引物序列见表 1。
基因名称 上游序列 下游序列 miR-18b-5p TGA GCC ACA GCA CCT T ACG UGA UCU ACG UGG AA U6 CTC GCT TCG GCA GCA CA AAC GCT TCA CGA ATT TGC GT 表 1 引物序列
-
收集处于对数生长期的SKBR-3细胞,加入RIPA裂解液,冰浴30 min,4 ℃条件下经12 000 r/min离心30 min,提取细胞总蛋白。采用BCA法测定蛋白浓度。取30 μg蛋白样品与上样缓冲液充分混匀后点样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜、封闭,加入CD63、TSG101一抗稀释液(1∶1 000),4 ℃孵育24 h,洗膜,加入二抗稀释液(1∶2 000)室温孵育2 h,ECL显影,应用Image J软件分析蛋白条带灰度值。
-
首先将NEDD9 3′-UTR序列进行扩增,构建NEDD9野生型3′-UTR荧光素酶质粒pmirGLO-WT和突变型质粒pmirGLO-Mut。将pmirGLO-WT、pmirGLO-Mut与miR-18b-5p模拟物和阴性对照转染进SKBR-3细胞,24 h后去除培养基,以PBS清洗细胞3次,弃去PBS,每孔加入100 μL被动裂解液,室温下将培养板置于平板摇床上,轻微晃动15 min。待细胞裂解后,将每组20 μL样本转移至发光用96孔板上,并置于超级酶标仪的检测板上,分别分装100 μL的LARⅡ和Stop & Glo试剂。测量时,使用1~2 s延迟和5~10 s读数。如此循环操作直至所有样本检测完毕。使用酶标仪配套软件分析结果。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
-
对SKBR-3转染NEDD9过表达序列,实验分为NC组和NEDD9过表达组。通过Transwell实验检测NEDD9对细胞侵袭和迁移的影响。具体操作同前。
-
采用t检验、单因素方差分析和q检验。
-
与正常乳腺癌上皮细胞MCF-10A比较,乳腺癌细胞系中miR-18b-5p相对高表达(P < 0.01),其中在SKBR-3/PR细胞中表达量最高(P < 0.01) (见表 2)。
分组 n miR-18b-5p F P MS组内 MCF-10A组 3 1.02±0.04 SKBR-3组 3 1.74±0.03** 19.35 < 0.01 0.294 SKBR-3/PR组 3 2.86±0.11## q检验: 与MCF-10A组比较**P < 0.01;与SKBR-3组比较##P < 0.01 表 2 在MCF-10A、SKBR-3和SKBR-3/PR细胞中miR-18b-5p表达水平比较(x±s)
-
外泌体组CD63和TSG101表达均高于对照组(P < 0.01)(见表 3)。
分组 n CD63 TSG101 细胞对照组 3 1.00±0.04 1.00±0.02 外泌体组 3 1.47±0.03 1.86±0.05 t — 10.24 22.13 P — < 0.01 < 0.01 表 3 外泌体蛋白标志物CD63、TSG101的表达(x±s)
-
inhibitor对SKBR-3细胞迁移能力的影响与NC组比较,转染了miR-18b-5p inhibitor的SKBR-3/PR细胞外泌体组SKBR-3细胞侵袭与迁移能力明显降低(P < 0.01)(见表 4), 表明下调miR-18b-5p能抑制SKBR-3细胞侵袭、迁移能力。
分组 n 细胞数 迁移率/% NC组 3 272±8.25 0.69±0.03 miR-18b-5p inhibitor组 3 176±5.34 0.42±0.01 t — — 26.40 P — — < 0.01 表 4 miR-18b-5p inhibitor对SKBR-3细胞迁移能力的影响(x±s)
-
inhibitor对SKBR-3细胞增殖的影响相对于NC组,转染了miR-18b-5p inhibitor的SKBR-3/PR细胞外泌体组抑制细胞的增殖(P < 0.01)(见表 5),表明下调miR-18b-5p可抑制SKBR-3细胞增殖能力。
分组 n 24 h 48 h 72 h NC组 3 0.84±0.03 1.72±0.04 2.28±0.11 miR-18b-5p inhibitor组 3 0.57±0.02 1.16±0.02 1.49±0.07 t — 4.7 12.35 6.82 P — < 0.01 < 0.01 < 0.01 表 5 miR-18b-5p inhibitor对SKBR-3细胞的增殖抑制作用(x±s)
-
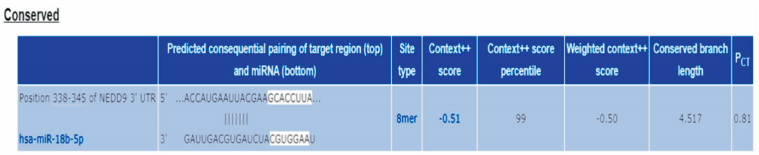
生物信息学软件Target Scan预测结果显示,NEDD9 3′UTR上存在潜在的与miR-18b-5p靶向结合的位点(见图 1),说明NEDD9可能是miR-18b-5p的靶基因。根据双荧光素酶活性检测结果显示,与NC组比较,miR-18b-5p mimic组wt-NEDD9细胞中荧光素酶活性降低(P < 0.05),而mut- NEDD9细胞中荧光素酶活性不受影响(P>0.05)(见表 6)。
分组 n wt-NEDD9 mut-NEDD9 NC组 3 0.98±0.07 0.94±0.06 miR-18b-5p mimic组 3 0.64±0.16 0.96±0.04 t — 3.18 0.72 P — < 0.05 >0.05 表 6 双荧光素酶报告实验(x±s)
-
与NC组比较,NEDD9过表达组侵袭的细胞与迁移能力明显降低(P < 0.01)(见表 7),过表达NEDD9能够显著抑制SKBR-3细胞侵袭、迁移能力。
分组 n 细胞数 迁移率/% NC组 3 316±7.39 0.72±0.03 NEDD9过表达组 3 224±4.26 0.56±0.01 t — — 30.58 P — — < 0.01 表 7 过表达NEDD9对SKBR-3侵袭、迁移能力的影响(x±s)
-
乳腺癌是成年女性最常见的恶性肿瘤,发病率较高,也是女性最常见的死亡原因之一[14]。虽然通过化疗使非转移性病人5年存活率达到60%~70%,但因化疗药物不良反应较大并且容易发生耐药,所以找到一种更有前途的治疗策略是非常迫切和必要的。外泌体近年来成为研究热点,其在肿瘤的发生、发展与转移过程中起到重要作用。肿瘤细胞分泌的外泌体携带特异性小分子或RNA,能够影响其他细胞的生物学功能,从而调节癌症进程[15]。miRNAs因其能够作为癌症生物标志物,以及与肿瘤发生、细胞增殖、分化和凋亡等多种生理和病理发展密切相关而备受关注[16-17]。同时靶向关键调节基因和异常表达的miRNA可能是预防恶性肿瘤转移的有效策略,因此miRNA可充当一种有效的分子靶向药物对肿瘤进行治疗[18]。研究[19]表明miR-18b-5p在胆囊中过表达并作为转移形成的重要介质。XUE等[6]发现miR-18b-5p在卵巢癌中呈过表达并靶向VMA21促进肿瘤的增殖、侵袭和迁移。LI等[5]提出上调miR-18b-5p可通过下调Akt途径促进结直肠癌细胞的生长,而miR-18b-5p在乳腺癌中的表达及作用有待研究。
本研究通过qRT-PCR检测了miR-18b-5p在乳腺癌细胞SKBR-3和SKBR-3/PR和正常乳腺癌上皮细胞MCF-10A中的表达情况,结果表明miR-18b-5p在2种乳腺癌细胞系中的表达水平均明显增高,随后选取SKBR-3/PR细胞提取外泌体,并将外泌体与SKBR-3细胞共培养,发现转染miR-18b-5p inhibitor外泌体对SKBR-3细胞增殖、侵袭和迁移能力显著降低,表明miR-18b-5p具有调控SKBR-3细胞的能力。Target Scan靶基因预测软件证明NEDD9是miR-18b-5p的靶基因之一,荧光素酶报告基因实验结果表明miR-18b-5p通过靶向结合NEDD9的3′-UTR,继而抑制了NEDD9的表达,提示NEDD9可能是乳腺癌潜在的治疗靶点。过表达NEDD9可抑制乳腺癌细胞SKBR-3的侵袭与迁移能力。因此,外泌体中的miR-18b-5p可能通过靶向NEDD9调控乳腺癌SKBR-3细胞增殖、侵袭、迁移。NEDD9是核受体家族的一员,在肺癌组织与肺癌细胞系中低表达,而且NEDD9的减少与肿瘤进展和肺癌预后不良有关[20]。WANG等[21]研究表明NEDD9可以调节并控制肝癌的侵袭。同时,有研究[22]发现,NEDD9在胃癌中呈低表达并抑制胃癌细胞增殖。miRNA通常通过靶向调控下游mRNA,影响其在细胞中的水平,进而调控细胞生物学功能。本研究证实了外泌体miR-18b-5p可靶向调控NEDD9。由于NEDD9介导了细胞的接触抑制作用,抑制了肿瘤细胞的转移和增殖,因此NEDD9蛋白表达被抑制后乳腺癌细胞的增殖与侵袭能力增强,促进了乳腺癌的转移。
综上所述,miR-18b-5p在SKBR-3/PR来源的外泌体中高表达,外泌体通过上调SKBR-3细胞中miR-18b-5p水平靶向抑制NEDD9表达,促进SKBR-3细胞的增殖、迁移、侵袭,因此miR-18b-5p可能是乳腺癌治疗的潜在分子靶点,为乳腺癌的诊断和治疗带来了积极影响。
外泌体介导的miR-18b-5p调控NEDD9对乳腺癌细胞增殖、迁移、侵袭的影响
Study on the exosome-mediated miR-18b-5p in promoting the proliferation, migration and invasion of breast cancer cells by regulating NEDD9
-
摘要:
目的探讨miR-18b-5p调控神经前体细胞表达下调蛋白9(NEDD9)对乳腺癌细胞侵袭、迁移的影响及其作用机制。 方法qRT-PCR检测人正常乳腺癌上皮细胞MCF-10A与2株乳腺癌细胞株(SKBR-3和SKBR-3/PR)中miR-18b-5p的表达水平;Western blotting检测SKBR-3/PR细胞来源外泌体的表面标志物;CCK8和Transwell实验检测SKBR-3/PR细胞转染miR-18b-5p inhibitor并提取的外泌体与SKBR-3细胞共培养后对SKBR-3细胞增殖和侵袭、迁移能力。生物信息学预测软件Target Scan预测miR-18b-5p与NEDD9的靶向结合位点。双荧光素酶实验分析miR-18b-5p与NEDD9的靶向调控关系。Transwell实验检测上调NEDD9对SKBR-3细胞侵袭迁移能力的影响。 结果miR-18b-5p在乳腺癌细胞株中相对于正常乳腺癌上皮细胞中高表达(P < 0.01);SKBR-3/PR细胞来源的外泌体高表达CD63和TSG101等特异性蛋白(P < 0.01),SKBR-3/PR细胞转染miR-18b-5p inhibitor提取外泌体后对SKBR-3细胞的增殖、侵袭和迁移显著被抑制(P < 0.01)。生物信息学软件Target Scan预测结果显示,NEDD9 3'UTR上存在潜在与miR-18b-5p靶向结合的位点,miR-18b-5p能够负向调控NEDD9基因表达(P < 0.01)。过表达NEDD9能抑制SKBR-3细胞侵袭能力(P < 0.01)。 结论miR-18b-5p通过靶向NEDD9促进乳腺癌细胞侵袭、迁移。 -
关键词:
- 乳腺肿瘤 /
- 外泌体 /
- miRNA-18b-5p /
- 神经前体细胞表达下调蛋白9
Abstract:ObjectiveTo investigate the effects of miR-18b-5p on the invasion and migration of breast cancer cells by down-regulating the expression of neural precursor cell expressed developmentally down-regulated 9(NEDD9), and its mechanism. MethodsThe expression levels of miR-18b-5p in human normal breast cancer epithelial cells MCF-10A and two breast cancer cell lines of SKBR-3 and SKBR-3/PR were detected using qRT-PCR.The surface markers of SKBR-3/PR cell-derived exosomes were detected using Western blotting.The CCK8 and Transwell assay were used to investigate the effects of the transfection of SKBR-3/PR cells with miR-18b-5p inhibitor and extraction of exosomes on the proliferation, invasion and migration of SKBR-3 cells.The targeted binding sites of miR-18b-5p to NEDD9 were predicted using Bioinformatics prediction software Target Scan.Dual luciferase assay was used to analyze the targeted regulation relationship between miR-18b-5p and NEDD9.The effects of up-regulation of NEDD9 on the invasion and migration of SKBR-3 cells were detected using Transwell assay. ResultsThe expression of miR-18b-5p in breast cancer cell line was higher than that in normal cancer cell line(P < 0.01).The expression levels of CD63 and TSG101 specific proteins SKBR-3/PR in cell-derived exosomes were high(P < 0.01).The proliferation, invasion and migration of SKBR-3 cells were significantly inhibited by the extractive exosomes of SKBR-3/PR cells transfected with miR-18b-5p inhibitor(P < 0.01).The prediction results of bioinformatics software Target Scan showed that the NEDD9 3'UTR had potential binding sites with miR-18b-5p, and the miR-18b-5p could negatively regulate NEDD9 gene expression(P < 0.01).The overexpression of NEDD9 could inhibit the invasion of SKBR-3 cells(P < 0.01). ConclusionsThe miR-18b-5p can promote the invasion and migration of breast cancer cells by targeting NEDD9. -
表 1 引物序列
基因名称 上游序列 下游序列 miR-18b-5p TGA GCC ACA GCA CCT T ACG UGA UCU ACG UGG AA U6 CTC GCT TCG GCA GCA CA AAC GCT TCA CGA ATT TGC GT 表 2 在MCF-10A、SKBR-3和SKBR-3/PR细胞中miR-18b-5p表达水平比较(x±s)
分组 n miR-18b-5p F P MS组内 MCF-10A组 3 1.02±0.04 SKBR-3组 3 1.74±0.03** 19.35 < 0.01 0.294 SKBR-3/PR组 3 2.86±0.11## q检验: 与MCF-10A组比较**P < 0.01;与SKBR-3组比较##P < 0.01 表 3 外泌体蛋白标志物CD63、TSG101的表达(x±s)
分组 n CD63 TSG101 细胞对照组 3 1.00±0.04 1.00±0.02 外泌体组 3 1.47±0.03 1.86±0.05 t — 10.24 22.13 P — < 0.01 < 0.01 表 4 miR-18b-5p inhibitor对SKBR-3细胞迁移能力的影响(x±s)
分组 n 细胞数 迁移率/% NC组 3 272±8.25 0.69±0.03 miR-18b-5p inhibitor组 3 176±5.34 0.42±0.01 t — — 26.40 P — — < 0.01 表 5 miR-18b-5p inhibitor对SKBR-3细胞的增殖抑制作用(x±s)
分组 n 24 h 48 h 72 h NC组 3 0.84±0.03 1.72±0.04 2.28±0.11 miR-18b-5p inhibitor组 3 0.57±0.02 1.16±0.02 1.49±0.07 t — 4.7 12.35 6.82 P — < 0.01 < 0.01 < 0.01 表 6 双荧光素酶报告实验(x±s)
分组 n wt-NEDD9 mut-NEDD9 NC组 3 0.98±0.07 0.94±0.06 miR-18b-5p mimic组 3 0.64±0.16 0.96±0.04 t — 3.18 0.72 P — < 0.05 >0.05 表 7 过表达NEDD9对SKBR-3侵袭、迁移能力的影响(x±s)
分组 n 细胞数 迁移率/% NC组 3 316±7.39 0.72±0.03 NEDD9过表达组 3 224±4.26 0.56±0.01 t — — 30.58 P — — < 0.01 -
[1] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7. doi: 10.3322/caac.21442 [2] SHAO XJ, MIAO MH, XUE J, et al. The down-regulation of microRNA-497 contributes to cell growth and cisplatin resistance through PI3K/Akt pathway in osteosarcoma[J]. Cell Physiol Biochem, 2015, 36(5): 2051. doi: 10.1159/000430172 [3] SHEN K, MAO R, MA L, et al. Post-transcriptional regulation of the tumor suppressor miR-139-5p and a network of miR-139-5p-mediated mRNA interactions in colorectal cancer[J]. FEBS J, 2014, 281(16): 3609. doi: 10.1111/febs.12880 [4] XUE J, NIU J, WU J, et al. MicroRNAs in cancer therapeutic response: Friend and foe[J]. World J Clin Oncol, 2014, 5(4): 730. doi: 10.5306/wjco.v5.i4.730 [5] LI Y, CHEN M, LIU J, et al. Upregulation of MicroRNA 18b contributes to the development of colorectal cancer by inhibiting CDKN2B[J]. Mol Cell Biol, 2017, 37(22): e00391. [6] XUE F, XU YH, SHEN CC, et al. Non-coding RNA LOXL1-AS1 exhibits oncogenic activity in ovarian cancer via regulation of miR-18b-5p/VMA21 axis[J]. Biomed Pharmacother, 2020, 125: 109568. doi: 10.1016/j.biopha.2019.109568 [7] LI XJ, REN ZJ, TANG JH, et al. Exosomal MicroRNA MiR-1246 promotes cell proliferation, invasion and drug resistance by targeting CCNG2 in breast cancer[J]. Cell Physiol Biochem, 2017, 44(5): 1741. doi: 10.1159/000485780 [8] TOMASETTI M, LEE W, SANTARELLI L, et al. Exosome-derived microRNAs in cancer metabolism: possible implications in cancer diagnostics and therapy[J]. Exp Mol Med, 2017, 49(1): e285. doi: 10.1038/emm.2016.153 [9] OHNO S, TAKANASHI M, SUDO K, et al. Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells[J]. Mol Ther, 2013, 21(1): 185. doi: 10.1038/mt.2012.180 [10] FANG JH, ZHANG ZJ, SHANG LR, et al. Hepatoma cell-secreted exosomal microRNA-103 increases vascular permeability and promotes metastasis by targeting junction proteins[J]. Hepatology, 2018, 68(4): 1459. doi: 10.1002/hep.29920 [11] JIANG X, ZHOU Y, SUN AJ, et al. NEAT1 contributes to breast cancer progression through modulating miR-448 and ZEB1[J]. J Cell Physiol, 2018, 233(11): 8558. doi: 10.1002/jcp.26470 [12] XIONG G, WANG C, EVERS BM, et al. RORα suppresses breast tumor invasion by inducing SEMA3F expression[J]. Cancer Res, 2012, 72(7): 1728. doi: 10.1158/0008-5472.CAN-11-2762 [13] GUO X, QIU W, LIU Q, et al. Immunosuppressive effects of hypoxia-induced glioma exosomes through myeloid-derived suppressor cells via the miR-10a/NEDD9 and miR-21/Pten Pathways[J]. Oncogene, 2018, 37(31): 4239. doi: 10.1038/s41388-018-0261-9 [14] SUN X, DONGOL S, QIU C, et al. miR-652 promotes tumor proliferation and metastasis by targeting NEDD9 in endometrial cancer[J]. Mol Cancer Res, 2018, 16(12): 1927. doi: 10.1158/1541-7786.MCR-18-0267 [15] 张玮, 彭澎, 沈铿. 外泌体来源RNA在细胞通讯中的作用[J]. 中国医学科学院学报, 2016, 38(4): 480. doi: 10.3881/j.issn.1000-503X.2016.04.020 [16] VANHIE A, O D, PETERSE D, et al. Plasma miRNAs as biomarkers for endometriosis[J]. Hum Reprod, 2019, 34(9): 1650. doi: 10.1093/humrep/dez116 [17] ZHAO Y, WANG Z, ZHANG W, et al. MicroRNAs play an essential role in autophagy regulation in various disease phenotypes[J]. Biofactors, 2019, 45(6): 844. doi: 10.1002/biof.1555 [18] IMAN M, MOSTAFAVI SS, ARAB SS, et al. HOXB7 and Hsa-miR-222 as the potential therapeutic candidates for metastatic colorectal cancer[J]. Recent Pat Anticancer Drug Discov, 2016, 11(4): 434. doi: 10.2174/1574892811999160628114857 [19] JIN L, CAI Q, WANG S, et al. Long noncoding RNA PVT1 promoted gallbladder cancer proliferation by epigenetically suppressing miR-18b-5p via DNA methylation[J]. Cell Death Dis, 2020, 11(10): 871. doi: 10.1038/s41419-020-03080-x [20] CHANG JX, GAO F, ZHAO GQ, et al. Expression and clinical significance of NEDD9 in lung tissues[J]. Med Oncol, 2012, 29(4): 2654. doi: 10.1007/s12032-012-0213-0 [21] WANG Z, SHEN M, LU P, et al. NEDD9 may regulate hepatocellular carcinoma cell metastasis by promoting epithelial-mesenchymal-transition and stemness via repressing Smad7[J]. Oncotarget, 2017, 8(1): 1714. doi: 10.18632/oncotarget.13852 [22] FENG J, ZHAO J, XIE H, et al. Involvement of NEDD9 in the invasion and migration of gastric cancer[J]. Tumour Biol, 2015, 36(5): 3621. doi: 10.1007/s13277-014-2999-1 -





 下载:
下载: