-
肝细胞癌(hepatocellular carcinoma, HCC)是一种常见的消化道恶性肿瘤之一,其死亡率高居恶性肿瘤第3位[1]。但因其起病隐匿,早期多无明显临床症状,大部分病人在初次诊断时已为晚期,失去了手术机会。近年来,尽管在手术治疗、放化疗以及靶向治疗等方面取得很大进展,但由于其高侵袭性、转移、复发等因素,HCC病人预后仍相对较差[2-3]。因此,探究肝癌侵袭转移的机制,确定有效的作用靶点或预后标志物成为目前HCC研究的重要方向。长链非编码RNA(long-chain non-coding RNA, LncRNA)是一类长度超过200个核苷酸的不编码蛋白质的RNA[4]。LncRNA可以通过调控肿瘤细胞的增殖、迁移、凋亡、血管生成等方面参与肿瘤的发生、发展过程[5-6]。LINC00319是肿瘤相关lncRNA的一种[7-8]。LINC00319通过分子海绵吸附miR-335-5p上调ADCY3从而促进胃癌细胞的肿瘤生长和远处转移[9],通过调控miR-32的表达促进肺癌的增殖和侵袭[10],通过调控miR-3127-5p/RPP25轴促进宫颈癌细胞迁移、侵袭和上皮间质转化(epithelial-mesenchymal transition, EMT)[11]。但是,LINC00319在肝癌中的表达水平及其临床意义仍不清楚。因此,本研究旨在探讨LINC00319在肝细胞癌组织中的表达及临床意义,及其对肝癌细胞侵袭迁移能力的影响。
-
收集并筛选2013年在我院肝胆外科手术治疗后经病理证实的HCC病人。所有入组病人均签署知情同意书。病人术前均未接受放疗、化疗等其他辅助治疗。癌旁组织为距肿瘤边缘 < 2 cm的肝组织,所有组织为术后获得的新鲜标本组织,组织获得后立即转移至液氮。
-
人肝癌细胞株和正常永生化肝细胞株(L02)细胞购自中国科学院上海生命研究所。DMEM细胞培养基、胰蛋白酶购自Hyclone公司;胎牛血清购自杭州四季青公司;E-cahderin、N-cadherin、Vimentin和GAPDH购自Cell signaling technology公司;脂质体(Lipofectamine 2000)购自Invitrogen公司;LINC00319 siRNA及对照siRNA购自上海吉凯公司;Transwell小室购自Millipore公司。BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所,ECL化学发光试剂盒购自Milipore公司。
-
参照按TRIZOL说明书提取总RNA。紫外分光光度计检测提取RNA的浓度及纯度。采用Takara公司的逆转录试剂盒将RNA反转录为cDNA。qRT-PCR以GAPDH为内参对照,采用2-ΔΔCt法分析定量PCR的结果。
-
按照RIPA(强)试剂盒说明书提取相应细胞内的蛋白,经BCA蛋白定量后。用SDS-PAGE制10%分离胶后,每组样品加20 μg,经湿转转膜仪将蛋白移至PVDF膜上。50 g/L脱脂牛奶封闭2 h,加PBS稀释的一抗(1:1 000),把抗体孵育盒放入4 ℃冰箱孵育最少12 h;TBST洗膜3次,分别加HRP标记的抗兔或抗小鼠二抗(1:10 000),室温孵育2 h;TBST洗膜3次,在用超敏发光试剂盒显影并进行半定量分析。
-
取转染48 h后的HCC细胞,重悬细胞调整细胞数为1×106个/毫升。50 mg/L Matrigel胶1:8稀释液包被Transwell小室(孔径8 μm)底部(侵袭实验铺胶、迁移实验未铺胶)。取各组细胞悬液200 μL加入Transwell小室,向24孔板下室加650 μL 10% FBS的完全培养基。每组重复3个样本。常规培养24 h后取出小室,用PBS冲洗小室,4%多聚甲醛固定,PBS冲洗,1 g/L结晶紫染色,用棉棒擦去小室内层细胞,在倒置显微镜下观察移至微孔膜下层的细胞数,每个样本随机选取8个200倍视野求细胞计数平均数。
-
采用t检验、单因素方差分析和q检验、χ2检验和Kaplan-Meier曲线。
-
肝癌组织中的LINC00319在肝癌组织中的表达(0.57±0.02)明显高于癌旁组织(0.27±0.01)(t=15.02,P < 0.01)。
-
将LINC00319按中位数分为LINC高表达组(n=49)和低表达组(n=48)。结果显示LINC00319高表达与TNM分期(Ⅲ+Ⅳ)和血管侵犯均相关(P < 0.01和P < 0.05)(见表 1)。
临床病理 n LINC00319 χ2 P 高表达组 低表达组 年龄/岁 < 60
≥6064
3331(48.44)
18(54.54)33(51.56)
15(45.46)0.33 >0.05 性别 男
女80
1740(50.00)
9(52.94)40(50.00)
8(47.06)0.05 >0.05 肿瘤大小/cm < 5
≥568
2930(44.12)
19(65.52)38(55.88)
10(34.48)3.72 >0.05 肿瘤数量 单发
多发84
1340(47.62)
9(69.23)44(52.38)
4(30.77)2.10 >0.05 病理分级 Ⅰ+Ⅱ
Ⅲ+Ⅳ23
749(39.13)
40(54.05)14(60.87)
34(45.95)1.56 >0.05 TNM分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ72
2530(41.67)
19(76.00)42(58.33)
6(24.00)8.75 < 0.01 血管侵犯 是
否16
8112(75.00)
37(45.68)4(25.00)
44(54.32)4.60 < 0.05 甲胎蛋白/(ng/mL) < 400
≥40022
7513(59.09)
36(48.00)9(40.91)
39(52.00)0.84 >0.05 乙肝表面抗原 阳性
阴性89
845(50.56)
4(50.00)44(49.44)
4(50.00)0.01 >0.05 表 1 LINC00319的表达与肝癌临床病理特征关系[n;构成比(%)]
-
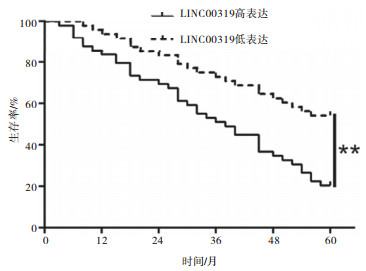
随访发现,LINC00319高表达病人的5年生存率(20.41%)明显低于LINC00319低表达组病人(52.08%)(χ2=11.59,P < 0.01)(见图 1)。
-
LINC00319在肝癌细胞系中的表达均高于L02正常肝细胞系(P < 0.05~P < 0.01),且在MHCC-97H和HCCLM3细胞系中表达最高(P < 0.01)(见表 2)。基于以上结果,选择MHCC-97H和HCCLM3细胞系为后续敲低实验研究对象,研究LINC00319对肝癌细胞系生物学功能的影响。
细胞系 n LINC00319表达水平 F P MS组内 L02 3 1.00±0.02 22.34 < 0.01 0.001 Hep3B 3 1.89±0.12* SMMC-7721
Huh73
31.96±0.11*
2.56 ±0.15**△#MHCC-97H 3 3.23±0.12**△△##▲ HCCLM3 3 3.65±0.13**△△##▲▲ q检验:与L02比较*P < 0.05,**P < 0.01;与Hep3B比较△P < 0.05,△△P < 0.01;与SMMC-7721比较#P < 0.05,##P < 0.01;与Huh7比较▲P < 0.05,▲▲P < 0.01 表 2 LINC00319在不同肝癌细胞系中的表达水平(x±s)
-
将si-Control、siRNA#1、siRNA#2分别转染MHCC-97H和HCCLM3细胞系干扰LINC00319的表达48 h后,用qRT-PCR检测干扰效率。结果显示,与si-Control对照组相比,siRNA#1、siRNA#2均能抑制MHCC-97H和HCCLM3细胞中LINC00319的相对表达量(P < 0.01)(见表 3)。提示该两条siRNA可用于后续实验对LINC00319的敲低。
分组 n LINC00319/MHCC-97H LINC00319/HCCLM3 si-Control 3 1.00±0.05 1.00±0.03 siRNA#1 3 0.32±0.05** 0.30±0.05** siRNA#2 3 0.23±0.04** 0.28±0.04** F — 52.26 35.67 P — < 0.01 < 0.01 MS组内 — 0.003 0.001 q检验:与si-Control组比较**P < 0.01 表 3 各组细胞中LINC00319表达水平(x±s)
-
利用未铺胶的Transwell实验证实,敲低LINC00319能抑制MHCC-97H和HCCLM3细胞的迁移能力和侵袭能力(P < 0.01)(见表 4)。
分组 n MHCC-97H HCCLM3 迁移细胞数 侵袭细胞 迁移细胞数 侵袭细胞数 si-Control 3 155.23±14.35 95.63±9.56 172.39±14.83 89.64±8.37 siRNA#1 3 65.43±8.25** 42.38±5.26** 58.43±8.75** 41.35±5.59** siRNA#2 3 43.23±7.14** 38.65±4.15** 45.28±7.24** 35.62±4.25** F — 54.08 59.64 93.45 55.04 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.002 0.001 0.001 0.001 q检验:与si-Control组比较** P < 0.01 表 4 siRNA干扰LINC00319表达水平后细胞迁移及侵袭能力(x±s)
-
敲低LINC00319能够促进上皮表型标志物E-cadherin的表达(P < 0.01),而抑制间质表型标志物N-cadherin和Vimentin的表达(P < 0.01)(见表 5)。说明LINC00319能够调控肝癌细胞EMT的发生。
分组 n MHCC-97H HCCLM3 E-cadherin N-cadherin Vimentin E-cadherin N-cadherin Vimentin si-Control 3 1.00±0.02 1.00±0.03 1.00±0.02 1.00±0.02 1.00±0.04 1.00±0.02 siRNA#1 3 2.53±0.12** 0.37±0.05** 0.29±0.05** 2.60±0.12** 0.42±0.05** 0.31±0.05** siRNA#2 3 2.10±0.11** 0.26±0.04** 0.23±0.04** 2.21±0.11** 0.31±0.04** 0.38±0.04** F — 54.08 65.34 89.36 67.38 46.35 56.89 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.001 0.001 0.001 0.001 0.001 0.001 q检验:与si-Control组比较**P < 0.01 表 5 siRNA干扰LINC00319表达水平后EMT相关蛋白的表达量(x±s)
-
肝癌细胞侵袭和远处转移能力强是HCC病人预后差的重要因素。因此研究HCC细胞侵袭转移的分子网络机制对寻找新的治疗靶点降低HCC转移有重要意义。LncRNA因本身缺乏开放阅读框架无明显蛋白质编码功能[12]。近年来,越来越多研究证实lncRNA能够在肿瘤发生、发展中起重要角色[13]。LINC00319作为新的lncRNA,在鼻咽癌、膀胱癌、胶质瘤等中均异常高表达[14-19]。本研究证实LINC00319在肝癌组织中异常高表达,且高表达LINC00319与肿瘤TNM分期、血管侵犯的不良临床病理特征相关。通过随访,发现LINC00319高表达病人的5年生存率明显低于低表达者,提示LINC00319的高表达与HCC病人不良预后相关。说明LINC00319在HCC发生、发展过程中发挥重要作用。
在细胞学水平上,本研究发现LINC003319在肝癌细胞系中的表达明显高于正常肝细胞系。在体外实验中我们选择LINC00319相对高表达细胞系MHCC-97H和HCCLM3细胞作为研究模型,利用siRNA特异性下调LINC00319的表达。发现LINC00319的下调能够显著抑制MHCC-97H和HCCLM3细胞的侵袭和迁移能力。另外,EMT是细胞形态学上从上皮表型转化为间质表型的过程,伴随着细胞极性消失,运动能力增强、黏附能力减弱等现象,是肿瘤转移的关键步骤[20]。本研究发现,LINC00319下调后HCC细胞上皮分子标志物E-cadherin表达上调,而间质表型标志物N-cadherin和Vimentin表达下调。这说明LINC00319能够调控HCC细胞EMT的发生,这与YANG等[11]在宫颈癌中研究一致。以上结果表明,在HCC中LINC00319可能通过调控EMT发生促进肝癌侵袭转移。
综上,本研究证实LINC00319在HCC中异常高表达,并且与HCC的不良临床病理特征及预后密切相关。可能通过调控EMT发生促进肝癌侵袭转移发挥致癌基因的作用。这表明,LINC00319可能成为肝癌诊断的生物标志物和防治靶点。
长链非编码RNA LINC00319在肝细胞癌中表达上调并促进肝癌细胞迁移和侵袭
Observation of the high-expression of long-chain non-coding RNA LINC00319 and promotion of cell migration and invasion in hepatocellular carcinoma
-
摘要:
目的探讨LINC00319在肝细胞癌(HCC)组织中的表达、临床意义及可能的分子机制。 方法实时定量PCR检测LINC00319在HCC及癌旁组织中的表达水平,并分析LINC00319表达水平与临床病理特征的关系及生存率。Transwell实验检测LINC00319对HCC细胞的侵袭及迁移作用,Western blotting法检测LINC00319对HCC细胞EMT的影响。 结果LINC00319在肝癌组织中表达水平明显高于相应癌旁组织(P < 0.01);肝癌组织LINC00319高表达与TNM分期及血管侵犯相关(P < 0.01和P < 0.05);高表达LINC00319病人5年生存率明显高于低表达组(P < 0.01);LINC00319下调可显著抑制HCC细胞的侵袭及迁移(P < 0.01);LINC00319下调抑制HCC细胞EMT的发生(P < 0.01)。 结论LINC00319在肝癌组织中表达升高,其高表达与肝癌恶性临床病理特征有关,LINC00319能够通过调控HCC细胞EMT促进其侵袭和迁移。 Abstract:ObjectiveTo investigate the level and clinical significance of LINC00319 expression in human hepatocellular carcinoma(HCC) and analyze the potential underlying mechanisms. MethodsThe LINC00319 expression level in HCC was checked by real time quantitative PCR method, and the relationship among LINC00319 expression level, clinical pathological features and survival rate were analyzed.Transwell assay was performed to measure the invasion and migration of effects of LINC00319 on HCC cells.The expression of EMT-related protein was determined by Western blotting. ResultsThe expression level of LINC00319 in HCC tissues was significantly higher than that in the adjacent normal tissues(P < 0.01), and it was significantly associated with TNM stage and vascular infiltration(P < 0.01 and P < 0.05).Patients in the higher LINC00319 group had a worse 5-year survival than those in the lower LINC00319 group(P < 0.01).Down-expression of LINC00319 significantly inhibited the invasion and migration of HCC cells(P < 0.01).Down-expression of LINC00319 inhibited the EMT of HCC(P < 0.01). ConclusionsLINC00319 is up-regulated in HCC tissues.Its high expression is correlated with the malignant clinical pathological features.LINC00319 high-expression regulates EMT and subsequently promotes invasion and migration of HCC cells. -
Key words:
- hepatocellular carcinoma /
- LINC00319 /
- invasion /
- migration /
- epithelial-mesenchymal transition
-
表 1 LINC00319的表达与肝癌临床病理特征关系[n;构成比(%)]
临床病理 n LINC00319 χ2 P 高表达组 低表达组 年龄/岁 < 60
≥6064
3331(48.44)
18(54.54)33(51.56)
15(45.46)0.33 >0.05 性别 男
女80
1740(50.00)
9(52.94)40(50.00)
8(47.06)0.05 >0.05 肿瘤大小/cm < 5
≥568
2930(44.12)
19(65.52)38(55.88)
10(34.48)3.72 >0.05 肿瘤数量 单发
多发84
1340(47.62)
9(69.23)44(52.38)
4(30.77)2.10 >0.05 病理分级 Ⅰ+Ⅱ
Ⅲ+Ⅳ23
749(39.13)
40(54.05)14(60.87)
34(45.95)1.56 >0.05 TNM分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ72
2530(41.67)
19(76.00)42(58.33)
6(24.00)8.75 < 0.01 血管侵犯 是
否16
8112(75.00)
37(45.68)4(25.00)
44(54.32)4.60 < 0.05 甲胎蛋白/(ng/mL) < 400
≥40022
7513(59.09)
36(48.00)9(40.91)
39(52.00)0.84 >0.05 乙肝表面抗原 阳性
阴性89
845(50.56)
4(50.00)44(49.44)
4(50.00)0.01 >0.05 表 2 LINC00319在不同肝癌细胞系中的表达水平(x±s)
细胞系 n LINC00319表达水平 F P MS组内 L02 3 1.00±0.02 22.34 < 0.01 0.001 Hep3B 3 1.89±0.12* SMMC-7721
Huh73
31.96±0.11*
2.56 ±0.15**△#MHCC-97H 3 3.23±0.12**△△##▲ HCCLM3 3 3.65±0.13**△△##▲▲ q检验:与L02比较*P < 0.05,**P < 0.01;与Hep3B比较△P < 0.05,△△P < 0.01;与SMMC-7721比较#P < 0.05,##P < 0.01;与Huh7比较▲P < 0.05,▲▲P < 0.01 表 3 各组细胞中LINC00319表达水平(x±s)
分组 n LINC00319/MHCC-97H LINC00319/HCCLM3 si-Control 3 1.00±0.05 1.00±0.03 siRNA#1 3 0.32±0.05** 0.30±0.05** siRNA#2 3 0.23±0.04** 0.28±0.04** F — 52.26 35.67 P — < 0.01 < 0.01 MS组内 — 0.003 0.001 q检验:与si-Control组比较**P < 0.01 表 4 siRNA干扰LINC00319表达水平后细胞迁移及侵袭能力(x±s)
分组 n MHCC-97H HCCLM3 迁移细胞数 侵袭细胞 迁移细胞数 侵袭细胞数 si-Control 3 155.23±14.35 95.63±9.56 172.39±14.83 89.64±8.37 siRNA#1 3 65.43±8.25** 42.38±5.26** 58.43±8.75** 41.35±5.59** siRNA#2 3 43.23±7.14** 38.65±4.15** 45.28±7.24** 35.62±4.25** F — 54.08 59.64 93.45 55.04 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.002 0.001 0.001 0.001 q检验:与si-Control组比较** P < 0.01 表 5 siRNA干扰LINC00319表达水平后EMT相关蛋白的表达量(x±s)
分组 n MHCC-97H HCCLM3 E-cadherin N-cadherin Vimentin E-cadherin N-cadherin Vimentin si-Control 3 1.00±0.02 1.00±0.03 1.00±0.02 1.00±0.02 1.00±0.04 1.00±0.02 siRNA#1 3 2.53±0.12** 0.37±0.05** 0.29±0.05** 2.60±0.12** 0.42±0.05** 0.31±0.05** siRNA#2 3 2.10±0.11** 0.26±0.04** 0.23±0.04** 2.21±0.11** 0.31±0.04** 0.38±0.04** F — 54.08 65.34 89.36 67.38 46.35 56.89 P — < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.001 0.001 0.001 0.001 0.001 0.001 q检验:与si-Control组比较**P < 0.01 -
[1] SIEGEL RL, MILLER KD, JEMAL A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7. doi: 10.3322/caac.21387 [2] MALUCCIO M, COVEY A. Recent progress in understanding, diagnosing, and treating hepatocellular carcinoma[J]. CA Cancer J Clin, 2012, 62(6): 394. doi: 10.3322/caac.21161 [3] DONADON M, SOLBIATI L, DAWSON L, et al. Hepatocellular carcinoma: the role of interventional oncology[J]. Liver Cancer, 2016, 6(1): 34. [4] GUTTMAN M, AMIT I, GARBER M, et al. Chromatin signature reveals over a thousand highly conserved large non-coding RNAs in mammals[J]. Nature, 2009, 458(7235): 223. doi: 10.1038/nature07672 [5] LIU Z, WANG Y, WANG L, et al. Long non-coding RNA AGAP2-AS1, functioning as a competitive endogenous RNA, upregulates ANXA11 expression by sponging miR-16-5p and promotes proliferation and metastasis in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2019, 38(1): 194. doi: 10.1186/s13046-019-1188-x [6] SUN L, WANG L, CHEN T, et al. LncRNA RUNX1-IT1 which is downregulated by hypoxia-driven histone deacetylase 3 represses proliferation and cancer stem-like properties in hepatocellular carcinoma cells[J]. Cell Death Dis, 2020, 11(2): 95. doi: 10.1038/s41419-020-2274-x [7] DU W, FENG Z, SUN Q. LncRNA LINC00319 accelerates ovarian cancer progression through miR-423-5p/NACC1 pathway[J]. Biochem Biophys Res Commun, 2018, 507(1/4): 198. [8] ZhANG Y, HUANG Z, SHENG F, et al. MYC upregulated LINC00319 promotes human acute myeloid leukemia(AML) cells growth through stabilizing SIRT6[J]. Biochem Biophys Res Commun, 2019, 509(1): 314. doi: 10.1016/j.bbrc.2018.12.133 [9] ZOU J, WU K, LIN C, et al. LINC00319 acts as a microRNA-335-5p sponge to accelerate tumor growth and metastasis in gastric cancer by upregulating ADCY3[J]. Am J Physiol Gastrointest Liver Physiol, 2020, 318(1): G10. doi: 10.1152/ajpgi.00405.2018 [10] ZHOU B, YUAN W, LI X. Long intergenic noncoding RNA 319(linc00319) promotes cell proliferation and invasion in lung cancer cells by directly downregulating the tumor suppressor MiR-32[J]. Oncol Res, 2017. doi: 10.3727/096504017X15016337254650. [11] YANG J, HOU S, LIANG B. LINC00319 promotes migration, invasion and epithelial-mesenchymal transition process in cervical cancer by regulating miR-3127-5p/RPP25 axis[J]. In Vitro Cell Dev Biol Anim, 2020, 56(2): 145. doi: 10.1007/s11626-019-00425-5 [12] PONTING CP, OLIVER PL, REIK W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4): 629. doi: 10.1016/j.cell.2009.02.006 [13] WANG Y, LIU Z, YAO B, et al. Long non-coding RNA CASC2 suppresses epithelial-mesenchymal transition of hepatocellular carcinoma cells through CASC2/miR-367/FBXW7 axis[J]. Mol Cancer, 2017, 16(1): 123. doi: 10.1186/s12943-017-0702-z [14] SONG P, YIN SC. Long non-coding RNA 319 facilitates nasopharyngeal carcinoma carcinogenesis through regulation of miR-1207-5p/KLF12 axis[J]. Gene, 2019, 680: 51. doi: 10.1016/j.gene.2018.09.032 [15] YANG Y, ZHANG F, HUANG H, et al. Long noncoding RNA LINC00319 regulates ROMO1 expression and promotes bladder cancer progression via miR-4492/ROMO1 axis[J]. J Cell Physiol, 2020, 235(4): 3768. doi: 10.1002/jcp.29271 [16] LI Q, WU Q, LI Z, et al. LncRNA LINC00319 is associated with tumorigenesis and poor prognosis in glioma[J]. Eur J Pharmacol, 2019, 861: 172556. doi: 10.1016/j.ejphar.2019.172556 [17] ZHANG ZW, CHEN JJ, XIA SH, et al. Long intergenic non-protein coding RNA 319 aggravates lung adenocarcinoma carcinogenesis by modulating miR-450b-5p/EZH2[J]. Gene, 2018, 650: 60. doi: 10.1016/j.gene.2018.01.096 [18] LI F, LIAO J, DUAN X, et al. Upregulation of LINC00319 indicates a poor prognosis and promotes cell proliferation and invasion in cutaneous squamous cell carcinoma[J]. J Cell Biochem, 2018, 119(12): 10393. doi: 10.1002/jcb.27388 [19] QI G, KONG W, MOU X, et al. A new method for excavating feature lncRNA in lung adenocarcinoma based on pathway crosstalk analysis[J]. J Cell Biochem, 2019, 120(6): 9034. doi: 10.1002/jcb.28177 [20] YANG J, WEINBERG RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis[J]. Dev Cell, 2008, 14(6): 818. doi: 10.1016/j.devcel.2008.05.009 -




 下载:
下载: