-
大肠癌是消化道常见的恶性肿瘤,其发病率及致死率较高,位于肿瘤疾病中的第4~5位[1-2]。随着物质生活水平的提升,人们生活环境、生活节奏及饮食习惯的改变,大肠癌的发病人数每年呈上升趋势[3]。尽管医疗水平不断提高,可应用放、化疗及免疫法等手段进行干预,但是大肠癌5年的生存率仍然较低[4]。对大肠癌发生机制进行深入探讨,对于大肠癌的早期治疗具有重大作用。寻找一种有效的大肠癌治疗药物是目前研究的热点。铁死亡是一种铁离子依赖的过氧化反应引起的细胞死亡模式,和凋亡、坏死及自噬等细胞死亡模式相比,在细胞形态学、生物学及遗传学等方面有较大区别[5]。早期报道[5-6]显示,铁死亡是因为胱氨酸-谷氨酸反向转运体亚基xCT蛋白表达降低时,胱氨酸的摄取减少,导致谷胱甘肽过氧化物酶4(GPX4)表达下降,进而引发细胞内活性氧(ROS)过度堆积导致的细胞死亡,这一生物学过程需要铁离子的参与。研究[7]发现,铁死亡与肿瘤发生发展的病理过程相关。
白藜芦醇是多酚类化合物。主要来源于花生、葡萄(红葡萄酒)、虎杖、桑椹等植物。白藜芦醇是一种生物性很强的天然多酚类物质是肿瘤的化学预防剂,也是降低血小板聚集、预防和治疗动脉粥样硬化、心脑血管疾病的化学预防剂[8-9];王晓燕等[10]发现白藜芦醇能通过下调人端粒酶逆转录酶(hTERT)启动子活性来抑制大肠癌细胞的增殖。然而,白藜芦醇是否能诱导大肠癌细胞铁死亡,尚未见报道。本研究以大肠癌SW480细胞株为体外研究对象,观察白藜芦醇通过抑制xCT、GPX4表达,诱导ROS过度堆积促使大肠癌细胞的铁死亡。
-
大肠癌细胞株SW480购自中科院上海细胞库;白藜芦醇(美国Sigma公司);DMEM培养基(Thermo公司);胎牛血清(杭州四季青公司);CCK-8试剂盒(上海纪宁公司);BCA蛋白浓度测定试剂盒(上海谷歌生物有限公司);ROS检测试剂盒均购自碧云天生物技术研究所;xCT、GPX4、二价金属离子转运体1(DMT1)及β-actin抗体购自英国Abcam公司。单人超净工作台(北京六一仪器厂);BC-J80S型CO2细胞培养箱(北京六一仪器厂);Victor3 1420 Multilable Counter酶标仪(美国BD,FACS AriaⅢ);HD-3000型凝胶成像仪(上海上天精密仪器有限公司);Millipore流式细胞仪(北京维欣仪奥科技发展有限公司)。
-
SW480细胞培养于10%胎牛血清的DMEM培养基中,条件为37 ℃、5%CO2、饱和湿度环境,等细胞贴壁生长后,进行常规培养并传代。每2 d换液1次,每天监测细胞形态变化。
-
取对数期SW480细胞消化、重悬、调整细胞密度后接种于96孔板,置于37 ℃、5%CO2培养箱中培养过夜。然后加入不同浓度(0、10、20、40、80、160 μmol/L)白藜芦醇处理细胞24、48、72 h后,除去旧培养液,每孔加入10 μL CCK8溶液,每组设置6个复孔,再置于培养箱中孵育2 h后,置于酶标仪中测定450 nm处的吸光度(OD)值。细胞抑制率(%)=[(1-实验组OD值)/对照组OD值]×100%。
-
取对数期SW480细胞消化、重悬、调整细胞密度后接种于6孔板,置于37 ℃恒温、5%CO2培养箱中培养过夜。然后加入不同浓度(0、20、40、80 μmol/L)白藜芦醇处理细胞48 h后,收集各组SW480细胞,冰上充分裂解30 min,在4 ℃、12 000 r/min低温离心机中离心15 min,然后吸取上清测蛋白浓度。细胞匀浆采用10%SDS-PAGE电泳4 h(电压45 V),随后转膜,5%脱脂牛奶封闭1 h。把条带对应放入xCT、GPX4、DMT1及β-actin抗体溶液中(稀释比1∶1 000),4 ℃反应过夜。TBST洗膜3次,每次10 min,然后室温条件下孵育二抗1 h。TBST洗膜3次,每次10 min,ECL显色后,成像系统进行曝光显影,Image J软件分析蛋白灰度值。
-
取对数期SW480细胞消化、重悬、调整细胞密度后接种于6 cm培养皿中,置于37 ℃、5%CO2培养箱中培养过夜。然后加入不同浓度(0、20、40、80 μmol/L)白藜芦醇处理细胞48 h后,除去培养液,加入1 mL终浓度为10 μmol/L的2′, 7′-二氯荧光黄双乙酸盐(DCFH-DA)探针工作液,置于37 ℃培养箱中孵育20 min。采用无血清细胞培养液洗涤3遍,采用不含EDTA的胰蛋白酶消化细胞,上流式细胞仪检测细胞中荧光强度(激发波长为488 nm,发射波长为525 nm)。
-
采用t检验、q检验和方差分析。
-
10 μmol/L白藜芦醇对SW480细胞增殖就表现出抑制作用,随着药物浓度的增高,细胞增殖抑制率数值也随之升高。同时,同一浓度白藜芦醇作用不同时间SW480细胞后,随着作用时间的延长,细胞增殖受到抑制的效果更为明显(P < 0.01)(见表 1)。
分组/(μmol/L) 24 h 48 h 72 h F P MS组内 0 — — — 10 5.4±1.7 12.3±2.5▽ 22.6±3.7▽△ 49.23 < 0.01 7.610 20 8.6±3.1 21.7±2.9**▽ 42.4±4.2**▽△ 122.16 < 0.01 11.886 40 21.3±3.3**## 36.9±3.2**##▽ 49.8±3.4**##▽△ 93.46 < 0.01 10.896 80 34.2±2.8**##▼▼ 47.6±3.8**##▼▼▽ 71.2±4.3**##▼▼▽△ 129.11 < 0.01 13.590 160 41.2±3.8**##▼▼▲▲ 52.7±4.1**##▼▼▲ 88.3±5.1**##▼▼▲▲ 157.96 < 0.01 19.086 F 133.16 129.67 186.43 — — — P < 0.01 < 0.01 < 0.01 — — — MS组内 9.134 11.230 17.478 — — — q检验:与10 μmol/L比较**P < 0.01;与20 μmol/L比较##P < 0.01;与40 μmol/L比较▼▼P < 0.01;与80 μmol/L比较▲P < 0.05,▲▲P < 0.01;组内比较:与24 h比较▽P < 0.01,与48 h比较△P < 0.01 表 1 各组间SW480细胞增殖抑制率的比较(n=5)
-
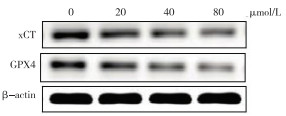
20、40、80 μmol/L白藜芦醇作用SW480细胞48 h后,细胞中GPX4和xCT蛋白表达相对于对照组细胞明显降低(P < 0.01)。低、中、高剂量白藜芦醇组间细胞中GPX4和xCT蛋白表达也有明显差异(P < 0.01),表现出浓度依赖性(见图 1、表 2)。
分组 xCT/β-actin GPX4/β-actin 对照组 0.47±0.03 0.24±0.03 20 μmol/L白藜芦醇 0.27±0.04** 0.17±0.02** 40 μmol/L白藜芦醇 0.17±0.02**## 0.13±0.03**# 80 μmol/L白藜芦醇 0.13±0.03**## 0.09±0.02**##▼ F 121.40 31.47 P < 0.01 < 0.01 MS组内 0.001 0.001 q检验:与对照组比较**P < 0.01;与20 μmol/L白藜芦醇比较#P < 0.05,##P < 0.01;与40 μmol/L白藜芦醇比较▼P < 0.05 表 2 各组间xCT、GPX4蛋白表达的比较(n=5)
-
结果表明, 不同剂量白藜芦醇(20、40、80 μmol/L)干预细胞48 h后,与对照组相比,药物组SW480细胞中产生了大量ROS(P < 0.01),DMT1蛋白表达相对于对照组细胞明显升高(P < 0.01);低、中、高剂量白藜芦醇组间细胞中ROS积累量及DMT1蛋白表达差异有统计学意义(P < 0.01),表现出浓度依赖性(见图 2~3、表 3)。
分组 ROS GPX4/β-actin 对照组 1104.3±342.7 0.07±0.02 20 μmol/L白藜芦醇 2453.1±546.5** 0.13±0.03* 40 μmol/L白藜芦醇 3890.4±657.2**## 0.24±0.04**## 80 μmol/L白藜芦醇 4416.7±547.3**## 0.39±0.04**##▼▼ F 38.85 87.81 P < 0.01 < 0.01 MS组内 286 888.667 5 0.001 q检验:与对照组比较*P < 0.05,**P < 0.01;与20 μmol/L白藜芦醇比较##P < 0.01;与40 μmol/L白藜芦醇比较▼▼P < 0.01 表 3 各组间ROS累积、DMT1蛋白表达(n=5)
-
铁死亡属于一种新型的铁离子依赖性细胞死亡方式,与早期报道[5]的细胞坏死和凋亡等模型有着明显不同。铁死亡对于机体来说是一把“双刃剑”,即其发生在正常细胞中,会因为ROS的过度积累引发多种病症。中枢神经系统疾病中,发现铁死亡是帕金森病中多种细胞死亡方式的一种,在这过程中GPX4发挥着重要的作用[11]。在肿瘤方面,发现顺铂可以引起癌细胞发生铁死亡,其中xCT和GPX4的表达水平发生了显著变化[12]。于是,在肿瘤细胞中能够诱导铁死亡可能成为肿瘤治疗的一个新方案。
目前,已有研究[13]发现多种药物均可诱导肿瘤细胞发生铁死亡。青蒿琥酯在胰腺癌细胞中可诱导铁死亡的发生;双氢青蒿素也能引发头颈部鳞状细胞癌发生铁死亡[14];另外,索拉菲尼在治疗肝癌过程中也发现铁死亡的存在[15]。白藜芦醇在抗肿瘤等方面效果显著,并且对大肠癌细胞增殖具有明显的抑制作用[10]。本文研究也发现白藜芦醇对大肠癌SW480细胞增殖表现出时间、剂量依赖性的抑制作用。随着白藜芦醇剂量的增高,SW480细胞中xCT和GPX4蛋白的表达水平逐渐降低。此外,用流式细胞法检测了不同剂量白藜芦醇处理后SW480细胞中ROS的含量。实验结果发现白藜芦醇处理后SW480细胞中ROS含量显著升高。上述结果充分证实白藜芦醇能诱导SW480细胞发生铁死亡。
细胞发生铁死亡与细胞内铁离子的富集关系密切,DMT1与Cu2+和Fe2+等二价金属离子的转运有一定联系[16]。然而铁死亡本身是因为胞内铁离子的富集导致ROS的过度堆积而引发的细胞死亡。由此不难得出DMT1在细胞铁死亡过程中发挥了重要的作用。为了进一步证实白藜芦醇引发铁死亡的机制是否与DMT1表达有关,实验中对SW480细胞中DMT1蛋白表达水平进行了进一步检测。发现SW480细胞经白藜芦醇处理后,DMT1蛋白表达水平明显升高。总之,本研究发现白藜芦醇早大肠癌SW480细胞中诱导铁死亡,其机制可能与DMT1蛋白表达水平升高有关。
白藜芦醇诱导大肠癌SW480细胞发生铁死亡及机制研究
Resveratrol induces ferroptosis in colorectal cancer SW480 cells and its mechanism
-
摘要:
目的研究白藜芦醇对大肠癌SW480细胞铁死亡的激活,并探讨其可能的作用机制。 方法利用不同剂量白藜芦醇(0、10、20、40、80、160 μmol/L)干预SW480细胞24、48、72 h后,CCK8法分析白藜芦醇对细胞增殖抑制率的影响;不同剂量白藜芦醇(0、20、40、80 μmol/L)干预SW480细胞48 h后,采用蛋白质印迹法分析谷胱甘肽过氧化物酶4(GPX4)、胱氨酸-谷氨酸反向转运体亚基xCT蛋白及二价金属离子转运体1(DMT1)的表达水平,流式细胞仪分析细胞内荧光强度用于监测活性氧(ROS)含量的变化。 结果白藜芦醇处理SW480细胞后,细胞增殖抑制率明显升高,表现出时间和浓度依赖性(P < 0.05);白藜芦醇能够显著抑制细胞内xCT、GPX4蛋白表达,促使DMT1蛋白表达(P < 0.05);还能诱导SW480细胞内ROS的积累(P < 0.05)。 结论白藜芦醇通过抑制xCT、GPX4蛋白表达使SW480细胞中ROS大量累积,细胞发生铁死亡,DMT1的激活可能是其机制之一。 -
关键词:
- 大肠肿瘤 /
- 白藜芦醇 /
- 铁死亡 /
- 二价金属离子转运体1
Abstract:ObjectiveTo study the activation of ferroptosis by resveratrol in colorectal cancer SW480 cells, and to explore its possible mechanism. MethodsAfter intervening SW480 cells with different doses of resveratrol(0, 10, 20, 40, 80, 160 μmol/L) for 24, 48 and 72 h, the effect of resveratrol on cell proliferation inhibition rate was analyzed by CCK8 method.After intervening SW480 cells with different doses of resveratrol(0, 20, 40, 80 μmol/L) for 48 h, Western blotting was used to analyze the expression levels of cystine/glutamate antiporter system Xc(xCT), glutathione peroxidase 4(GPX4) and divalent metal transporter 1(DMT1), and flow cytometry was applied to detect the change of reactive oxygen specie(ROS) level which was indicated by fluorescence intensity. ResultsAfter SW480 cells were treated with resveratrol, the inhibition rate of cell proliferation was significantly increased, which showed a time- and concentr ation-dependent manner(P < 0.05);the expression level of xCT and GPX4 protein were significantly decreased, and the expression level of DMT1 was greatly increased(P < 0.05);resveratrol also induced the accumulation of ROS in SW480 cells(P < 0.05). ConclusionsResveratrol increases the accumulation of ROS by inhibiting the expression of GPX4 and xCT protein to induce ferroptosis in SW480 cells, which may involve the activation of DMT1 expression. -
Key words:
- colorectal neoplasms /
- resveratrol /
- ferroptosis /
- divalent metal transporter 1
-
表 1 各组间SW480细胞增殖抑制率的比较(n=5)
分组/(μmol/L) 24 h 48 h 72 h F P MS组内 0 — — — 10 5.4±1.7 12.3±2.5▽ 22.6±3.7▽△ 49.23 < 0.01 7.610 20 8.6±3.1 21.7±2.9**▽ 42.4±4.2**▽△ 122.16 < 0.01 11.886 40 21.3±3.3**## 36.9±3.2**##▽ 49.8±3.4**##▽△ 93.46 < 0.01 10.896 80 34.2±2.8**##▼▼ 47.6±3.8**##▼▼▽ 71.2±4.3**##▼▼▽△ 129.11 < 0.01 13.590 160 41.2±3.8**##▼▼▲▲ 52.7±4.1**##▼▼▲ 88.3±5.1**##▼▼▲▲ 157.96 < 0.01 19.086 F 133.16 129.67 186.43 — — — P < 0.01 < 0.01 < 0.01 — — — MS组内 9.134 11.230 17.478 — — — q检验:与10 μmol/L比较**P < 0.01;与20 μmol/L比较##P < 0.01;与40 μmol/L比较▼▼P < 0.01;与80 μmol/L比较▲P < 0.05,▲▲P < 0.01;组内比较:与24 h比较▽P < 0.01,与48 h比较△P < 0.01 表 2 各组间xCT、GPX4蛋白表达的比较(n=5)
分组 xCT/β-actin GPX4/β-actin 对照组 0.47±0.03 0.24±0.03 20 μmol/L白藜芦醇 0.27±0.04** 0.17±0.02** 40 μmol/L白藜芦醇 0.17±0.02**## 0.13±0.03**# 80 μmol/L白藜芦醇 0.13±0.03**## 0.09±0.02**##▼ F 121.40 31.47 P < 0.01 < 0.01 MS组内 0.001 0.001 q检验:与对照组比较**P < 0.01;与20 μmol/L白藜芦醇比较#P < 0.05,##P < 0.01;与40 μmol/L白藜芦醇比较▼P < 0.05 表 3 各组间ROS累积、DMT1蛋白表达(n=5)
分组 ROS GPX4/β-actin 对照组 1104.3±342.7 0.07±0.02 20 μmol/L白藜芦醇 2453.1±546.5** 0.13±0.03* 40 μmol/L白藜芦醇 3890.4±657.2**## 0.24±0.04**## 80 μmol/L白藜芦醇 4416.7±547.3**## 0.39±0.04**##▼▼ F 38.85 87.81 P < 0.01 < 0.01 MS组内 286 888.667 5 0.001 q检验:与对照组比较*P < 0.05,**P < 0.01;与20 μmol/L白藜芦醇比较##P < 0.01;与40 μmol/L白藜芦醇比较▼▼P < 0.01 -
[1] ZHOU B, SHU B, YANG J, et al. C-reactive protein, interleukin-6 and the risk of colorectal cancer: a meta-analysis[J]. Cancer Causes Control, 2014, 25(10): 1397. doi: 10.1007/s10552-014-0445-8 [2] PLUNKETT M, MURRAY M, FRIZELLE F, et al. Colorectal adenocarcinoma cancer in New Zealand in those under 25 years of age(1997-2007)[J]. ANZ J Surg, 2014, 84(5): 371. doi: 10.1111/ans.12380 [3] BRENNER H, KLOOR M, POX CP. Colorectal cancer[J]. Lancet, 2014, 383(9927): 1490. doi: 10.1016/S0140-6736(13)61649-9 [4] LAM VW, LAURENCE JM, PANG T, et al. A systematic review of a liver-first approach in patients with colorectal cancer and synchronous colorectal liver metastases[J]. HPB(Oxford), 2014, 16(2): 101. [5] 肖莉, 张倩雨, 马莹, 等. 氧化应激在肿瘤糖代谢中的作用研究[J]. 肿瘤, 2018, 38(9): 901. [6] DIXON SJ, LEMNERG KM, LAMPRECHT MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060. doi: 10.1016/j.cell.2012.03.042 [7] TOYOKUNI S, ITO F, YAMASHITA K, et al. Iron and thiol redox signaling in cancer: an exquisite balance to escape ferroptosis[J]. Free Radic Biol Med, 2017, 108(11): 610. [8] ZHOU C, DING J, WU Y. Resveratrol induces apoptosis of bladder cancer cells via miR21 regulation of the Akt/Bcl2 signaling pathway[J]. Mol Med Rep, 2014, 9(4): 1467. doi: 10.3892/mmr.2014.1950 [9] NOH KT, CHAE SH, CHUN SH, et al. Resveratrol suppresses tumor progression via the regulation of indoleamine 2, 3-dioxygenase[J]. Biochem Biophys Res Commun, 2013, 431(2): 348. doi: 10.1016/j.bbrc.2012.12.093 [10] 王晓燕, 范钰, 张尤历, 等. 白藜芦醇对大肠癌细胞hTERT表达及其启动子的影响[J]. 江苏大学学报(医学版), 2010, 20(1): 52. [11] GUINEY SJ, ADLARD PA, BUSH AI, et al. Ferroptosis and cell death mechanisms in Parkinson′s disease[J]. Neurochem Int, 2017, 104(14): 34. [12] 郭继鹏. 顺铂诱导肿瘤细胞发生Ferroptosis及其机制的初步研究[D]. 武汉: 华中科技大学, 2014. [13] ELING N, REUTER L, HAZIN J, et al. Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells[J]. Oncoscience, 2015, 2(5): 517. doi: 10.18632/oncoscience.160 [14] LIN R, ZHANG Z, CHEN L, et al. Dihydroartemisinin(DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Lett, 2016, 381(1): 165. doi: 10.1016/j.canlet.2016.07.033 [15] LOUANDRE C, MARCQ I, BOUHLAL H, et al. The retinoblastoma(Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells[J]. Cancer Lett, 2015, 356(2): 971. doi: 10.1016/j.canlet.2014.11.014 [16] GOUT PW, BUCKLEY AR, SIMMS CR, et al. Sulfasalazine, a potent suppressor of lymphoma growth by inhibition of the x(c)-cystine transporter: a new action for an old drug[J]. Leukemia, 2001, 15(10): 1633. doi: 10.1038/sj.leu.2402238 -





 下载:
下载: