-
2020年,WHO国际癌症研究机构(IARC)发布全球最新癌症数据显示,乳腺癌新增人数达226万,肺癌为220万,乳腺癌正式取代肺癌,成为全球第一大癌症[1]。三阴性乳腺癌(TNBC)是该疾病的一种亚型,其雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Her-2)不表达,占所有乳腺癌的15%~20%。由于TNBC对内分泌和靶向治疗不敏感, 化疗一直是TNBC的最合适的医疗选择。尽管已经有几种化疗药物可用,但是化疗药物的耐药性,非选择性细胞毒性,使得TNBC复发转移率高,毒性反应较重, 部分病人无法耐受,且预后较差, 亟需探索新的方法来改善TNBC的临床治疗效果。近年来,许多研究致力于发现具有低成本效益且不良反应小的新型天然抗癌药物[2]。因此,杨梅素及其衍生物的抗肿瘤作用引起学者们的极大兴趣,研究主要集中在杨梅素诱导细胞凋亡,抑制肿瘤细胞增殖、迁移与侵袭等。PHILLIPS等[3]研究表明杨梅素通过抑制磷脂酰肌醇3-激酶(PI3K)信号通路诱导胰腺癌细胞凋亡。SUN等[4]发现,杨梅素在人类膀胱癌细胞中也显示出抗癌活性,SHIH等[5]研究表明,杨梅素可以通过抑制细胞外信号调控激酶ERK信号通路,抑制A549细胞的迁移和侵袭。2017年,苏丽娟等[6]研究发现,杨梅素通过上调PHLPP1的表达抑制A549细胞迁移。有趣的是杨梅素对肿瘤细胞杀伤性具有浓度依懒性,对正常细胞却没有毒害作用[7]。研究[8]发现,不同化学结构的杨梅素衍生物其抗癌活性不同。因此,笔者设想能否对杨梅素母体化学式进行改造,使用化学合成这种容易获得的方法得到具有抗癌活性的杨梅素衍生物,通过对天然化合物杨梅素化学式进行改造,获得可用于TNBC治疗作用的化学物质,为临床提供作为TNBC化疗药物的可能选择。
-
胎牛血清(FBS)(Gibco, 美国),DMEM培养基(Gibco, 美国),胰酶消化液(碧云天生物), 青霉素-链霉素溶液(100×)(碧云天生物),二甲基亚砜(DMSO,MP Biomedicals,美国),CO2培养箱(Thermo,美国),电子分析天平(Mettler-Toledo仪器有限公司),高速台式冷冻离心机(Eppendorf,德国),全波长多功能酶标仪(Thermo,美国),正置荧光显微镜(Nikon,日本),FACS流式细胞仪(BD Biosciences,San Diego,CA,USA)。CCK-8试剂盒(碧云天生物),HE染色液(碧云天生物),TUNEL(TdT-mediated dUTP Nick-End Labeling)染色液(碧云天生物),Western blotting实验抗体(Proteintech, 北京),Bax兔多克隆抗体,50599-2-ig,1∶500;p53兔多克隆抗体,10442-1-AP; 1∶500;Caspase 3兔多克隆抗体19677-1-AP 1∶500;Bcl2兔多克隆抗体,26593 -1-AP,1∶500;β-肌动蛋白小鼠抗体BM0627,1∶500)。二抗:山羊抗兔IgG,SA00009-2,1∶10 000;山羊抗小鼠IgG,9J08BL101,1∶10 000。
-
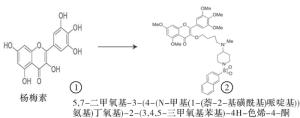
我们通过6步反应合成了杨梅素衍生物(见图 1、2):(1)用甲基碘保护杨梅素的羟基;(2)暴露其三个羟基;(3)用1,4-二溴丁烷桥连;(4)取代末端溴用1-Boc-4-甲基氨基哌啶;(5)除去Boc;(6)与磺酰氯反应得到化合物。最终试剂溶于DMSO。
-
小鼠TNBC细胞系4T1(CB16193857)获自中国科学院细胞系库(中国上海)。4T1细胞用DMEM培养基,该培养基包含10%胎牛血清(FBS),100 U/mL青霉素和100 mg/mL链霉素,于5%CO2的37 ℃培养箱中孵育。
-
用细胞计数试剂盒(CCK-8)对细胞活力进行定量评估。将约4×103/每孔的4T1细胞接种到96孔板中(每组6孔),并培养24 h,然后用重组杨梅素处理细胞,使杨梅素终浓度分别为1、3、5、5.5、6、8、10 μmol/mL,在24、48和72 h时间节点,将CCK-8溶液(10 μL)添加到每个孔中,并将细胞在37 ℃和5%CO2下进一步温育1 h。用酶标仪测定450 nm处的吸光度值(OD)。
-
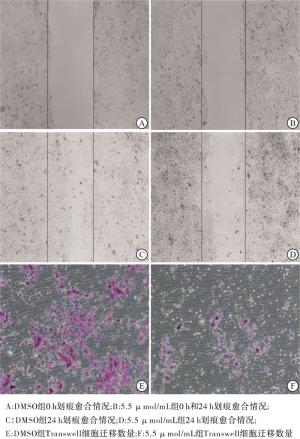
用于研究重组杨梅素对4T1细胞迁移的抑制作用。将4T1细胞以约1×105细胞/孔的适当密度接种到24孔板中。待细胞生长贴壁后(12 h),用200 μL的无菌移液器吸头机械刮划细胞单层以形成线性伤口。然后,将细胞用1×PBS冲洗一次,并用低浓度血清培养基(2%FBS)培养。随后用在DMSO中稀释的终浓度为5.5 μmol/mL的重组杨梅素干预细胞24 h。分别在划痕0、12和24 h显微镜拍摄图像,并通过ImageJ分析以计算划痕迁移率。划痕迁移率的计算公式如下:(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
-
重组杨梅素对小鼠TNBC细胞(4T1)侵袭能力的影响。将在-20 ℃的冰箱中冷冻的基质胶(MatrigelBD,356234)取出,并在4 ℃放置过夜,使其变成液体。无血清培养基(1∶8)稀释液体基质胶,将50 μL的稀释基质胶添加到每个Transwell小室(孔径为8 μm, Corning)的上室中,并放在37 ℃的培养箱中1 h。然后从上室中除去残留的液体,烘干备用。在上室中加入100 μL的4T1细胞(约5×104细胞/孔)的无血清培养基。同时加入重组杨梅素和对照组DMSO,使得终浓度为5.5 μmol/mL。Transwel下室加入完全的培养基,充满24孔板。每组3个复孔。温育24 h后,一些细胞已通过膜迁移,并且将迁移的细胞固定至HE染色。显微镜观察穿过膜的细胞数量,每个孔随机选择5个视野计数。
-
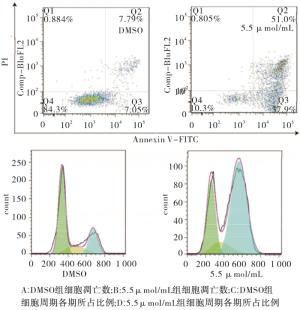
将4T1细胞接种接种于六孔板中,并用5.5 μmol/mL重组杨梅素干预24 h。对照组加入同体积的DMSO。用0.25%的胰蛋白酶消化细胞,并用总共100 μL的冷1×PBS重悬至终浓度约为1×106/mL的细胞。然后,将5 μL的V-FITC添加至各组细胞悬浮液中,避光室温孵育10 min。随后在4 ℃下再添加10 μL碘化丙啶(PI),15 min后,使用流式细胞仪分析样品。每组3个重复。对于细胞周期测定,按凋亡测定中所述处理相同量的4T1细胞。悬浮的细胞用4%甲醛固定30 min,并用1×PBS洗涤3次。然后将细胞沉淀在室温下于400 μL PI(50 μg/mL)中孵育30 min,流式细胞仪上机检测。流式分析软件Flowjo分析G0/G1、S和G2/M期的细胞比例。
-
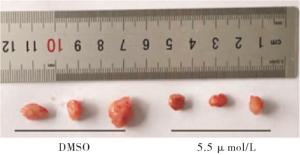
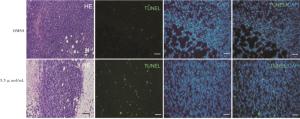
体内异种移植模型所有动物实验均获得蚌埠医学院伦理委员会的批准,并按照我们机构的规则进行。BALB/c小鼠(4周龄)购自合肥实验动物中心(中国合肥),通过皮下注射1×107细胞/毫升的4T1细胞建立将其置于雌性Balb/c小鼠的右腋下脂肪垫,建立了TNBC肿瘤异种移植模型,该模型用于评估重组杨梅素的抗肿瘤活性,当平均肿瘤大小达到500 mm3时,将小鼠分成2组(每组3只),每2 d用游标卡尺监测和测量肿瘤的生长,并根据下式计算肿瘤体积(V):V(mm3)= 1/2×长(mm)×宽(mm2), 分别在第5天和第10天,将重组杨梅素(50 μL,5.5 μmol/mL)注入肿瘤部位,并以相同体积的DMSO注入对照组。最后一次重组杨梅素治疗5 d后,即成瘤分组后第15天收集小鼠肿瘤并测量重量和大小。将肿瘤组织石蜡包埋,切片,脱蜡,脱水后分别进行HE和TUNEL染色。
-
4T1细胞接种到六孔板中,并在细胞贴壁后24 h使用5.5 μmol/mL重组杨梅素干预细胞。对照组用相同体积的DMSO处理,收集细胞,并在冰冷的1×PBS中洗涤2次。将细胞在RIPA缓冲液冰上裂解30 min,期间轻轻吹打细胞,离心裂解物并收集上清液。用BCA法蛋白质浓度检测试剂盒(23227,美国Thermo Scientific)测量蛋白质浓度并计算标准曲线。后续步骤简而言之,在电泳后,用10%SDS-PAGE凝胶分离30 μg蛋白质,并转移到补充有蛋白酶和磷酸酶抑制剂的PVDF膜上。用TBST(pH 7.4,含0.1%Tween-20的TBS)中的5%脱脂奶粉封闭1 h后,将膜与检测一抗在4 ℃下孵育过夜。洗涤后,将印迹与偶联至辣根过氧化物酶的对应的二抗一起孵育。使用化学发光对辣根过氧化物酶显影液显影的蛋白条带进行定量。β-肌动蛋白用作负载对照。使用ImageJ软件(1.48 v版)对信号强度进行定量。每种蛋白质的定量实验3次重复。
-
采用t检验、方差分析和q检验。
-
不同时间节点,与DMSO组比较,1、3、5 μmol/mL浓度重组杨梅素组4T1乳腺癌细胞划痕率差异均无统计学意义(P>0.05),5.5、6、8、10 μmol/mL浓度重组杨梅素组4T1乳腺癌细胞划痕率降低,差异均有统计学意义(P<0.05~P<0.01);重组杨梅素对4T1乳腺癌细胞抑制存在浓度依赖性,可在5.5 μmol/mL浓度对TNBC细胞增殖有较好的抑制作用(见表 1)。
分组 n 24 h 48 h 72 h DMSO 6 0.566±0.054 1.906±0.302 2.126±0.233 1 μmol/mL 6 0.531±0.096 1.879±0.226 2.220±0.086 3 μmol/mL 6 0.476±0.101 1.592±0.201 2.097±0.237 5 μmol/mL 6 0.425±0.074 1.020±0.160** 1.707±0.221 5.5 μmol/mL 6 0.276±0.051 0.354±0.078** 0.564±0.178** 6 μmol/mL 6 0.238±0.044** 0.251±0.024** 0.468±0.094** 8 μmol/mL 6 0.178±0.083** 0.193±0.032** 0.183±0.035** 10 μmol/mL 6 0.163±0.039** 0.200±0.032** 0.191±0.030** F — 31.33 131.47 194.94 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.005 0.027 0.026 q检验:不同时间节点与DMSO组比较**P<0.01 表 1 不同时间节点及浓度重组杨梅素对4T1细胞的抑制作用(x±s)
-
与DMSO组相比,5.5 μmol/mL的新型重组杨梅素组细胞计数和迁移率均降低,差异有统计学意义(P<0.01),5.5 μmol/mL的新型重组杨梅素有抑制4T1细胞迁移与侵袭能力(见图 3、表 2)。
分组 细胞计数
(Transwell,n=5)迁移率/%
(划痕,n=4)DMSO 109.00±5.60 0.99±0.000 6 5.5 μmol/mL 30.00±4.79 0.97±0.000 9 t 23.97 36.98 P < 0.01 < 0.01 表 2 5.5 μmol/mL新型重组杨梅素衍生物对4T1细胞侵袭和迁移能力的影响(x±s)
-
与DMSO组相比,5.5 μmol/mL新型重组杨梅素干预4T1细胞凋亡细胞数增高,细胞周期显示,G1期细胞比例较低,G2期细胞比率增高,差异有统计学意义(P<0.01);TNBC细胞在5.5 μmol/mL的新型重组杨梅素干预后24 h,4T1细胞早期凋亡显著,与DMSO组相比G1期、G2期细胞所占比例显著增加(见图 4、表 3)。
分组 n 凋亡 G1期 S期 G2期 DMSO 3 7.21±0.45 56.87±4.09 22.62±4.71 18.52±1.92 5.5 μmol/mL 3 53.3±1.45 30.79±1.69 12.44±0.84 53.18±4.90 t — 30.34 5.90 2.13 6.59 P — < 0.01 < 0.01 >0.05 < 0.01 表 3 5.5 μmol/mL重组杨梅素对4T1细胞凋亡和周期的影响(x±s)
-
与DMSO组相比,5.5 μmol/mL新型重组杨梅素组肿瘤生长体积和肿瘤重量均较小,差异有统计学意义(P<0.05),新型重组杨梅素可抑制荷瘤小鼠乳腺癌肿瘤细胞增殖,并诱导肿瘤细胞凋亡(见图 5、6及表 4)。
分组 肿瘤成长体积/mm3
(n=8)肿瘤重量/g
(n=3)DMSO 545.00±38.73 1.205±0.109 5.5 μmol/mL 447.40±18.47 0.837±0.047 t 2.28 3.10 P < 0.05 < 0.05 表 4 5.5 μmol/mL新型重组杨梅素衍生物对小鼠移植肿瘤生长的影响(x±s)
-
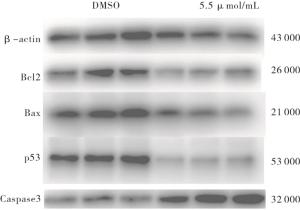
与DMSO组相比,重组杨梅素组p53和Bcl2蛋白下调,Caspase 3上调,差异有统计学意义(P<0.05~P<0.01),重组杨梅素可通过下调突变型p53基因从而引起4T1细胞周期阻滞,并通过改变Bax和Bcl2基因比值变化,上调Caspase 3基因蛋白表达诱导乳腺癌细胞凋亡(见图 7、表 5)。
分组 n p53 Bcl2 Bax Caspase 3 DMSO 3 0.952±0.022 0.940 5±0.091 6 0.903 1±0.068 5 0.514±0.0403 5.5 μmol/mL 3 0.370±0.026 0.624 1±0.058 2 0.743 2±0.067 3 0.725±0.043 3 t — 16.91 2.93 1.67 3.57 P — < 0.01 < 0.05 >0.05 < 0.05 表 5 5.5 μmol/mL新型重组杨梅素对凋亡相关基因蛋白表达的影响(x±s)
-
全球范围内乳腺癌的治疗取得长足进步,免疫治疗、靶向治疗等精准治疗相继出现,但是乳腺癌高致病性和较高死亡率仍然是给全世界病人带来极大痛苦。TNBC是该疾病的一种亚型,由于TNBC对内分泌和靶向治疗不敏感, 术后化疗一直是TNBC的最合适的医疗选择。尽管已经有几种化疗药物可用,但是化疗药物的耐药性和非选择性细胞毒性使得TNBC复发转移率高, 毒性反应较重, 部分病人无法耐受,且预后较差, 鉴于杨梅素及其衍生物在许多癌种中表现出抗癌活性,也基于前期研究[9],我们致力于用新的方法发现一种具有低成本效益且易获得的抗癌化合物。
杨梅素(3、5、7、3′,4′,5′-六羟基黄酮)是一种比较常见的黄酮类化学物质,广泛存在于日常蔬菜、水果和全谷类食品中[10], 近年来研究发现杨梅素及其衍生物在抗肿瘤作用中显示出巨大潜力。天然植物提取化合物杨梅素可通过抑制肿瘤细胞增殖、迁移,并诱导肿瘤细胞凋亡达到肿瘤治疗的作用。且杨梅素衍生物化学结构的不同,显示出抗肿瘤细胞的特异性[11]。鉴于天然植物提取物不易获得量产,因此我们考虑对天然母体杨梅素化学式进行化学改造,得到化学式为5, 7-二甲氧基-3-(4-(N-甲基(1-(2-硝基苯磺酰基)哌啶基))氨基)丁氧基)-2-(3, 4, 5-三甲氧基苯基)-4H-色烯-4-酮的化合物,前期研究在肺癌细胞系中显示出明显抑制肿瘤细胞增殖的作用[9]。在此,我们探讨其对小鼠TNBC(4T1)细胞是否具有抑制细胞增殖和诱导细胞凋亡的作用。
从实验结果来看,CCK-8细胞增殖抑制试验显示新型杨梅素4T1细胞增殖,且具有浓度依赖性,达半数细胞抑制的浓度为5.5 μmol/mL。后续实验选择该浓度作为实验的使用浓度。转移是肿瘤细胞具有侵袭性的特征,抑制侵袭对遏制肿瘤扩散大有助益。我们知道,降解细胞外基质和肿瘤周围正常组织基底膜蛋白是肿瘤转移的重要一步,有研究表明杨梅素可下调基质金属蛋白酶9(MMP-9)抑制肝癌细胞迁移和侵袭[12];二氢杨梅素可通过抑制TNF-α /p38MAPK/MMP-2信号通路,抑制骨肉瘤细胞的迁移和侵袭[13]。划痕和Transwell实验结果显示,5.5 μmol/mL的重组新型杨梅素可抑制4T1细胞划痕面积愈合和细胞穿透Transwell小室膜的能力。表明合成的重组杨梅素杨梅素衍生物可抑制肿瘤细胞迁移和侵袭。为验证重组杨梅素衍生物在体内作用活性,我们建立小鼠TNBC移植瘤模型。结果显示与对照组相比,重组杨梅素衍生物作用组可显著减小肿瘤体积和重量,HE染色发现肿瘤细胞出现明显坏死迹象,表明该衍生物在小鼠体内发挥作用。凋亡是可调节的细胞程序性死亡的一种生化过程,通过该过程可以将受损的细胞和异常的细胞清除。人们利用这一过程,对受损或者癌变的细胞进行干预,达到清除该异常细胞的作用。本文实验结果显示,在体外,与对照组相比重组杨梅素衍生物可诱导细胞发生凋亡,流式细胞检测Q2晚期凋亡细胞数量显著增加;在体内移植瘤模型,肿瘤细胞TUNEL染色显示凋亡细胞数量增加。表明重组杨梅素衍生物可在体内和体外诱导细胞凋亡。细胞凋亡有多种途径,主要有外部途径(死亡受体介导的)和内在途径(线粒体介导的)两种。凋亡的外在途径主要是通过与配体Fas-FasL结合的死亡受体激活,刺激配体会导致Caspase 8募集并随后激活Caspase 3[14]。正常细胞很少发生凋亡是因为有凋亡抑制物存在,凋亡启动蛋白会调节细胞内蛋白功能,使得凋亡蛋白和抑制物蛋白达到动态平衡。若细胞遭受打击或者长期刺激,凋亡启动蛋白和抑制蛋白的平衡被打破,凋亡程序被启动。细胞结构破坏,DNA断裂片段化。此为线粒体途径诱导细胞凋亡[15-16]。研究[17]表明,杨梅素在通过降低Bcl-2水平,同时结合核糖体S6激酶增加Bax和裂解的Caspase 3,上调Mad1的表达,诱导HGC-27和SGC7901胃癌细胞凋亡并抑制增殖。同时,在U251人神经胶质瘤细胞中,杨梅素具有浓度依赖性的促凋亡作用,其中Bax和Bad上调以及Bcl-2下调[18-19]。杨梅素干预后的肿瘤细胞,使得Bcl-2家族蛋白通过调节促凋亡蛋白Bax和抗凋亡蛋白Bcl2平衡,改变线粒体膜通透性和完整性,以及通过激活Caspase 3级联以达到诱导细胞凋亡的作用[20]。本研究Western blotting实验检测凋亡相关基因蛋白表达,结果显示,p53、Bcl2下调,Bax变化不明显。Caspase 3上调。表明合成衍生物通过调节Bcl-2家族蛋白促凋亡Bax和抗凋亡蛋白Bcl-2之间平衡,改变线粒体膜通透性和完整性,激活Caspase 3级联,使得4T1细胞通过线粒体途径凋亡。有趣的是本实验p53蛋白表达是下调的,这与HUANG等[21]在卵巢癌中p53上调的研究结果不同。笔者分析可能是合成的杨梅素衍生物化学式改变,其起作用的机制不同。本文p53蛋白表达下调可能与细胞周期阻滞有关,流式结果显示实验组细胞G1期和G2期细胞所占比例增加。有学者研究杨梅素抑制肿瘤细胞增殖的同时,发现其对正常细胞没有杀伤作用[7, 21],亦有研究杨梅素与其他杨梅素衍生物的其他酮类化合物诱导细胞凋亡作用进行了比较[22],ZHENG等[23]发现杨梅素可以对肿瘤放疗起到增敏的作用,这对TNBC治疗具有重要意义。关于杨梅素治疗肿瘤的作用基础研究已经有很多,但是体内使用的临床实验还鲜见报道。后续我们会增加重组杨梅素在正常细胞中的毒性作用观察,并和母体杨梅素治疗肿瘤效果进行比较。为杨梅素治疗肿瘤在临床应用提供证据。
总之,我们通过对杨梅素母体化学式进行改造,得到重组杨梅素衍生物可以在体内和体外抑制小鼠TNBC增殖、迁移侵袭,并诱导细胞凋亡。衍生物可以调节Bcl2家族基因蛋白表达,通过线粒体凋亡途径诱导TNBC凋亡。该重组杨梅素有望成为TNBC治疗药物的选择。
新型重组杨梅素对三阴性乳腺癌的抑制作用及机制研究
Inhibitory effect and mechanism of novel recombinant myricetin on triple negative breast cancer
-
摘要:
目的探讨新型重组杨梅素抑制4T1细胞的作用及机制。 方法通过对杨梅素化学式改造合成一种新的杨梅素衍生物;CCK-8细胞增殖力抑制实验,并计算半数抑制浓度(IC50)。划痕与Transwell实验观察新型杨梅素对4T1细胞迁移与侵袭能力的影响。流式细胞术观察4T1细胞在合成杨梅素干预后其周期与凋亡的变化情况,小鼠体内移植瘤模型评估新型杨梅素在模拟体内环境下对小鼠三阴性乳腺癌(TNBC)的抑制作用。HE和TUNEL染色观察小鼠移植肿瘤组织切片的细胞坏死与凋亡。最后,Western blotting检测4T1细胞干预后其相关蛋白(p53、Bcl2、Bax、Caspase 3)的表达。 结果IC50为5.5 μmol/mL。与DMSO组相比,5.5 μmol/mL新型重组杨梅素在作用于4T1细胞24 h,细胞计数和迁移率均降低,差异有统计学意义(P<0.01)。流式细胞术和肿瘤组织切片TUNEL染色结果显示,与DMSO组相比,5.5 μmol/mL新型重组杨梅素细胞凋亡细胞数增高,G1期细胞比例较低,G2期细胞比率增高,肿瘤生长体积和肿瘤重量均较小,p53和Bcl2蛋白下调,Caspase 3上调,差异有统计学意义(P<0.05~P<0.01)。 结论新型重组杨梅素可在体外和体内诱导4T1细胞凋亡,抑制其增殖。可能通过下调p53抑制4T1细胞增殖,通过Bcl2线粒体凋亡途径诱导4T1细胞凋亡。 Abstract:ObjectiveTo investigate the inhibitory effect and mechanism of novel recombinant myricetin on 4T1 cells. MethodsA new myricetin derivative was synthesized by modifying the chemical formula of myricetin.CCK-8 cell proliferation inhibition assay, and half inhibitory concentration(IC50) was calculated.The effects of novel myricetin on the migration and invasion of 4T1 cells were observed by scratch and Transwell assay.Flow cytometry was used to observe the changes of the cycle and apoptosis of 4T1 cells after the intervention of synthetic myricetin.The inhibitory effect of the novel myricetin on triple negative breast cancer(TNBC) was evaluated in the mouse tumor transplantation model in vivo.HE and TUNEL staining were used to observe the cell necrosis and apoptosis in transplanted tumor tissue sections of mice.Finally, the expression of related proteins(P53, Bcl2, Bax, Caspase 3) in 4T1 cells after intervention was detected by Western bloting. ResultsThe IC50 was 5.5 μmol/mL.Compared with DMSO group, the cell count and migration rate of 4T1 cells were decreased after treated with 5.5 μmol/mL novel myricetin for 24 h(P<0.01).Flow cytometry and TUNEL staining of tumor tissue sections showed that compared with DMSO group, the number of apoptotic cells was increased, the proportion of G1 phase cells was lower, the proportion of G2 phase cells was higher, the tumor growth volume and tumor weight were smaller, p53 and Bcl2 proteins were down-regulated, Caspase 3 was up-regulated in 5.5 μmol/mL recombinant myricetin group(P<0.05 to P<0.01). ConclusionsThe novel recombinant myricetin can induce the apoptosis and inhibit proliferation of 4T1 cells in vitro and in vivo, which may inhibit the proliferation of 4T1 cells by down-regulating p53 and induce the apoptosis of 4T1 cells through the Bcl2 mitochondrial apoptosis pathway. -
Key words:
- triple negative breast cancer /
- novel myricetin /
- 4T1 cells /
- apoptosis
-
表 1 不同时间节点及浓度重组杨梅素对4T1细胞的抑制作用(x±s)
分组 n 24 h 48 h 72 h DMSO 6 0.566±0.054 1.906±0.302 2.126±0.233 1 μmol/mL 6 0.531±0.096 1.879±0.226 2.220±0.086 3 μmol/mL 6 0.476±0.101 1.592±0.201 2.097±0.237 5 μmol/mL 6 0.425±0.074 1.020±0.160** 1.707±0.221 5.5 μmol/mL 6 0.276±0.051 0.354±0.078** 0.564±0.178** 6 μmol/mL 6 0.238±0.044** 0.251±0.024** 0.468±0.094** 8 μmol/mL 6 0.178±0.083** 0.193±0.032** 0.183±0.035** 10 μmol/mL 6 0.163±0.039** 0.200±0.032** 0.191±0.030** F — 31.33 131.47 194.94 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.005 0.027 0.026 q检验:不同时间节点与DMSO组比较**P<0.01 表 2 5.5 μmol/mL新型重组杨梅素衍生物对4T1细胞侵袭和迁移能力的影响(x±s)
分组 细胞计数
(Transwell,n=5)迁移率/%
(划痕,n=4)DMSO 109.00±5.60 0.99±0.000 6 5.5 μmol/mL 30.00±4.79 0.97±0.000 9 t 23.97 36.98 P < 0.01 < 0.01 表 3 5.5 μmol/mL重组杨梅素对4T1细胞凋亡和周期的影响(x±s)
分组 n 凋亡 G1期 S期 G2期 DMSO 3 7.21±0.45 56.87±4.09 22.62±4.71 18.52±1.92 5.5 μmol/mL 3 53.3±1.45 30.79±1.69 12.44±0.84 53.18±4.90 t — 30.34 5.90 2.13 6.59 P — < 0.01 < 0.01 >0.05 < 0.01 表 4 5.5 μmol/mL新型重组杨梅素衍生物对小鼠移植肿瘤生长的影响(x±s)
分组 肿瘤成长体积/mm3
(n=8)肿瘤重量/g
(n=3)DMSO 545.00±38.73 1.205±0.109 5.5 μmol/mL 447.40±18.47 0.837±0.047 t 2.28 3.10 P < 0.05 < 0.05 表 5 5.5 μmol/mL新型重组杨梅素对凋亡相关基因蛋白表达的影响(x±s)
分组 n p53 Bcl2 Bax Caspase 3 DMSO 3 0.952±0.022 0.940 5±0.091 6 0.903 1±0.068 5 0.514±0.0403 5.5 μmol/mL 3 0.370±0.026 0.624 1±0.058 2 0.743 2±0.067 3 0.725±0.043 3 t — 16.91 2.93 1.67 3.57 P — < 0.01 < 0.05 >0.05 < 0.05 -
[1] World Health Organization. World Cancer Report: Cancer Research for Cancer Prevention[R]. Geneva: WHO, 2020. [2] LEE MM, CHAN BD, WONG WY, et al. Synthesis and evaluation of novel anticancer compounds derived from the natural product brevilin A[J]. ACS Omega, 2020, 5(24): 14586. doi: 10.1021/acsomega.0c01276 [3] PHILLIPS PA, SANGWAN V, BORJA-CACHO D, et al. Myricetin induces pancreatic cancer cell death via the induction of apoptosis and inhibition of the phosphatidylinositol 3-kinase(PI3K) signaling pathway[J]. Cancer Lett, 2011, 308(2): 181. doi: 10.1016/j.canlet.2011.05.002 [4] SUN F, ZHENG XY, YE J, et al. Potential anticancer activity of myricetin in human T24 bladder cancer cells both in vitro and in vivo[J]. Nutr Cancer, 2012, (64): 599. [5] SHIH YW, WU PF, LEE YC, et al. Myricetin suppresses invasion and migration of human lung adenocarcinoma A549 cells: possible mediation by blocking the ERK signaling pathway[J]. J Agric Food Chem, 2009, 57(9): 3490. doi: 10.1021/jf900124r [6] 苏丽娟, 付有荣, 田莉, 等. 杨梅素通过上调PHLPP1的表达抑制A549细胞迁移[J]. 临床和实验医学杂志, 2017, 16(2): 131 doi: 10.3969/j.issn.1671-4695.2017.02.009 [7] JAYAKUMAR JK, NIRMALA P, PRAVEEN KUMAR, BA, et al. Evaluation of protective effect of myricetin, a bioflavonoid in dimethyl benzanthracene-induced breast cancer in female Wistar rats[J]. South Asian J Cancer, 2014, 3: 107. doi: 10.4103/2278-330X.130443 [8] SEMWAL DK, SEMWAL RB, COMBRINCK S, et al. Myricetin: A dietary molecule with diverse biological activities[J]. Nutrients, 2016, 8(2): 90. doi: 10.3390/nu8020090 [9] XUE W, SONG BA, ZHAO HJ, et al. Novel myricetin derivatives: Design, synthesis and anticancer activity[J]. Eur J Med Chem, 2015, 97: 155. doi: 10.1016/j.ejmech.2015.04.063 [10] HA TK, JUNG I, KIM ME, et al. Anti-cancer activity of myricetin against human papillary thyroid cancer cells involves mitochondrial dysfunc-tion-mediated apoptosis[J]. Biomed Pharmacother, 2017, 91: 378. doi: 10.1016/j.biopha.2017.04.100 [11] SHIOMI K, KURIYAMA I, YOSHIDA H, et al. Inhibitory effects of myricetin on mammalian DNA polymerase, topoisomerase, and human cancer cell proliferation[J]. Food Chem Toxicol, 2013, 139(1/4): 910. [12] HANG QY, LI R, ZENG GF, et al. Dihydromyricetin inhibits migration and invasion of hepatoma cells through regulation of MMP-9 expression[J]. World J Gastroenterol, 2014, 20(29): 10082. doi: 10.3748/wjg.v20.i29.10082 [13] LIU C, ZHAO P, YANG Y, et al. Ampelopsin suppresses TNF-α induced migration and invasion of U2OS osteosarcoma cells[J]. Mol Med Rep, 2016, 13(6): 4729. doi: 10.3892/mmr.2016.5124 [14] DU P, LI SJ, OJCIUS DM, et al. A novel Fas-binding outer membrane protein and lipopolysaccharide of Leptospira interrogans induce macrophage apoptosis through the Fas/FasL-caspase-8/-3 pathway[J]. Emerg Microbes Infect, 2018, 7(1): 135. [15] HAO Q, CHEN J, LIAO J, et al. p53 induces ARTS to promote mitochondrial apoptosis[J]. Cell Death Dis, 2021, 12(2): 204. doi: 10.1038/s41419-021-03463-8 [16] 时宗芬, 鲁星月, 张配, 等. 3-溴丙酮酸增强人鼻咽癌细胞对顺铂敏感性的作用及机制研究[J]. 蚌埠医学院学报, 2020, 45(9): 1147. [17] FENG J, CHEN X, WANG Y, et al. Myricetin inhibit-sproliferation and induces apoptosis and cell cycle arrest in gastric cancer cells[J]. Mol Cell Biochem, 2015, 408(1/2): 163. [18] LI HG, CHEN JX, XIONG JH, et al. Myricetin exhibits anti-glioma potential by inducing mitochondrial-mediated apoptosis, cell cycle arrest, inhibition of cell migration and ROS generation[J]. J BUON, 2016, 21(1): 182. [19] 董正远, 许河南, 王文锐, 等. 紫杉醇长循环纳米胶束联合vMIP-ⅡN端肽逆转乳腺癌细胞耐药的研究[J]. 蚌埠医学院学报, 2020, 45(9): 1141. [20] ADAMKOV M. Logical complexity of Bcl-2 family proteins function in the intrinsic apoptosis[J]. SPR ARK CELOK LEK, 2019, 147(1/2): 99. [21] HUANG H, CHEN AY, YE X, et al. Myricetin inhibits proliferation of cisplatin-resistant cancer cells through a p53-dependent apoptotic pathway[J]. Int J Oncol, 2015, 47(4): 1494. doi: 10.3892/ijo.2015.3133 [22] ABOTALEB M, SAMUEL SM, VARGHESE E, et al. Flavonoids in Cancer and Apoptosis[J]. Cancers(Basel), 2018, 11(1): 28. [23] ZHENG AW, CHEN YQ, ZHAO LQ, et al. Myricetin induces apoptosis and enhances chemosensitivity in ovarian cancer cells[J]. Oncol Lett, 2017, 13(6): 4974. doi: 10.3892/ol.2017.6031 -




 下载:
下载: