-
继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT)是慢性肾脏病病人最常见的严重并发症之一[1],在透析病人中SHPT的发病率可高达50%,且严重影响透析病人的生活质量和生存率[2]。目前对SHPT的发病机制、疾病进展影响因素及预后等方面的研究尚不深入,需进一步研究。越来越多的证据支持慢性炎症是导致细胞增生和肿瘤发生、进展的确切因素之一,NOD样受体家族蛋白3(NOD-like receptor family pyrin domain containing 3, NLRP3)炎性小体是目前研究最为深入且在多种细胞中表达的炎性体[3],其在细胞增生及肿瘤发生、发展等方面的起到一定作用,但NLRP3在SHPT中的作用尚未阐明。本研究旨在探讨NLRP3在SHPT中的表达情况,并分析其与SHPT临床病理特征的关系。现作报道。
-
收集安徽医科大学第二附属医院
2017年10月至2019年4月因SHPT行手术切除的甲状旁腺组织和术前血清标本各88例,收集因甲状腺癌行甲状腺全切除术并在病理切片中发现正常甲状旁腺组织且无肾脏病者10例。收集健康体检人群的血清标本14例作为对照组。
-
从病理科调取相关病例的甲状旁腺组织蜡块,切片(厚3~4 μm)常规脱蜡,水化,行HE染色。每例切片显微镜下随机选取10个互不重叠的视野进行观察拍照,分别由2名病理医生明确诊断。
-
蜡块切片(厚3~4 μm)常规脱蜡,水化,枸橼酸钠、微波修复后,按免疫组织化学试剂盒(福州迈新)说明书步骤检测NLRP3(1∶100,美国Santa Cruz),PBS作为阴性对照,显微镜下观察并拍照。
-
收集88例SHPT病人术前血清和14名健康体检人群的血清标本,严格按照ELISA试剂盒(武汉基因美)说明书步骤检测血中NLRP3水平。
-
NLRP3蛋白免疫组织化学阳性主要表达于细胞质,呈棕黄色颗粒状。随机选取10个高倍镜视野,分别由2名病理医生判读,以阳性细胞所占细胞总数的比例分级,采用半定量法进行染色结果判读:无明显阳性细胞为阴性(-), < 25%为弱阳性(+),25%~50%为阳性(2+),>50%为强阳性(3+)。
-
采用t检验和秩和检验。
-
88例SHPT病人中男54例,女34例;年龄30~73岁,中位年龄50岁;血液透析75例,腹膜透析4例,血液透析联合腹膜透析9例;透析龄1~16年,平均8年,其中≤5年21例,>5~ < 10年36例,≥10年31例。
-
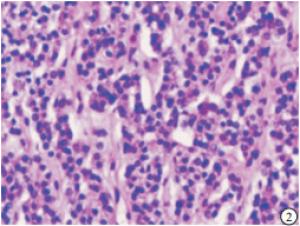
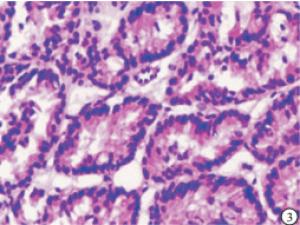
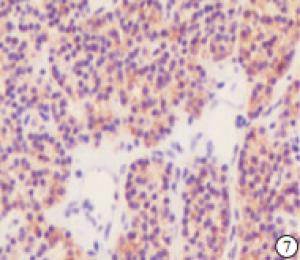
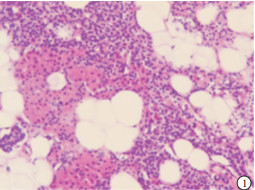
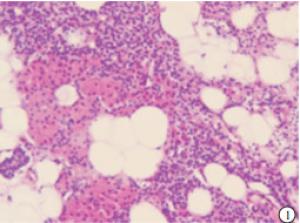
HE染色切片显示,正常的甲状旁腺腺细胞排列成索团状,其间富含有孔毛细血管及少量结缔组织,还可见较多的脂肪细胞(见图 1);SHPT病人甲状旁腺中主细胞和嗜酸性细胞普遍体积变大,排列成弥漫性的实性片状(见图 2),或者呈结节、梁状、滤泡状、腺泡样形态,也可以呈菊形团样、乳头状,常见的是不同排列形态混合形成腺瘤样增生,间质内仅见少量脂肪细胞,周围有纤维结缔组织分隔(见图 3)。
-
88例SHPT病人的术前血清NLRP3的表达水平为(290.66±72.53),明显高于健康体检人群的血清NLRP3的水平(75.59±20.05)(t′=22.86,P < 0.01)。
-
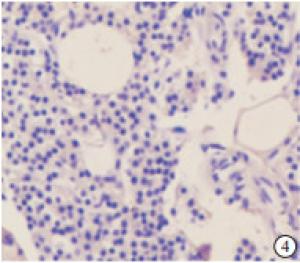
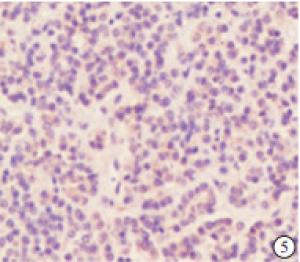
检测88例SHPT病人的甲状旁腺组织和10例因甲状腺疾病行甲状腺全切手术时带有正常甲状旁腺且无肾脏病者的甲状旁腺组织,结果NLRP3蛋白在正常甲状旁腺组织中的阳性率为20.00%,且为弱阳性(见图 4),NLRP3蛋白在SHPT病人的甲状旁腺组织中的阳性率为95.45%,表现为不同程度的阳性(见图 5~7)。NLRP3蛋白在SHPT病人异常增生的甲状旁腺组织中的表达率显著高于正常甲状旁腺组织(P < 0.01)(见表 1)。不同性别、年龄、透析方式、透析龄等SHPT病人甲状旁腺组织中NLRP3蛋白表达差异均无统计学意义(P>0.05)(见表 2)。
分组 n NLRP3 Z P - + 2+ 3+ 增生的甲状旁腺组织 88 4 10 39 35 正常的甲状旁腺组织 10 8 2 0 0 5.06 < 0.01 合计 98 12 12 39 35 表 1 NLRP3在正常甲状旁腺组织及SHPT病人的甲状旁腺组织中的表达
临床病理参数 n NLRP3 Z P - + 2+ 3+ 性别 男 54 2 7 22 23 0.46 >0.05 女 34 2 3 17 12 年龄/岁 < 50 42 1 6 16 19 0.76 >0.05 ≥50 46 3 4 23 16 透析方式 血液透析 75 4 8 34 29 腹膜透析 4 0 1 2 1 1.30* >0.05 血液透析联合腹膜透析 9 0 1 3 5 透析龄/年 ≤5 21 2 4 9 6 >5~ < 10 36 0 3 18 15 2.91 >0.05 ≥10 31 2 3 12 14 *示χ2值 表 2 不同临床参数SHPT病人甲状旁腺组织中NLRP3蛋白表达
-
SHPT是慢性肾脏病病人,尤其是透析病人最常见的并发症之一,可导致皮肤瘙痒、骨骼畸形、身高缩短、面貌改变、血管钙化等,钙磷代谢紊乱严重者可发生转移性钙化、骨痛、病理性骨折等诸多症状,明显影响了病人的生存质量,增加了治疗费用。因此,探讨SHPT的发病机制、疾病进展影响因素及预后等有重要的经济和社会意义。
传统观点认为慢性肾脏病病人出现SHPT的根本原因是增生的甲状旁腺组织分泌过量的甲状旁腺激素(PTH),PTH可促进骨溶解,使钙磷释放入血,促进肾小管对钙离子的重吸收和磷酸盐的排泄,使血钙浓度增加和血磷浓度下降,代偿性维持血钙、血磷正常。而发生SHPT的主要机制是,慢性肾功能不全时肾小球滤过率下降,肾脏排磷减少,血磷增高,高磷血症可引起血钙降低。同时由于肾1α-羟化酶缺乏,1, 25(OH)2D3生成受阻,肠钙吸收不足、排出增多,血钙降低,低血钙和高血磷刺激甲状旁腺腺体增生和肥大[4]。甲状旁腺细胞最初表现为弥漫性增生,长期的低钙、高磷刺激使甲状旁腺进一步增大,可呈结节性增生,甲状旁腺由代偿性功能亢进发展成自主性功能亢进,最终形成甲状旁腺腺瘤,合成、分泌过量的PTH[5],从而导致一系列症状的出现。本研究发现SHPT病人的甲状旁腺组织可呈弥漫性或腺瘤样增生,镜下形态表现多种多样。
在慢性炎症的长期刺激下,炎症调节因子和炎症细胞可导致增生的细胞在基因水平发生变化,甚至发生瘤变、癌变等[6]。炎性体是机体固有免疫及应激系统的重要防御成分,其中各种内源性或外源性的刺激可通过不同的信号通路激活NLRP3炎性体,使caspase-1活化,引起白细胞介素(IL)-1β、IL-18等促炎细胞因子成熟分泌,进而促进炎症和肿瘤的发生。近年来,NLRP3炎性体在炎症及纤维化中的研究较多,我们既往的研究[7-9]表明,肾小管上皮细胞在长期大量蛋白尿的慢性刺激下可发生NLRP3炎性体激活,IL-1β和IL-18水平升高,间质内有较多的淋巴细胞及单核细胞浸润,最终导致慢性肾小管间质炎症和纤维化的发生,从而导致慢性肾脏病的进展。
随着对NLRP3炎性体研究领域的逐渐扩大,近几年的研究着重于NLRP3在细胞增生及肿瘤方面的作用,从新的视角研究炎症相关的增生及肿瘤的发病机制以及治疗方法已成为NLRP3炎性体研究领域的新热点[10]。据报道,幽门螺杆菌感染可导致胃慢性炎症和介导炎性细胞因子如NLRP3炎性体激活后的产物IL-1β、肿瘤坏死因子α、IL-6释放增加,可能引发胃黏膜上皮细胞增生和癌变[11]。NLRP3炎性体与细胞周期蛋白-D1启动子结合并促进其在胃上皮细胞中的转录,NLRP3可能与增强上皮细胞增生和胃肿瘤的发生有关。此外,IL-1β与其受体结合并激活NF-κB,启动JNK信号转导,引起上皮细胞的增生、侵袭和癌症发展[12]。LI等[13]发现,MiR-22是胃黏膜上皮细胞和巨噬细胞中NLRP3下调的必需调节剂,这表明MiR-22在抑制NLRP3炎性体表达中具有重要作用,而MiR-22可直接靶向抑制NLRP3并在体外和体内减弱其致癌作用。HUANG等[14]研究表明头颈部鳞状细胞癌组织中NLRP3炎性体表达升高,其表达程度与疾病预后相关,通过NLRP3炎性体途径诱导活性IL-1β的产生,抑制NLRP3炎性体途径被认为是降低肿瘤细胞侵袭的有效方法。NLRP3炎性体相关基因多态性还与慢性粒细胞白血病(CML)有关,与对照相比,CML病人中IL-1β或NLRP3 mRNA表达降低并且IL-18 mRNA表达显着增加,NLRP3炎性体的遗传多态性可作为CML的潜在预测因子[15]。本研究发现SHPT病人的甲状旁腺组织中NLRP3蛋白的表达明显强于正常甲状旁腺组织,且血清中NLRP3的水平也较正常人明显升高,这提示SHPT病人体内可能存在NLRP3炎性体的激活,这可能与甲状旁腺细胞在长期低钙、高磷刺激下引起NLRP3炎性体激活有关,NLRP3炎性体激活后导致IL-1β和IL-18水平升高,引起慢性炎症的发生,而甲状旁腺组织在长期慢性炎症的刺激下出现了甲状旁腺组织的弥漫性增生或腺瘤样增生异常增生。
综上所述,NLRP3在SHPT病人异常增生的甲状旁腺组织中表达水平明显高于正常甲状旁腺组织,且NLRP3的表达与病人性别、年龄、透析方式、透析龄等均无关,NLRP3可能参与SHPT的发生、发展,NLRP3可作为SHPT早期诊断及预后评估的重要指标。
NLRP3在继发性甲状旁腺功能亢进症中的表达及临床意义
Expression of NLRP3 in secondary hyperparathyroidism and its clinical significance
-
摘要:
目的探讨NOD样受体家族蛋白3(NLRP3)炎性小体在慢性肾脏病继发性甲状旁腺功能亢进症(SHPT)中的表达及临床意义。 方法应用HE染色观察SHPT病人异常增生的甲状旁腺镜下形态;采用ELISA法检测正常人和SHPT病人血清中NLRP3水平;免疫组织化学SP法检测NLRP3在正常和异常增生的甲状旁腺组织中的表达,并分析NLRP3的表达与SHPT临床病理特征的关系。 结果SHPT病人异常增生的甲状旁腺镜下可表现为弥漫性及腺瘤样增生,与正常甲状旁腺表现明显不同;NLRP3在SHPT病人血清中的水平明显高于正常人(P < 0.01);NLRP3在SHPT病人异常增生的甲状旁腺组织中的阳性率明显高于正常甲状旁腺组织(P < 0.01)。不同性别、年龄、透析方式、透析龄等SHPT病人甲状旁腺组织中NLRP3蛋白表达差异均无统计学意义(P>0.05)。 结论NLRP3可能参与慢性肾脏病病人SHPT的发生、发展,其高表达有望成为SHPT早期诊断及预后评估的重要指标。 -
关键词:
- 继发性甲状旁腺功能亢进症 /
- 慢性肾脏病 /
- NOD样受体家族蛋白3
Abstract:ObjectiveTo investigate the expression and clinical significance of NOD-like receptor family pyrin domain containing 3(NLRP3) in secondary hyperparathyroidism(SHPT). MethodsHE staining was used to observe the difference of parathyroid gland in normal people and SHPT patients.ELISA was used to detect the serum level of NLRP3 in normal people and SHPT patients.Immunohistochemistry of SP method was used to detect the expression of NLRP3 in normal and hyperplastic parathyroid tissue, and the relationship between NLRP3 expression and SHPT clinical-pathological characteristics was analyzed. ResultsHyperplastic parathyroid glands in SHPT patients manifested as diffuse and adenoma-like hyperplasia, which was obviously different from that of normal, and the serum level of NLRP3 in SHPT patients was significantly higher than that of normal people(P < 0.01).The positive rate of NLRP3 in abnormal hyperplastic parathyroid tissue in SHPT patients was significantly higher than that in normal parathyroid tissue(P < 0.01).The expression of NLRP3 in SHPT patients had no correlation with gender, age, dialysis method or dialysis age(P>0.05). ConclusionsNLRP3 may be involved in the occurrence and development of SHPT, and its high expression is expected to become an important indicator for the early diagnosis and prognostic evaluation of SHPT. -
表 1 NLRP3在正常甲状旁腺组织及SHPT病人的甲状旁腺组织中的表达
分组 n NLRP3 Z P - + 2+ 3+ 增生的甲状旁腺组织 88 4 10 39 35 正常的甲状旁腺组织 10 8 2 0 0 5.06 < 0.01 合计 98 12 12 39 35 表 2 不同临床参数SHPT病人甲状旁腺组织中NLRP3蛋白表达
临床病理参数 n NLRP3 Z P - + 2+ 3+ 性别 男 54 2 7 22 23 0.46 >0.05 女 34 2 3 17 12 年龄/岁 < 50 42 1 6 16 19 0.76 >0.05 ≥50 46 3 4 23 16 透析方式 血液透析 75 4 8 34 29 腹膜透析 4 0 1 2 1 1.30* >0.05 血液透析联合腹膜透析 9 0 1 3 5 透析龄/年 ≤5 21 2 4 9 6 >5~ < 10 36 0 3 18 15 2.91 >0.05 ≥10 31 2 3 12 14 *示χ2值 -
[1] ISAKOVA T, NICKOLAS T L, DENBURG M, et al. KDOQI US Commentary on the 2017 KDIGO clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder(CKD-MBD)[J]. Am J Kidney Dis, 2017, 70(6): 737. doi: 10.1053/j.ajkd.2017.07.019 [2] MALINDRETOS P, SARAFIDIS P, LAZARIDIS A, et al. A study of the association of higher parathormone levels with health-related quality of life in hemodialysis patients[J]. Clin Nephrol, 2012, 77(3): 196. doi: 10.5414/CN107030 [3] JO EK, KIM JK, SHIN DM, et al. Molecular mechanisms regulating NLRP3 inflammasome activation[J]. Cell Mol Immunol, 2016, 13(2): 148. doi: 10.1038/cmi.2015.95 [4] SLATOPOLSKY E, DUSSO A, BROWN AJ. The role of phosphorus in the development of secondary hyperparathyroidism and parathyroid cell proliferation in chronic renal failure[J]. Am J Med Sci, 1999, 317(6): 370. doi: 10.1097/00000441-199906000-00004 [5] DUAN K, GOMEZ HERNANDEZ K, METE O. Clinicopathological correlates of hyperparathyroidism[J]. J Clin Pathol, 2015, 68(10): 771. doi: 10.1136/jclinpath-2015-203186 [6] KANDA Y, OSAKI M, OKADA F. Chemopreventive strategies for inflammation-related carcinogenesis: current status and future direction[J]. Int J Mol Sci, 2017, 18(4): 867. doi: 10.3390/ijms18040867 [7] 丁丽红, 吕林莉, 王德光, 等. 白蛋白导致肾小管上皮细胞NLRP3炎性体激活的机制分析[J]. 临床与实验病理学杂志, 2017, 33(12): 1341. [8] DING LH, LIU D, XU M, et al. Enalapril inhibits tubulointerstitial inflammation and NLRP3 inflammasome expression in BSA-overload nephropathy of rats[J]. Acta Pharmacol Sin, 2014, 35(10): 1293. doi: 10.1038/aps.2014.66 [9] 丁丽红, 刘丹, 徐敏, 等. 蛋白负荷大鼠肾脏热蛋白结构域相关蛋白3炎性体的表达[J]. 中华肾脏病杂志, 2014, 30(9): 689. doi: 10.3760/cma.j.issn.1001-7097.2014.09.009 [10] MOOSSAVI M, PARSAMANESH N, BAHRAMI A, et al. Role of the NLRP3 inflammasome in cancer[J]. Mol Cancer, 2018, 17(1): 158. doi: 10.1186/s12943-018-0900-3 [11] BAGHERI V, MEMAR B, MOMTAZI AA, et al. Cytokine networks and their association with Helicobacter pylori infection in gastric carcinoma[J]. J Cell Physiol, 2018, 233(4): 2791. doi: 10.1002/jcp.25822 [12] PEI HP, TAN FB, LIU Li, et al. IL-1β/NF-κb signaling promotes colorectal cancer cell growth through miR-181a/PTEN axis[J]. Arch Biochem Biophys, 2016, 604: 20. doi: 10.1016/j.abb.2016.06.001 [13] LI S, LIANG X, MA L, et al. MiR-22 sustains NLRP3 expression and attenuates H. pylori-induced gastric carcinogenesis[J]. Oncogene, 2018, 37(7): 884. doi: 10.1038/onc.2017.381 [14] HUANG CF, CHEN L, LI YC, et al. NLRP3 inflammasome activation promotes inflammation-induced carcinogenesis in head and neck squamous cell carcinoma[J]. J Exp Clin Cancer Res, 2017, 36(1): 116. doi: 10.1186/s13046-017-0589-y [15] ZHANG A, YU J, YAN S, et al. The genetic polymorphism and expression profiles of NLRP3 inflammasome in patients with chronic myeloid leukemia[J]. Hum Immunol, 2018, 79(1): 57. doi: 10.1016/j.humimm.2017.10.013 -




 下载:
下载: