-
食管癌是临床常见的消化道肿瘤,发病率、死亡率高,且预后较差,因此, 早期诊断及治疗至关重要。在中国,超过90%的食管癌为鳞状细胞癌。对于早期食管癌, 手术是最主要的治疗方式, 根治术有利于完整地切除肿瘤, 但是术后创伤大这一问题无法避免。随着医疗技术的发展, 内镜治疗开始成为早期食管癌的治疗首选。内镜治疗在早期食管癌的适应证不断扩大,但无法进行淋巴结清扫,因此限制了在早期食管癌尤其是T1b期(肿瘤侵及黏膜下层)的应用。T1b期食管鳞癌病人淋巴结转移率接近20%[1], 对于该类病人的治疗方式选择目前尚有争议, 仍依赖于今后淋巴结转移的相关因素研究。已有研究证实,若临床排除淋巴结转移,内镜治疗T1b期食管鳞癌效果令人满意[2]。因此,本研究回顾性分析了行食管癌根治术的140例食管鳞癌病人的临床资料,旨在研究T1b期食管鳞癌的淋巴结转移高危因素及影响预后的独立因素,为临床内镜诊疗提供方案选择。现作报道。
-
纳入我院2010-2020年收治的行食管癌根治术病人140例,其中淋巴结阳性组20例,淋巴结阴性组120例。纳入标准: (1)术后病理类型为鳞癌;(2)术后病理证实肿瘤侵及黏膜下层;(3)病人术前未接受其他治疗;(4)全身检查无远处转移。排除标准: (1)术后病理为腺癌; (2)术前接受放化疗或术后追加放化疗;(3)同时存在其他影响病人预后的疾病,如重度肝肾功能不全。
-
收集并比较病人的临床资料包括性别、年龄、吸烟饮酒史、合并症、肿瘤位置、肿瘤最大径、组织分化程度、淋巴结转移等。肿瘤位置包括胸上段(肿瘤上缘距门齿20~25 cm)、胸中段(肿瘤上缘距门齿25~30 cm)、胸下段(肿瘤上缘距门齿30~40 cm)。通过对病人进行电话随访及调取病历获得病人后续治疗情况及生存时间。研究终点是总体生存时间,单位以月计,以末次随访时间或病人死亡时间为准,随访时间截至2021年7月。
-
采用χ2检验、logistic多因素回归分析、生存分析(Kaplan-Meier法)和Cox回归分析。
-
纳入的140例病人中,淋巴结阳性组20例(14.3%),年龄48~75岁,平均(63.05±8.029)岁;淋巴结阴性组120例(85.7%),年龄44~80岁,平均(63.77±8.212)岁。单因素分析显示,2组病人性别、吸烟史、饮酒史和肿瘤位置比较差异均无统计学意义(P>0.05),2组病人的年龄、肿瘤直径、肿瘤分化程度差异均有统计学意义(P < 0.05)(见表 1)。将病人的年龄、肿瘤直径和肿瘤分化程度纳入多因素logistic回归分析,结果显示,年龄、肿瘤直径和肿瘤分化程度与食管鳞癌淋巴结转移的相关性均有统计学意义(P < 0.05~P < 0.01), 其中年龄≥55岁, 中低分化、肿瘤直径≥5 cm者更易出现淋巴结转移(见表 2)。
临床
病理特征淋巴结阳性组
(n=20)淋巴结阴性组
(n=120)χ2 P 性别 男 16(80.00) 84(70.00) 0.84 >0.05 女 4(20.00) 36(30.00) 年龄/岁 ≥55 11(55.00) 99(82.50) 6.15 < 0.05 < 55 9(45.00) 21(17.50) 吸烟史 是 11(55.00) 56(46.67) 0.47 >0.05 否 9(45.00) 64(53.33) 饮酒史 是 9(45.00) 49(40.83) 0.12 >0.05 否 11(55.00) 71(59.17) 肿瘤直径/cm < 3 5(25.00) 16(13.33) 3~ < 5 13(65.00) 59(49.17) 6.25 < 0.05 ≥5 2(10.00) 45(37.50) 肿瘤位置 胸上段 1(80.00) 9(80.00) 胸中段 17(80.00) 81(80.00) 2.31 >0.05 胸下段 2(80.00) 30(80.00) 肿瘤分化程度 高分化 6(30.00) 11(9.17) 中分化 10(50.00) 90(75.00) 7.05 < 0.05 低分化 4(20.00) 19(15.83) 表 1 淋巴结阳性组与阴性组临床病理特征的比较[n;百分率(%)]
因素 B Waldχ2 P OR(95%CI) 年龄(≥55 VS < 55) -1.895 11.90 < 0.01 0.150(0.051~0.441) 肿瘤直径/cm < 3 — 7.21 < 0.05 1 3~ < 5 0.649 1.12 >0.05 1.914(0.573~6.393) ≥5 2.474 7.11 < 0.01 11.868(1.926~73.144) 肿瘤分化程度 高分化 — 10.66 < 0.01 1 中分化 2.085 10.55 < 0.01 8.047(2.286~28.325) 低分化 1.627 4.53 < 0.05 5.090(1.137~22.794) 表 2 2组淋巴结转移的多因素logistic分析
-
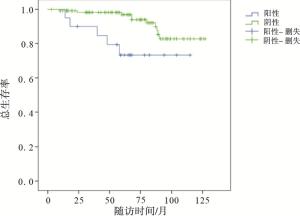
本次研究共纳入140例, 随访时间58(3~127)个月, 失访9例, 死亡15例, 其中淋巴结阳性组死亡5例, 淋巴结阴性组死亡10例。淋巴结阳性组3年生存率为84.7%, 5年生存率为73.3%。淋巴结阴性组3年生存率为98.2%。5年生存率为96.9%。淋巴结阳性组的生存率明显低于淋巴结阴性组(χ2=9.85, P < 0.01)(见图 1)。不同性别、不同分化程度、肿瘤不同位置及是否淋巴结转移的5年生存率差异均有统计学意义(P < 0.05~P < 0.01)(见表 3)。COX多因素分析显示, 淋巴结转移及性别是影响T1b期食管鳞癌预后的独立危险因素(P < 0.05和P < 0.01)(见表 4)。
临床病理特征 n 5年生存情况 χ2 P 性别 男 100 93(96.28) 9.54 < 0.01 女 40 32(86.43) 年龄/岁 ≥55 110 102(93.40) 0.16 >0.05 < 55 30 28(84.62) 吸烟史 是 67 61(92.07) 1.38 >0.05 否 73 84(92.17) 饮酒史 是 58 48(93.60) 2.54 >0.05 否 82 77(95.73) 肿瘤直径/cm < 3 21 19(89.05) 3~ < 5 72 65(92.85) 1.42 >0.05 ≥5 47 41(96.20) 肿瘤位置 胸上段 10 8(63.46) 胸中段 98 90(95.31) 6.72 < 0.05 胸下段 32 27(90.45) 肿瘤分化程度 低分化 23 21(92.31) 中分化 100 93(95.13) 10.44 < 0.01 高分化 17 11(83.31) 淋巴结 阳性 20 15(73.30) 9.85 < 0.01 阴性 120 110(96.89) 表 3 临床病理特征与5年生存率的相关分析[n;百分率(%)]
因素 B Waldχ2 P OR(95%CI) 性别 1.085 6.20 < 0.05 2.960(1.260~6.956) 淋巴结转移 -1.640 0.53 < 0.01 0.194(0.069~0.544) 分化程度 高分化 — 3.33 >0.05 1 中分化 -0.860 2.99 >0.05 0.423(0.160~1.123) 低分化 -0.847 1.81 >0.05 0.429(0.125~1.473) 病变位置 胸上段 — 4.42 >0.05 1 胸中段 -1.051 2.61 >0.05 0.349(0.098~1.251) 胸下段 -0.218 0.12 >0.05 0.804(0.229~2.819) 表 4 T1b期食管鳞癌生存期COX风险比较回归模型
-
食管癌是全球发病率较高的癌症, 全球半数食管癌发生在中国[3],其五年生存率约为19%[4]。早期食管癌首选治疗为外科手术治疗,但外科并发症较多且影响生存质量[5],近年来内镜治疗因疗效好, 并发症少, 成为早期食管癌的首选。食管癌主要通过淋巴结转移,但内镜无法评估有无淋巴结转移,对于有淋巴结转移者内镜治疗后常常仍需追加治疗,因此,对于这部分病人临床治疗方式的选择意见尚不统一。近年来,针对T1b期食管鳞癌是否属于内镜治疗范围已经开始进行探讨。据报道[2],无淋巴结转移的T1b期食管癌内镜治疗与外科治疗效果相当,这与我国早期食管鳞癌及癌前病变诊治共识[6]意见一致。因此探究T1b期食管鳞癌淋巴结转移的危险因素及预后, 对于指导临床治疗方式的选择有重要意义,有高危因素病人应行外科手术根治,无高危因素者可行内镜下治疗。
本研究中T1b期食管鳞癌病人淋巴结转移率为14.3%,与相关研究[7]相符。国外有研究[8]表明肿瘤侵犯较深、分化程度较低、脉管侵犯者更易发生淋巴结转移。近期国内也有研究[9]发现, 肿瘤直径较大、低分化和脉管浸润者更易发生淋巴结转移。本研究结果示, 年龄、肿瘤直径及分化程度与淋巴结转移密切相关。另外, 多因素分析示中低分化程度、肿瘤直径≥5 cm者及年龄≥55岁更容易发生淋巴结转移。这与多数学者的研究结果一致,国内外普遍认为低分化较高分化鳞癌更易发生淋巴结转移,这可能因为低分化肿瘤普遍侵袭性较强有关[10]。目前国内外对于肿瘤直径的结论尚不统一。肿瘤直径与淋巴结转移率的关系均有报道, 在一项包含715例食管癌病人的报道[11]中,研究者发现肿瘤直径与淋巴结转移率呈正相关。但同时也有研究[12-13]认为肿瘤直径与淋巴结转移无关,可能随着肿瘤直径的增加脉管浸润等因素影响更为显著。因此,肿瘤直径是否为淋巴结转移的危险因素仍需进一步研究。
分析病人的预后发现,T1b期食管鳞癌病人淋巴结阳性组3年和5年生存率分别为84.7%、73.3%, 阴性组3年、5年生存率分别为98.2%、96.9%, 淋巴结阳性组的生存率明显低于淋巴结阴性组。由于食管解剖结构特殊,不同深度的组织有着不完全相同的淋巴引流系统, 早期容易发生淋巴结转移[14]。食管癌一旦突破黏膜下层即可通过纵向淋巴管及横向直接引流至胸导管发生广泛转移,因此T1b期食管鳞癌淋巴结转移者生存率明显低于未转移者。既往研究[15]发现,早期食管癌的3年、5年的生存率为86%、82%,与本次研究结果基本一致。不同性别、不同分化程度、肿瘤不同位置及是否淋巴结转移均在不同程度上影响病人预后, 其中淋巴结转移及女性是影响T1b期食管鳞癌预后的独立危险因素。淋巴结转移影响早期食管癌预后这一点,已得到多数研究支持[16-17]。但对于女性为影响预后危险因素与既往研究[18-19]相悖,可能与本研究中性别占比不平衡有关。
综上所述,年龄≥55岁、中低分化及肿瘤直径≥5 cm是T1b期食管鳞癌病人淋巴结转移的高风险独立因素。淋巴结转移及女性是影响T1b期食管鳞癌病人预后的独立危险因素。因此,临床上高龄、中低分化、肿瘤直径较大的早期食管癌病人应更倾向于选择外科根治术加淋巴结清扫术,因为有上述临床特征的病人更易发生淋巴结转移。淋巴结转移者及女性较未有淋巴结转移者、男性生存时间短。本研究中因淋巴结阳性组占比较少,结果具有局限性,但仍具有一定的临床参考价值。
T1b期食管鳞癌淋巴结转移及预后危险因素分析
Analysis of the lymph node metastasis and prognostic risk factors of stage T1b esophageal squamous cell carcinoma
-
摘要:
目的探究T1b期食管鳞癌病人淋巴结转移危险因素及预后独立危险因素。 方法回顾性分析采用根治性手术加淋巴结清扫的T1b食管癌的140例食管鳞癌病人的临床资料,根据术后病理结果将病人分为淋巴结阳性组和淋巴结阴性组, 分析淋巴结转移及影响预后因素。 结果140例病人中淋巴结阳性组20例,淋巴结阴性组120例,淋巴结转移率为14.3%, 单因素分析显示2组年龄、肿瘤分化程度和肿瘤直径差异均有统计学意义(P < 0.05)。多因素分析示,年龄≥55岁、中低分化和肿瘤直径≥5 cm是淋巴结转移独立危险因素(P < 0.05~P < 0.01)。随访时间58(3~127)个月, 失访9例, 死亡15例,存活率为98.2%。T1b期淋巴结阳性组食管鳞癌病人3年及5年生存率分别为84.7%、73.3%,阴性组分别为98.2%、96.9%。淋巴结阳性组的生存率明显低于淋巴结阴性组(P < 0.01)。COX多因素分析显示, 淋巴结转移及女性是影响T1b期食管鳞癌病人预后的独立危险因素(P < 0.05和P < 0.01)。 结论年龄≥55岁、中低分化、肿瘤直径≥5 cm是1b期食管鳞癌病人淋巴结转移的高风险独立因素。淋巴结转移及女性是影响T1b期食管鳞癌病人预后的独立危险因素。 Abstract:ObjectiveTo explore the risk factors and prognostic independent risk factors of lymph node metastasis in stage T1b esophageal squamous cell carcinoma patients. MethodsThe clinical data of 140 stage T1b esophageal squamous cell carcinoma patients treated with radical surgery combined with lymph node dissection were retrospectively analyzed.The patients were divided into the lymph node positive group and lymph node negative group according to the postoperative pathological results, and the lymph node metastasis and prognostic factors in two groups were analyzed. ResultsAmong 140 patients, there were 20 cases in the lymph node positive group and 120 cases in the lymph node negative group, and the lymph node metastasis rate was 14.3%.The results of univariate analysis showed that the differences of the age, tumor differentiation and tumor diameter between two groups were statistically significant(P < 0.05).The results of multivariate analysis showed that the age ≥55 years, medium and low differentiation and tumor diameter ≥5 cm were the independent risk factors of lymph node metastasis(P < 0.05 to P < 0.01).During 58(3-127) months of following-up, 9 cases were lost to follow-up and 15 cases died, and the survival rate was 98.2%.The 3-year and 5-year survival rates in the stage T1b lymph node positive group and negative group were 84.7% & 73.3% and 98.2% & 96.9%, respectively.The survival rate in lymph node positive group was significantly lower than that in lymph node negative group(P < 0.01).The results of COX multivariate analysis showed that the lymph node metastasis and female were the independent risk factors of prognosis of stage T1b esophageal squamous cell carcinoma patients(P < 0.05 and P < 0.01). ConclusionsThe age≥55 years, moderate and low differentiation and tumor diameter ≥5 cm are the high-risk independent factors of lymph node metastasis in patients with stage T1b esophageal squamous cell carcinoma.Lymph node metastasis and female are the independent risk factors of prognosis of patients with stage T1b esophageal squamous cell carcinoma. -
Key words:
- esophageal neoplasms /
- stage T1b /
- lymph node metastasis
-
表 1 淋巴结阳性组与阴性组临床病理特征的比较[n;百分率(%)]
临床
病理特征淋巴结阳性组
(n=20)淋巴结阴性组
(n=120)χ2 P 性别 男 16(80.00) 84(70.00) 0.84 >0.05 女 4(20.00) 36(30.00) 年龄/岁 ≥55 11(55.00) 99(82.50) 6.15 < 0.05 < 55 9(45.00) 21(17.50) 吸烟史 是 11(55.00) 56(46.67) 0.47 >0.05 否 9(45.00) 64(53.33) 饮酒史 是 9(45.00) 49(40.83) 0.12 >0.05 否 11(55.00) 71(59.17) 肿瘤直径/cm < 3 5(25.00) 16(13.33) 3~ < 5 13(65.00) 59(49.17) 6.25 < 0.05 ≥5 2(10.00) 45(37.50) 肿瘤位置 胸上段 1(80.00) 9(80.00) 胸中段 17(80.00) 81(80.00) 2.31 >0.05 胸下段 2(80.00) 30(80.00) 肿瘤分化程度 高分化 6(30.00) 11(9.17) 中分化 10(50.00) 90(75.00) 7.05 < 0.05 低分化 4(20.00) 19(15.83) 表 2 2组淋巴结转移的多因素logistic分析
因素 B Waldχ2 P OR(95%CI) 年龄(≥55 VS < 55) -1.895 11.90 < 0.01 0.150(0.051~0.441) 肿瘤直径/cm < 3 — 7.21 < 0.05 1 3~ < 5 0.649 1.12 >0.05 1.914(0.573~6.393) ≥5 2.474 7.11 < 0.01 11.868(1.926~73.144) 肿瘤分化程度 高分化 — 10.66 < 0.01 1 中分化 2.085 10.55 < 0.01 8.047(2.286~28.325) 低分化 1.627 4.53 < 0.05 5.090(1.137~22.794) 表 3 临床病理特征与5年生存率的相关分析[n;百分率(%)]
临床病理特征 n 5年生存情况 χ2 P 性别 男 100 93(96.28) 9.54 < 0.01 女 40 32(86.43) 年龄/岁 ≥55 110 102(93.40) 0.16 >0.05 < 55 30 28(84.62) 吸烟史 是 67 61(92.07) 1.38 >0.05 否 73 84(92.17) 饮酒史 是 58 48(93.60) 2.54 >0.05 否 82 77(95.73) 肿瘤直径/cm < 3 21 19(89.05) 3~ < 5 72 65(92.85) 1.42 >0.05 ≥5 47 41(96.20) 肿瘤位置 胸上段 10 8(63.46) 胸中段 98 90(95.31) 6.72 < 0.05 胸下段 32 27(90.45) 肿瘤分化程度 低分化 23 21(92.31) 中分化 100 93(95.13) 10.44 < 0.01 高分化 17 11(83.31) 淋巴结 阳性 20 15(73.30) 9.85 < 0.01 阴性 120 110(96.89) 表 4 T1b期食管鳞癌生存期COX风险比较回归模型
因素 B Waldχ2 P OR(95%CI) 性别 1.085 6.20 < 0.05 2.960(1.260~6.956) 淋巴结转移 -1.640 0.53 < 0.01 0.194(0.069~0.544) 分化程度 高分化 — 3.33 >0.05 1 中分化 -0.860 2.99 >0.05 0.423(0.160~1.123) 低分化 -0.847 1.81 >0.05 0.429(0.125~1.473) 病变位置 胸上段 — 4.42 >0.05 1 胸中段 -1.051 2.61 >0.05 0.349(0.098~1.251) 胸下段 -0.218 0.12 >0.05 0.804(0.229~2.819) -
[1] GAMBOA AM, KIM S, FORCE SD, et al. Treatment allocation in patients with early-stage esophageal adenocarcinoma: Prevalence and predictors of lymph node involvement[J]. Cancer, 2016, 122(14): 2150. doi: 10.1002/cncr.30040 [2] WANG J, ZHU XN, ZHU LL, et al. Efficacy and safety of endoscopic submucosal tunnel dissection for superficial esophageal squamous cell carcinoma and precancerous lesions[J]. World J Gastroenterol, 2018, 24(26): 2878. doi: 10.3748/wjg.v24.i26.2878 [3] BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL RL, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394. doi: 10.3322/caac.21492 [4] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7. doi: 10.3322/caac.21551 [5] ZHANG Y, DING H, CHEN T, et al. Outcomes of endoscopic submucosal dissection vs esophagectomy for T1 esophageal squamous cell carcinoma in a real-world cohort[J]. Clin Gastroenterol Hepatol, 2019, 17(1): 73. doi: 10.1016/j.cgh.2018.04.038 [6] 李鹏, 王拥军, 陈光勇, 等. 中国早期食管鳞状细胞癌及癌前病变筛查与诊治共识(2015年, 北京)[J]. 中华消化内镜杂志, 2016, 33(1): 3. [7] MÖNIG S, CHEVALLAY M, NICLAUSS N, et al. Early esophageal cancer: the significance of surgery, endoscopy, and chemoradiation[J]. Ann N Y Acad Sci, 2018, 1434(1): 115. doi: 10.1111/nyas.13955 [8] SHEN W, SHEN Y, TAN L, et al. A nomogram for predicting lymph node metastasis in surgically resected T1 esophageal squamous cell carcinoma[J]. J Thorac Dis, 2018, 10(7): 4178. doi: 10.21037/jtd.2018.06.51 [9] 吴江涛. 表浅型食管癌淋巴结转移相关危险因素分析及其临床意义[J]. 蚌埠医学院学报, 2021, 46(4): 525. [10] 邵明雯, 蒋雯, 陈亮, 等. 食管癌淋巴结转移特点分析[J]. 现代肿瘤医学, 2019, 27(22): 4005. doi: 10.3969/j.issn.1672-4992.2019.22.016 [11] MANNER H, PECH O, HELDMANN Y, et al. The frequency of lymph node metastasis in early-stage adenocarcinoma of the esophagus with incipient submucosal invasion(pT1b sm1) depending on histological risk patterns[J]. Surg Endosc, 2015, 29(7): 1888. doi: 10.1007/s00464-014-3881-3 [12] 李浩淼, 李印, 刘先本, 等. 313例胸段食管鳞癌患者的淋巴结转移特点[J]. 中华肿瘤杂志, 2015, 37(11): 841. [13] LEE JM, YANG SY, YANG PW, et al. Polymorphism in epidermal growth factor receptor intron 1 predicts prognosis of patients with esophageal cancer after chemoradiation and surgery[J]. Ann Surg Oncol, 2011, 18(7): 2066. doi: 10.1245/s10434-011-1559-9 [14] WANG Y, ZHU L, XIA W, et al. Anatomy of lymphatic drainage of the esophagus and lymph node metastasis of thoracic esophageal cancer[J]. Cancer Manag Res, 2018, 10: 6295. doi: 10.2147/CMAR.S182436 [15] 李苗, 曾晓清, 谭黎杰, 等. 浅表食管癌术后患者的生存及预后分析[J]. 中华医学杂志, 2016, 96(6): 460. [16] 李林, 柳硕岩, 朱坤寿, 等. 早期食管癌淋巴结转移规律与预后分析[J]. 中华肿瘤杂志, 2009, 31(3): 226. [17] 朱多杰, 王成, 魏小平, 等. 病理T1b期食管鳞状细胞癌外科治疗的结果分析[J]. 中国胸心血管外科临床杂志, 2021, 28(6): 696. [18] 王沐廷, 郑滢丽, 林晓璇, 等. 女性食管癌的临床病理特点及生存分析[J]. 泰山医学院学报, 2016, 37(4): 372. [19] 张梅燕, 林小龙, 刘英霞. 食管癌女性患者的病理特点与预后研究[J]. 深圳中西医结合杂志, 2021, 31(15): 37. -




 下载:
下载:


