-
垂体腺瘤起源于垂体前叶激素分泌细胞,是常见的颅内肿瘤。过去10~15年的流行病学研究[1-3]结果显示,垂体腺瘤的发病率有增多的趋势。垂体腺瘤多为偶发瘤,病理组织学形态表现为良性,但部分垂体腺瘤仍有瘤体增大、侵袭生长的表现,并且手术切除存在全切率低、术后并发症多、肿瘤易复发等问题。此外,垂体腺瘤的发病机制尚不清楚,这进一步限制了探索垂体腺瘤临床治疗的研究步伐。
目前,关于垂体腺瘤发生机制存在多种假设和争论,但肿瘤相关细胞信号转导通路和肿瘤基因表观遗传学的异常是不争的事实。人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)是肿瘤中最常失活的抑癌基因之一[4-6]。研究[7-8]显示,PTEN参与调控垂体腺瘤的增殖和侵袭,而且这种调控作用很可能是通过下游的PI3K/AKT信号通路实现的。MicroRNA(miRNA)通过结合靶mRNA调控基因表达,参与调控细胞增殖、分化和/或凋亡的过程。
前人的研究提示了miR-20a在垂体腺瘤中的表达以及与PTEN的关系,但鲜有研究证明二者的确切调控关系以及影响肿瘤发生与发展的分子机制。本文通过细胞试验,深入探讨了miR-20a对PTEN以及下游信号通路和垂体腺瘤发生与发展的影响,我们的结果证明了miR-20a在调节细胞的增殖和侵袭的过程中扮演重要作用,它可能通过靶向PTEN,影响PI3K/AKT信号通路,调控垂体腺瘤细胞的增殖和侵袭,从而参与到垂体腺瘤的疾病进程中。现作报道。
-
大鼠垂体腺瘤细胞GH3购于赛百慷(上海)生物技术股份有限公司。人垂体腺瘤细胞系HP75由美国ATCC提供。细胞培养基购于Gibco公司。RNA提取试剂Trizol购于Invitrogen(上海)。反转录和荧光定量PCR试剂盒购于Takara(中国)。Gimma(中国)设计并合成了用于转染的寡核苷酸和PCR引物。PTEN、AKT、PI3K、E-caherin、MMP2、MMP9抗体购于Abcam公司。
-
大鼠垂体腺瘤细胞GH3、人垂体腺瘤细胞系HP75接种于含有12.5%马血清和2.5%胎牛血清的DMEM培养基中进行培养。进行转染时,6孔板每孔接种2×105个细胞,并在转染前将培养基换成无血清Opti-MEMI培养基。使用lipofectamine 2000进行转染。转染后将细胞置于37 ℃和5% CO2培养箱培养4~6 h后,无血清Opti-MEMI培养基换成正常培养基。48 h后收集细胞用于检测。
-
使用TRIzolⓇ试剂(Invitrogen, 15596026),按照说明书提取细胞样本的总RNA。以1 μg总RNA为模板,采用PrimeScriptTM RT Reagent kit试剂盒(Takara,RR037A),按说明书要求操作,反转录合成cDNA。选用SYBR Premix Ex Taq Master mix(Takara,RR390W)试剂,利用Applied Biosystems 7500 Real-Time PCR系统(Thermo), 以U6核小RNA为内参,实时定量PCR检测miR20a的表达。U6上游引物为:5′-CTC GCT TCG GCA GCA CA-3′;下游引物为:5′-AAC GCT TCA CGA ATT TGC GT-3′。
-
PCR扩增了PTEN mRNA的3′-UTR区,并将其克隆到PSICHECK-2载体(Promega)的XhoI/NotI位点,构建luc-PTEN-WT及luc-PTEN-MUT质粒。将HEK-293T细胞接种于24孔板中,用Lipofectamine 2000转染luc-PTEN-WT或luc-PTEN-MUT质粒分别与miR-20a mimic或miR-20a control共转染,形成4个共转染组:PTEN-WT+miR-20a control组(类似物对照组)、PTEN-WT+miR-20a mimic组(类似物组)、PTEN-MUT+miR-20a control组(抑制物对照组)、PTEN-MUT+miR-20a mimic组(抑制物组)。细胞转染48 h后按Dual-Luciferase Reporter Assay System-Promega说明书进行荧光素酶活性检测。按Luciferase的表达水平相对于Renilla luciferase的表达水平比值作为PGL-3M报告基因的相对表达水平。每种细胞的质粒导入效率用PRL-CMV的活性进行校正。每组实验各重复3次。
-
采用RIPA缓冲液(Sigma, V900854)裂解,提取总蛋白。采用BCA蛋白浓度测定试剂盒(Sigma, FP0010),进行蛋白浓度测定。等量蛋白(20 μg)用10% SDS-PAGE凝胶电泳后,电转至PVDF膜(EMD Millipore, IPVH00010)。用含5% BSA的TBST缓冲液室温封闭1 h。TBST清洗3次后,加入相应一抗,4 ℃轻摇孵育过夜。TBST清洗3次后,加入相应的辣根过氧化物酶标记二抗,室温孵育1 h。加入ECL超敏发光液(Thermo, 32132)显色。使用Image J(NIH)软件进行定量分析。
-
将细胞以1×103个细胞/每孔铺于96孔板中。采用CCK8检测试剂盒(Solarbio,CA1210),按说明书操作,分别在0、1、2、3、4 d进行检测。
-
选择膜孔径为8.0 μm的transwell小室(Corning, 3422),上室加入用无血清培养基1∶ 5稀释的Mitrigel基质胶(BD, 356234),置于37 ℃。4 h后,取出transwell小室,吸取多余液体,并用无血清培养基清洗。用胰酶消化HTR-8/Svneo细胞后,用无血清培养基制备2×105 HTR-8/Svneo细胞悬液,接种至Transwell小室上室。Transwell小室下室,加入完全培养基。24 h后,取出transwell小室,用棉签小心擦拭掉上室底部的Mitrigel基质胶以及附着其上的细胞。PBS清洗3次后,将transwell小室置于4%多聚甲醛中固定30 min。0.1%结晶紫染色15 min后,将transwell小室置于显微镜下,选取5个视野拍照并计数。
-
采用t检验、方差分析和q检验。
-
CCK8细胞增殖检测试验结果显示,大鼠和人垂体瘤细胞系各组OD值,Day0时差异均无统计学意义(P>0.05),Day1、Day2、Day3和Day4时,与类似物对照组相比,miR-20a类似物组OD值均增高,与抑制物对照组相比,miR-20a抑制物组的OD值均降低,差异均有统计学意义(P < 0.01)(见表 1、2)。
分组 n Day0 Day1 Day2 Day3 Day4 抑制物对照组 3 0.204±0.013 0.241±0.011 0.356±0.049 0.579±0.051 0.763±0.076 抑制物组 3 0.196±0.014 0.226±0.009** 0.293±0.011** 0.393±0.011** 0.548±0.006** 类似物对照组 3 0.207±0.009 0.241±0.010 0.380±0.017 0.611±0.021 0.809±0.019 类似物组 3 0.210±0.016 0.394±0.021△△ 0.676±0.017△△ 1.008±0.047△△ 1.375±0.063△△ F — 0.65 98.18 112.00 148.38 147.91 P — >0.05 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.000 0.019 0.087 0.201 0.374 q检验: 与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 1 miR-20a对大鼠垂体瘤细胞系增殖的影响(x±s)
分组 n Day0 Day1 Day2 Day3 Day4 抑制物对照组 3 0.214±0.013 0.31±0.012 0.449±0.055 0.666±0.059 0.901±0.09 抑制物组 3 0.205±0.015 0.244±0.010** 0.328±0.012** 0.453±0.012** 0.647±0.007** 类似物对照组 3 0.217±0.010 0.311±0.010 0.475±0.020 0.703±0.024 0.954±0.022 类似物组 3 0.220±0.016 0.425±0.023△△ 0.757±0.019△△ 1.159±0.054△△ 1.623±0.074△△ F — 0.68 76.48 101.55 148.83 149.05 P — >0.05 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.000 0.017 0.099 0.265 0.521 q检验: 与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 2 miR-20a对人垂体瘤细胞系增殖的影响(x±s)
-
Transwell试验结果显示,miR-20a类似物组GH3细胞和HP75细胞迁移细胞数量均高于类似物对照组,差异有统计学意义(P < 0.01和P < 0.05);相反的,miR-20a抑制物组GH3细胞和HP75细胞迁移细胞数量均低于抑制物对照组,差异有统计学意义(P < 0.01)(见表 3)。
分组 n GH3细胞系 HP75细胞系 抑制物对照组 3 65.36±6.54 71.81±17.18 抑制物组 3 40.58±9.56* 49.51±10.92** 类似物对照组 3 68.37±6.84 69.66±16.97 类似物组 3 111.37±11.14△△ 123.41±12.34△△ F — 34.00 13.95 P — < 0.01 < 0.01 MS组内 — 2 593.132 2 979.998 q检验:与抑制物对照组比较*P < 0.05, **P < 0.01;与类似物对照组比较△△P < 0.01 表 3 miR-20a对垂体腺瘤细胞侵袭的影响(x±s)
-
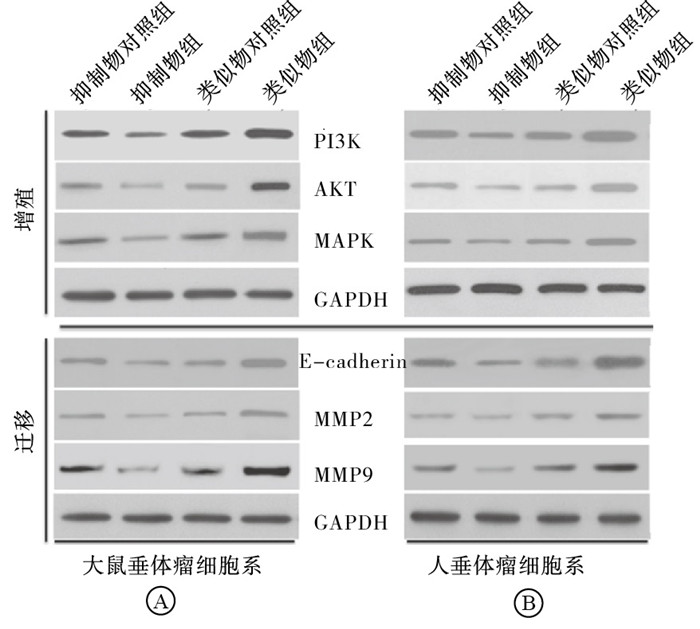
我们进一步检测了PTEN下游与肿瘤增殖和侵袭密切相关的PI3K/AKT信号通路相关蛋白的表达情况。结果表明,与类似物对照组相比,miR-20a类似物组在垂体腺瘤细胞系GH3和HP75中细胞增殖相关蛋白PI3K、AKT、MAPK和侵袭相关蛋白E-cadherin、MMP2和MMP9的表达量均增高,差异均有统计学意义(P < 0.01)(见图 1A和表 4、5);与抑制物对照组相比,miR-20a抑制物组在垂体腺瘤细胞系GH3和HP75中各蛋白表达量均下降,差异均有统计学意义(P < 0.01)(见图 1B和表 6、7)。
分组 n PI3K AKT MAPK 抑制物对照组 3 2.721±0.373 3.670±0.631 2.261±0.269 抑制物组 3 1.091±0.249** 1.017±0.220** 0.990±0.27** 类似物对照组 3 2.725±0.287 3.679±0.515 2.316±0.214 类似物组 3 5.111±0.481△△ 8.119±0.969△△ 4.868±0.750△△ F — 63.85 63.02 42.08 P — < 0.01 < 0.01 < 0.01 MS组内 — 8.223 26.021 7.931 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 4 miR-20a对垂体腺瘤GH3细胞系与增殖相关蛋白表达的影响(x±s)
分组 n PI3K AKT MAPK 抑制物对照组 3 4.328±0.565 3.670±0.333 2.543±0.363 抑制物对照组 3 4.328±0.565 3.670±0.333 2.543±0.363 抑制物组 3 1.016±0.350** 1.017±0.248** 1.009±0.315** 类似物对照组 3 4.331±0.709 3.679±0.515 2.587±0.536 类似物组 3 8.144±0.912△△ 8.119±0.969△△ 4.575±0.961△△ F — 57.34 75.60 17.79 P — < 0.01 < 0.01 < 0.01 MS组内 — 25.465 26.021 6.412 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 5 miR-20a对垂体腺瘤HP75细胞系与增殖相关蛋白表达的影响(x±s)
分组 n E-Cad MMP2 MMP9 抑制物对照组 3 3.567±0.502 2.339±0.524 4.417±0.989 抑制物组 3 1.000±0.294** 0.993±0.246** 0.993±0.364** 类似物对照组 3 3.607±0.487 2.372±0.414 4.480±0.478 类似物组 3 7.13±0.763△△ 5.283±0.334△△ 9.976±1.377△△ F — 65.73 63.50 51.19 P — < 0.01 < 0.01 < 0.01 MS组内 — 19.018 9.814 41.421 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 6 miR-20a对垂体腺瘤GH3细胞系与迁移相关蛋白表达的影响(x±s)
分组 n E-Cad MMP2 MMP9 抑制物对照组 3 4.693±0.785 2.058±0.462 3.909±0.876 抑制物组 3 0.992±0.283** 1.011±0.264** 0.993±0.246** 类似物对照组 3 4.697±0.614 2.088±0.352 3.964±0.788 类似物组 3 9.362±1.409△△ 4.649±0.676△△ 8.828±1.332△△ F — 46.09 33.33 39.26 P — < 0.01 < 0.01 < 0.01 MS组内 — 35.256 7.192 31.645 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 7 miR-20a对垂体腺瘤HP75细胞系与迁移相关蛋白表达的影响(x±s)
-
miR-20a是一种纤维化相关的小RNA,其序列中含有PTEN结合位点,因此我们认为miR-20a负调控PTEN通过PI3K/AKT信号通路进而促进垂体腺瘤的生长。通过双荧光素酶报告基因分析,发现与miR-20a类似物对照组比较,类似物组PTEN-WT的活性降低(P < 0.01)(见表 8)。
分组 n PTEN-WT PTEN-MUT 类似物对照组 3 0.976±0.117 0.945±0.079 类似物组 3 0.482±0.061 1.027±0.070 t — 6.48 1.35 P — < 0.01 >0.05 表 8 双荧光素酶报告基因分析证实miR-20a对PTEN的负调控(x ±s)
-
垂体腺瘤虽是常见的颅内肿瘤,但术后并发症多、易复发,多为良性,但部分肿瘤仍有侵袭性[9]。垂体腺瘤的发病机制目前尚不明确,但多数学者认为与染色体异常、信号通路紊乱、癌基因和抑癌基因的突变、表观遗传改变、miRNA表达异常等因素有关。miRNA具有重要的生物学功能,某些miRNAs参与调控垂体腺瘤发生发展[10-11]。miR-20a是多种生物学过程以及疾病发生发展过程的重要调控分子,在结直肠癌、胃癌、乳腺癌等多种实体瘤都检测到了miR-20a异常表达,并发现其与肿瘤进展相关[12-14]。WEI等[15]通过分析无功能性垂体癌并有多处颅内转移的病例后发现,与原发肿瘤相比,转移癌中的miR-20a表达上调,并且认为miR-20a很可能通过调控PTEN和TIMP2表达从而影响垂体癌转移。本研究也发现,在垂体腺瘤细胞试验中miR-20a与PTEN的表达呈负相关,与文献报道一致。基于以往研究结果和本文发现,我们推测,miR-20a很可能通过靶向PTEN调控PTEN及其下游信号通路的表达。双荧光素酶报告基因实验证实了我们的推测。本文研究结果显示,miR-20a可促进垂体腺瘤细胞的增殖和侵袭能力。PTEN是PI3K/AKT信号通路的重要负调节因子,而PI3K/AKT信号通调控细胞的生长、增殖、存活和代谢等生物学过程,是肿瘤发生发展的关键通路之一[16]。为了探索miR-20a对垂体腺瘤细胞增殖和侵袭能力影响的潜在机制,我们对PI3K/AKT信号通路以及其下游与细胞增殖和侵袭能力相关的关键蛋白进行了检测,结果显示提高miR-20a的表达,促进了肿瘤细胞增殖相关因子PI3K、AKT、MAPK及侵袭相关因子E-cadherin、MMP2、MM9的表达。因此,我们认为miR-20a很可能通过靶向PTEN,激活PI3K/AKT信号通路,从而促进垂体腺瘤增殖和侵袭。
综上所述,我们发现miR-20a很可能通过靶向PTEN,对垂体腺瘤细胞的增殖和侵袭过程进行调控,而且这一调控作用很可能是通过调控PI3K/AKT信号通路实现的。抑制miR-20a可显著抑制大鼠垂体瘤的增殖和侵袭。
miR-20a靶向PTEN调控垂体腺瘤细胞的增殖与侵袭
Study on the miR-20a regulating the proliferation and invasion of pituitary adenoma cells by targeting PTEN
-
摘要:
目的探讨miR-20a对垂体腺瘤细胞增殖和侵袭的影响及其作用机制。 方法培养垂体腺瘤细胞系GH3、HP75,采用RT-qPCR、Western blotting、双荧光素酶报告基因检测等方法,分析垂体腺瘤细胞系中miR-20a和人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)的表达相关性以及相互作用情况;采用CCK8和Transwell等方法检测miR-20a对垂体腺瘤细胞增殖和侵袭能力的影响,进一步考察对PTEN下游PI3K/AKT信号通路的影响。 结果 miR-20a负调控PTEN的表达。体外细胞实验显示,与miR-20a类似物对照组相比,类似物组在垂体腺瘤细胞系GH3和HP75中细胞迁移细胞数量、细胞增殖相关蛋白PI3K、AKT、MAPK和侵袭相关蛋白E-cadherin、MMP2和MMP9的表达量均增高,差异均有统计学意义(P < 0.01);与抑制物对照组相比,miR-20a抑制物组在GH3和HP75中细胞迁移细胞数量和各蛋白表达量均下降,差异均有统计学意义(P < 0.01);双荧光素酶报告基因分析发现与miR-20a类似物对照组比较,类似物组PTEN-WT的活性降低(P < 0.01)。 结论miR-20a在调节细胞的增殖和侵袭的过程中扮演非常重要的作用,因而影响了垂体腺瘤细胞的增殖和侵袭。它可能通过靶向PTEN,影响PI3K/AKT信号通路,参与垂体腺瘤的进程中。 -
关键词:
- 垂体瘤 /
- miR-20a /
- 人第10号染色体缺失的磷酸酶及张力蛋白同源基因 /
- 细胞增殖和侵袭
Abstract:ObjectiveTo explore the effects of miR-20a on the proliferation and invasion of pituitary adenoma cells and its mechanism. MethodsThe pituitary adenoma cell lines GH3 and HP75 were cultured, and the expression correlation and interaction of miR-20a and gene of phosphate and tensin homolog deletedon chromosome ten(PTEN) in cell lines were analyzed by RT-QPCR, Western blotting and double luciferase reporter gene detection.The CCK8 and Transwell methods were used to detect the effects of miR-20a on the proliferation and invasion ability of pituitary adenoma cells, and the effects of miR-20a on the downstream PI3K/AKT signaling pathway of PTEN were further investigated. ResultsmiR-20a can target PTEN and negatively regulate the expression of PTEN.The results of in vitro cell experiments showed that, compared with miR-20a analogue control group, the number of migrating cells, the expression levels of proliferation-related proteins PI3K, AKT, MAPK and invasion-related proteins E-cadherin, MMP2 and MMP9 in the pituitary adenoma cell lines GH3 and HP75 in the analogue group were increased(P < 0.01).Compared with the inhibitor control group, the number of migrating cells and the expression levels of each protein in miR-20a inhibitor group were decreased in GH3 and HP75, and the differences were statistically significant(P < 0.01).Double luciferase reporter gene analysis showed that compared with miR-20a analogue control group, the activity of PTEN-WT in the analogue group was decreased(P < 0.01). ConclusionsThe miR-20a plays an important role in the regulation of cell proliferation and invasion, and affects the growth and invasion of pituitary adenoma cells.It may regulate the PI3K/AKT signaling pathway and participate in the disease progression of pituitary adenoma by regulating the expression of PTEN. -
表 1 miR-20a对大鼠垂体瘤细胞系增殖的影响(x±s)
分组 n Day0 Day1 Day2 Day3 Day4 抑制物对照组 3 0.204±0.013 0.241±0.011 0.356±0.049 0.579±0.051 0.763±0.076 抑制物组 3 0.196±0.014 0.226±0.009** 0.293±0.011** 0.393±0.011** 0.548±0.006** 类似物对照组 3 0.207±0.009 0.241±0.010 0.380±0.017 0.611±0.021 0.809±0.019 类似物组 3 0.210±0.016 0.394±0.021△△ 0.676±0.017△△ 1.008±0.047△△ 1.375±0.063△△ F — 0.65 98.18 112.00 148.38 147.91 P — >0.05 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.000 0.019 0.087 0.201 0.374 q检验: 与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 2 miR-20a对人垂体瘤细胞系增殖的影响(x±s)
分组 n Day0 Day1 Day2 Day3 Day4 抑制物对照组 3 0.214±0.013 0.31±0.012 0.449±0.055 0.666±0.059 0.901±0.09 抑制物组 3 0.205±0.015 0.244±0.010** 0.328±0.012** 0.453±0.012** 0.647±0.007** 类似物对照组 3 0.217±0.010 0.311±0.010 0.475±0.020 0.703±0.024 0.954±0.022 类似物组 3 0.220±0.016 0.425±0.023△△ 0.757±0.019△△ 1.159±0.054△△ 1.623±0.074△△ F — 0.68 76.48 101.55 148.83 149.05 P — >0.05 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.000 0.017 0.099 0.265 0.521 q检验: 与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 3 miR-20a对垂体腺瘤细胞侵袭的影响(x±s)
分组 n GH3细胞系 HP75细胞系 抑制物对照组 3 65.36±6.54 71.81±17.18 抑制物组 3 40.58±9.56* 49.51±10.92** 类似物对照组 3 68.37±6.84 69.66±16.97 类似物组 3 111.37±11.14△△ 123.41±12.34△△ F — 34.00 13.95 P — < 0.01 < 0.01 MS组内 — 2 593.132 2 979.998 q检验:与抑制物对照组比较*P < 0.05, **P < 0.01;与类似物对照组比较△△P < 0.01 表 4 miR-20a对垂体腺瘤GH3细胞系与增殖相关蛋白表达的影响(x±s)
分组 n PI3K AKT MAPK 抑制物对照组 3 2.721±0.373 3.670±0.631 2.261±0.269 抑制物组 3 1.091±0.249** 1.017±0.220** 0.990±0.27** 类似物对照组 3 2.725±0.287 3.679±0.515 2.316±0.214 类似物组 3 5.111±0.481△△ 8.119±0.969△△ 4.868±0.750△△ F — 63.85 63.02 42.08 P — < 0.01 < 0.01 < 0.01 MS组内 — 8.223 26.021 7.931 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 5 miR-20a对垂体腺瘤HP75细胞系与增殖相关蛋白表达的影响(x±s)
分组 n PI3K AKT MAPK 抑制物对照组 3 4.328±0.565 3.670±0.333 2.543±0.363 抑制物对照组 3 4.328±0.565 3.670±0.333 2.543±0.363 抑制物组 3 1.016±0.350** 1.017±0.248** 1.009±0.315** 类似物对照组 3 4.331±0.709 3.679±0.515 2.587±0.536 类似物组 3 8.144±0.912△△ 8.119±0.969△△ 4.575±0.961△△ F — 57.34 75.60 17.79 P — < 0.01 < 0.01 < 0.01 MS组内 — 25.465 26.021 6.412 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 6 miR-20a对垂体腺瘤GH3细胞系与迁移相关蛋白表达的影响(x±s)
分组 n E-Cad MMP2 MMP9 抑制物对照组 3 3.567±0.502 2.339±0.524 4.417±0.989 抑制物组 3 1.000±0.294** 0.993±0.246** 0.993±0.364** 类似物对照组 3 3.607±0.487 2.372±0.414 4.480±0.478 类似物组 3 7.13±0.763△△ 5.283±0.334△△ 9.976±1.377△△ F — 65.73 63.50 51.19 P — < 0.01 < 0.01 < 0.01 MS组内 — 19.018 9.814 41.421 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 7 miR-20a对垂体腺瘤HP75细胞系与迁移相关蛋白表达的影响(x±s)
分组 n E-Cad MMP2 MMP9 抑制物对照组 3 4.693±0.785 2.058±0.462 3.909±0.876 抑制物组 3 0.992±0.283** 1.011±0.264** 0.993±0.246** 类似物对照组 3 4.697±0.614 2.088±0.352 3.964±0.788 类似物组 3 9.362±1.409△△ 4.649±0.676△△ 8.828±1.332△△ F — 46.09 33.33 39.26 P — < 0.01 < 0.01 < 0.01 MS组内 — 35.256 7.192 31.645 q检验:与抑制物对照组比较**P < 0.01;与类似物对照组比较△△P < 0.01 表 8 双荧光素酶报告基因分析证实miR-20a对PTEN的负调控(x ±s)
分组 n PTEN-WT PTEN-MUT 类似物对照组 3 0.976±0.117 0.945±0.079 类似物组 3 0.482±0.061 1.027±0.070 t — 6.48 1.35 P — < 0.01 >0.05 -
[1] SRIRANGAM NADHAMUNI V, KORBONITS M. Novel insights into pituitary tumorigenesis: Genetic and epigenetic mechanisms[J]. Endocr Rev, 2020, 41(6): 821. doi: 10.1210/endrev/bnaa006 [2] CHENG J, NIE D, LI B, et al. CircNFIX promotes progression of pituitary adenoma via CCNB1 by sponging miR-34a-5p[J]. Mol Cell Endocrinol, 2021, 525: 111140. doi: 10.1016/j.mce.2020.111140 [3] HONG CS, KUNDISHORA AJ, ELSAMADICY AA, et al. Somatic NF1 mutations in pituitary adenomas: report of two cases[J]. Cancer Genet, 2021: 26. [4] LUONGO F, COLONNA F, CALAPÀ F, et al. PTEN tumor-suppressor: The dam of stemness in cancer[J]. Cancers(Basel), 2019, 11(8): 1076. [5] HANNA C, DUNNE VL, WALKER SM, et al. ATM kinase inhibition preferentially sensitises PTEN-deficient prostate tumour cells to ionising radiation[J]. Cancers(Basel), 2020, 13(1): 79. [6] XU W, ZHANG M, LI Y, et al. YAP manipulates proliferation via PTEN/AKT/mTOR-mediated autophagy in lung adenocarcinomas[J]. Cancer Cell Int, 2021, 21(1): 30. doi: 10.1186/s12935-020-01688-9 [7] ZHANG J, LI X, ZHANG Y. Correlation of NEDD4-1 and PTEN expression with the invasive capacity of pituitary adenomas[J]. Mol Clin Oncol, 2017, 6(1): 96. doi: 10.3892/mco.2016.1092 [8] ZHENG Z, ZHANG Y, ZHANG Z, et al. Effect of miR-106b on Invasiveness of Pituitary Adenoma via PTEN-PI3K/AKT[J]. Med Sci Monit, 2017, 23: 1277. doi: 10.12659/MSM.900092 [9] LIU L, HE J, WEI X, et al. MicroRNA-20a-mediated loss of autophagy contributes to breast tumorigenesis by promoting genomic damage and instability[J]. Oncogene, 2017, 36(42): 5874. doi: 10.1038/onc.2017.193 [10] BRUE T, CASTINETTI F. The risks of overlooking the diagnosis of secreting pituitary adenomas[J]. Orphanet J Rare Dis, 2016, 11(1): 135. doi: 10.1186/s13023-016-0516-x [11] WEI D, YU Z, CHENG Y, et al. Dysregulated miR-137 and its target EGFR contribute to the progression of pituitary adenomas[J]. Mol Cell Endocrinol, 2021, 520: 111083. doi: 10.1016/j.mce.2020.111083 [12] CHENG D, ZHAO S, TANG H, et al. MicroRNA-20a-5p promotes colorectal cancer invasion and metastasis by downregulating Smad[J]. Oncotarget, 2016, 7(29): 45199. doi: 10.18632/oncotarget.9900 [13] YANG R, FU Y, ZENG Y, et al. Serum miR-20a is a promising biomarker for gastric cancer[J]. Biomed Rep, 2017, 6(4): 429. doi: 10.3892/br.2017.862 [14] LIU L, HE J, WEI X, et al. MicroRNA-20a-mediated loss of autophagy contributes to breast tumorigenesis by promoting genomic damage and instability[J]. Oncogene, 2017, 36(42): 5874. doi: 10.1038/onc.2017.193 [15] WEI Z, ZHOU C, LIU M, et al. MicroRNA involvement in a metastatic non-functioning pituitary carcinoma[J]. Pituitary, 2015, 18(5): 710. doi: 10.1007/s11102-015-0648-3 [16] LEE YR, CHEN M, PANDOLFI PP. The functions and regulation of the PTEN tumour suppressor: new modes and prospects[J]. Nat Rev Mol Cell Biol, 2018, 19(9): 547. doi: 10.1038/s41580-018-0015-0 -





 下载:
下载: