-
脑胶质母细胞瘤是脑内最常见的原发肿瘤,其发病率占脑内肿瘤的30%~50%,在脑胶质母细胞瘤的不同组织分型中,星形胶质母细胞瘤最为多见[1]。目前治疗脑星形胶质母细胞瘤的主要手段是手术切除和术后放化疗的联合治疗方法。尽管近三十年来脑星形胶质母细胞瘤的治疗疗效有较大改善,但是手术治疗只能做到肉眼切除,而多数呈“树根状”生长的脑星形胶质母细胞瘤通常浸润到正常脑组织中,导致手术切除不干净。另一方面由于人体内血脑屏障的原因,大多数抗肿瘤药物不能进入大脑充分发挥作用,给抗脑胶质母细胞瘤药物的开发也带来了很大挑战[2]。因此,发掘新的具有诊断和治疗意义的生物标记分子,进一步了解其作用机制,对脑胶质母细胞瘤的早期诊断和临床治疗具有重要意义。
凝集素是一种能和糖结合的蛋白,蛋白分子量为45 000,在黏着反应和细胞识别中起关键作用,研究[3]发现可通过发挥凝集素在肿瘤细胞之间的黏着功效用于肿瘤的临床治疗。C型凝集素蛋白家族4成员M(CLEC4M),也称为DC-SIGNR,是一种依赖Ca2+的C型凝集素,主要表达于淋巴窦内皮细胞、肝窦状内皮细胞和胎盘的毛细血管内皮细胞表面,参与机体对病原微生物的识别及免疫应答[4-5]。CLEC4M除了与病原体的感染密切相关,研究[6-7]表明CLEC4M同样参与了肿瘤免疫应答,在部分肿瘤组织中CLEC4M的表达水平发生异常,如CLEC4M过表达抑制肝癌的发生发展,与对照癌旁组织相比其在肝癌组织中的表达量下降;在对肺癌病人CLEC4M表达水平的研究中,也得到一致的结果[8]。但在结直肠癌中,CLEC4M的表达水平明显高于正常对照组,CLEC4M过表达促进结直肠癌的增殖、迁移和侵袭能力[9]。尽管CLEC4M在不同癌症中对于肿瘤发生发展所产生的作用不同,但是其对星形胶质母细胞瘤的作用目前还鲜见相关报道。
根据人类蛋白图谱数据库(human protein atls,HPA)资料,前期我们发现CLEC4M在星形胶质母细胞瘤病人的癌症组织中表达,但在正常脑组织中表达量很少;通过在线生存曲线分析,发现随着CLEC4M在星形胶质母细胞瘤病人中表达水平的升高,病人的生存时间缩短,我们推测CLEC4M可能促进星形胶质母细胞瘤的增殖。鉴于此,本课题将在细胞和分子水平上深入探讨CLEC4M对星形胶质母细胞瘤细胞生物学行为的影响及其作用机制,有助于临床上星形胶质母细胞瘤的早期诊断和治疗。
-
本实验使用的U-118MG、U-87MG细胞系购自上海赛百慷生物技术股份有限公司,均经STR鉴定。U-118MG细胞培养基为10%胎牛血清(Lonsera)、1%青霉素-链霉素双抗(碧云天)的DMEM(Gibco)培养基;U-87MG细胞培养基为含10%胎牛血清(Lonsera)、1%青霉素-链霉素双抗(碧云天)、1% L-谷氨酰胺(iCell)和1%非必需氨基酸的MEM(iCell) 培养基,细胞于37 ℃二氧化碳培养箱中培养。
-
慢病毒质粒购自于广州易锦生物技术有限公司,在37 ℃下向1×106细胞中加入4 μL带有CLEC4M的慢病毒培养12 h,不含CLEC4M的慢病毒作为阴性对照(Vector组)。然后用正常培养基替换上清液,37 ℃下培养48 h后使用嘌呤霉素(4 μg/mL)筛选成功转入质粒的细胞。我们构建了CLEC4M干扰U-118MG稳转细胞系(U118-MG/shCLEC4M)及其对照组(U118-MG/shCon);CLEC4M过表达U-118MG稳转细胞系(U118-MG/CLEC4M)及其对照组(U118-MG/Vector);CLEC4M干扰U-87MG稳转细胞系(U87-MG/shCLEC4M)及其对照组(U87-MG/shCon);CLEC4M过表达U-87MG稳转细胞系(U87-MG/CLEC4M)及其对照组(U87-MG/Vector)。
-
细胞接种在96孔板中,每孔接种2×103细胞,加200 μL培养基,每组重复3次。在37 ℃下孵育24、48和72 h后,每个孔加入20 μL的CCK-8试剂(biosharp),在37 ℃下孵育3 h后,使用Multiskan FC微孔板仪(Thermo Fisher Scientific)在450 nm处测量吸光度(OD)[10]。
-
细胞接种在6孔板中,待细胞铺满至90%培养瓶底部后,用10 μL移液管尖在细胞层上画出空白区域。用PBS轻轻冲洗细胞2次,然后加入正常培养基中。细胞图像在0、24 h采集,数据分析基于Image J软件。细胞迁移率的计算公式为:24 h细胞迁移率=(0 h刮伤区细胞数目-24 h刮伤区细胞数目)/0 h刮伤区数目。
-
细胞接种在6孔板中,待密度至65%~75% 时加入含地塞米松的无血清培养基进行同步化处理,2 h后更换正常培养基,24 h后收集细胞。加入TRIzol(Invitrogen) 试剂从细胞中提总RNA, 逆转录成cDNA后在Step One Plus Real-Time PCR仪上(Life Technologies)进行RT-qPCR分析。
-
细胞接种在6孔板中,每孔接种2×105个细胞,培养24 h后收集细胞,加入预冷的75%乙醇于4 ℃冰箱固定4 h。离心弃上清后,加入400 μL 50 μg/mL碘化丙啶,4 ℃下避光孵育30 min,使用流式细胞仪(Becton Dickinson)检测细胞周期的分布。
-
采用t检验。
-
为了检测CLEC4M对脑星形胶质母细胞瘤的作用,在U-118 MG和U-87 MG细胞中转染CLEC4M过表达克隆慢病毒和shRNA干扰克隆慢病毒,添加嘌呤霉素进行筛选,建立了CLEC4M稳转细胞系。RT-qPCR检测结果显示,分别与对照组U118-MG/Vector和U87-MG/Vector稳转细胞系比,过表达CLEC4M的稳转细胞系U118-MG/CLEC4M和U87-MG/CLEC4M中CLEC4M的mRNA水平均明显升高(P < 0.01);分别与对照组U118-MG/shCon和U87-MG/shCon稳转细胞系比,干扰CLEC4M的稳转细胞系U118-MG/shCLEC4M和U87-MG/shCLEC4M中CLEC4M的mRNA水平均明显降低(P < 0.01)(见表 1)。提示CLEC4M在脑星形胶质母细胞瘤中干扰和过表达成功,稳转细胞系可用于后续实验。
分组 n CLEC4M mRMA t P U118-MG/shCon 3 1.00 50.87 < 0.01 U118-MG/shCLEC4M 3 0.45±0.02 U118-MG/Vector 3 1.00 4.70 < 0.01 U118-MG/CLEC4M 3 2151.00±792.25 U87-MG/shCon 3 1.00 6.16 < 0.01 U87-MG/shCLEC4M 3 0.22±0.22 U87-MG/Vector 3 1.00 7.06 < 0.01 U87-MG/CLEC4M 3 7276.40±1784.61 表 1 CLEC4M干扰和过表达稳转细胞系中CLEC4M的mRNA水平(x±s)
-
CCK-8细胞毒性实验检测CLEC4M对脑星形胶质母细胞瘤增殖能力影响的结果显示,分别与对照组U118-MG/Vector和U87-MG/Vector细胞相比,发现过表达CLEC4M的U118-MG/CLEC4M和U87-MG/CLEC4M细胞的增殖率均明显升高(P < 0.05~P < 0.01);分别与对照组U118-MG/shCon和U87-MG/shCon细胞相比,干扰CLEC4M的U118-MG/shCLEC4M和U87-MG/shCLEC4M细胞的增殖率均明显降低(P < 0.05~P < 0.01)(见表 2)。提示CLEC4M促进脑星形胶质母细胞瘤的增殖。
分组 n OD450(24 h) OD450(48 h) OD450(72 h) U118-MG/shCon 3 0.91±0.05 1.03±0.02 1.65±0.05 U118-MG/shCLEC4M 3 0.64±0.05 0.86±0.04 1.34±0.07 t — 7.03 5.98 6.14 P — < 0.01 < 0.01 < 0.01 U118-MG/Vector 3 0.70±0.04 0.86±0.03 1.52±0.06 U118-MG/CLEC4M 3 0.84±0.04 0.95±0.04 1.76±0.11 t — 4.36 3.29 3.32 P — < 0.05 < 0.05 < 0.05 U87-MG/shCon 3 0.44±0.03 0.51±0.04 0.91±0.06 U87-MG/shCLEC4M 3 0.35±0.02 0.40±0.02 0.64±0.03 t — 4.29 4.02 7.42 P — < 0.05 < 0.05 < 0.01 U87-MG/Vector 3 0.36±0.00* 0.44±0.03 0.63±0.02 U87-MG/CLEC4M 3 0.43±0.01 0.53±0.03 0.94±0.04 t — 15.81 3.92 11.09 P — < 0.01 < 0.05 < 0.01 注:0.00*代表 < 0.001 表 2 CLEC4M促进脑星形胶质母细胞瘤的增殖(x±s)
-
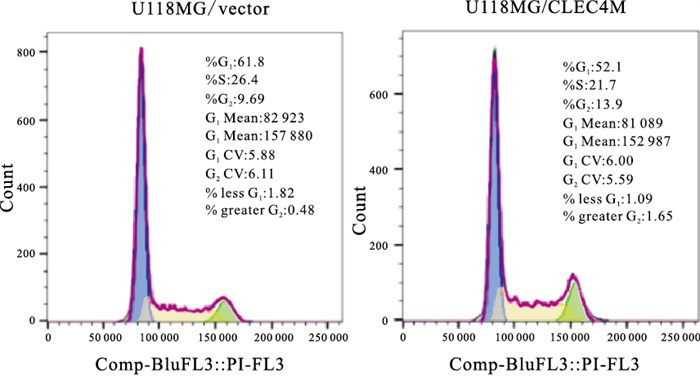
通过流式细胞实验进一步检测CLEC4M是如何影响脑星形胶质母细胞瘤的细胞增殖,结果显示,与对照组相比,发现过表达CLEC4M的U118-MG/CLEC4M细胞与对照组细胞U118-MG/Vector相比,G0/G1期细胞比例显著降低(P < 0.05),S期细胞比例显著上升(P < 0.05),G2/M期细胞比例无明显变化(P>0.05),在U87-MG细胞中得到一致的结果(见图 1~2、表 3)。表明CLEC4M在G0/G1和S期影响细胞周期从而促进脑星形胶质母细胞瘤的增殖能力。
分组 n G0/G1 S G2 U118-MG/Vector 3 60.60±1.65 25.70±2.14 12.09±2.63 U118-MG/CLEC4M 3 49.77±3.87 33.27±2.89 14.53±0.85 t — 4.46 3.65 1.53 P — < 0.05 < 0.05 >0.05 U87-MG/Vector 3 60.20±3.65 25.87±2.55 11.17±0.81 U87-MG/CLEC4M 3 49.77±0.31 31.77±0.40 13.10±1.01 t — 4.93 3.96 2.57 P — < 0.01 < 0.05 >0.05 表 3 CLEC4M对细胞周期的影响(x±s)
-
通过细胞划痕实验对CLEC4M对脑星形胶质母细胞瘤迁移能力影响的检测显示,与对照组相比,发现过表达CLEC4M促进U-118MG和U-87MG细胞的迁移(P < 0.05);干扰CLEC4M抑制U-118MG和U-87MG细胞的迁移(P < 0.05)(见图 3~4、表 4)。表明CLEC4M促进脑星形胶质母细胞瘤的迁移。
分组 n 愈合率/% t P U118-MG/shCon 3 0.60±0.04 5.45 < 0.05 U118-MG/shCLEC4M 3 0.44±0.01 U118-MG/Vector 3 0.50±0.02 8.08 < 0.05 U118-MG/CLEC4M 3 0.73±0.03 U87-MG/shCon 3 0.66±0.07 4.75 < 0.05 U87-MG/shCLEC4M 3 0.39±0.03 U87-MG/Vector 3 0.58±0.01 6.25 < 0.05 U87-MG/CLEC4M 3 0.76±0.04 表 4 CLEC4M促进脑星形胶质母细胞瘤的迁移(x±s)
-
为了分析CLEC4M影响脑星形胶质母细胞瘤发展的具体作用机制,利用转录组测序技术对U118-MG/CLEC4M细胞(过表达CLEC4M)与U118-MG/Vector细胞(正常表达CLEC4M)进行检测,分析2组间的转录本信息,鉴定差异表达的基因。转录组测序结果发现在2组中共有5 857个基因的转录水平有明显改变,其中2 897个基因显著上调,2 960个基因显著下调(见图 5)。我们将鉴定的差异表达基因进行GO分析,结果显示这些差异表达基因多数与肽链翻译起始的生物过程、细胞基质结合的细胞组成、钙粘蛋白连接的分子功能等生物过程有关;KEGG富集通路分析显示差异表达的基因主要在核糖体、细胞周期以及癌症信号通路中富集(见图 6)。
-
为了进一步明确CLEC4M影响癌症信号通路的具体基因,对癌症信号通路中差异表达基因的转录水平进行分析。与对照组相比,发现在U118-MG细胞中过表达CLEC4M可特异性降低CCNB1、CCND3、APAF1的mRNA水平(P < 0.05~P < 0.01);相反,在U118-MG细胞中过表达CLEC4M可特异性升高STEAP3、RRM2B、FAS的mRNA水平(P < 0.01)(见表 5)。表明CLEC4M可能与癌症信号通路中的CCNB1、CCND3、APAF1、STEAP3、RRM2B、FAS这些基因互作共同促进脑星形胶质母细胞瘤增殖和迁移。
分组 n CCNB1 CCND3 APAF1 STEAP3 RRM2B FAS U118-MG/Vector 3 108.67±4.33 10.52±0.43 3.43±0.45 52.27±2.14 14.62±1.24 3.67±0.18 U118-MG/CLEC4M 3 75.37±2.15 4.96±0.21 2.33±0.14 75.82±2.15 19.91 ±1.28 4.73±0.32 t — 11.93 20.16 4.08 13.44 5.13 4.96 P — < 0.01 < 0.01 < 0.05 < 0.01 < 0.01 < 0.01 表 5 癌症信号通路中差异表达基因的转录水平(x±s)
-
星形母细胞瘤是一种罕见的胶质瘤,这种神秘的肿瘤优先出现在儿童、青少年和年轻成年人的大脑半球,尤其是额叶和枕叶,其特点是星形细胞假性胶质细胞和血管透明化,边界清楚。星形母细胞瘤浸润性地在脑内生长,导致手术切除不彻底,且术后容易复发[12]。人脑星形胶质母细胞瘤细胞株U-118MG和U-87MG均是由科学家J.Ponten从恶性神经胶质瘤细胞株中构建的,本身可少量表达CLEC4M。本研究使用这两株细胞系通过慢病毒转染法成功构建了稳定过表达和干扰CLEC4M星形母细胞瘤细胞株,过表达和干扰效果显著。在此基础上,本研究探讨CLEC4M对脑星形胶质母细胞瘤的增殖和迁移的影响,并深入了解其影响增殖和迁移的分子机制。结果发现,CLEC4M促进脑星形胶质母细胞瘤的增殖和迁移,且CLEC4M主要影响G0/G1和S期来调控细胞周期进程。此外,转录组测序结果发现在U-118 MG中过表达CLEC4M导致5 857个基因在转录水平上有明显变化,其中2 897个基因显著上调,2 960个基因显著下调。KEGG分析显示差异表达的基因主要在核糖体、细胞周期以及癌症信号通路中富集。具体而言,CLEC4M可能与癌症信号通路中的CCNB1、CCND3、APAF1、STEAP3、RRM2B、FAS这些基因互作共同促进脑星形胶质母细胞瘤增殖和迁移。
CCNB1编码细胞周期蛋白B1, 是影响细胞周期的G2/M期过渡的关键分子。研究[13]发现在胶脑质瘤中CCNB1的过表达抑制了人胶质瘤细胞的体外和体内增殖。CCND3编码细胞周期蛋白D3,能与肿瘤抑制蛋白Rb互作并参与其磷酸化,是影响细胞周期G1/S期过渡的关键分子[14]。CCND3主要在恶性胶质瘤中表达,与胶质瘤向恶性表型的转化有关[15]。APAF1编码凋亡肽酶激活因子,该蛋白结合细胞色素c和dATP后形成凋亡小体,凋亡小体结合并切割caspase 9前体蛋白,释放成熟的活化形式。活化的caspase 9刺激随后的caspase级联反应,使细胞凋亡。APAF1和caspase 9的共转显著增强了胶质瘤中p53介导的细胞凋亡[16]。
STEAP3编码前列腺六膜上皮细胞抗原3,是一种多通道膜蛋白,其功能是铁转运体。该蛋白可介导下游对p53的反应,并促进细胞凋亡。STEAP3在恶性胶质瘤中高度表达,特别是在间质胶质瘤分子亚型,STEAP3的缺失减弱了胶质瘤细胞的增殖、侵袭能力[17]。RRM2B编码一个p53诱导的核糖核苷酸还原酶的小亚基,这种异型四元酶催化核糖二磷酸盐向脱氧核糖二磷酸盐的转化,RRM2B是一种DNA合成所必需的酶,参与DNA修复、线粒体稳态和细胞周期阻滞。KEGG通路富集分析发现,RRM2B在胶质瘤路径和p53信号通路中显著富集[18]。FAS编码Fas细胞表面死亡受体, 在凋亡的生理调控中起着核心作用,并与免疫系统疾病和各种恶性肿瘤的发病机理有关。Fas在神经胶质瘤中比正常脑组织表达量更多,腺病毒介导的由组织特异性启动子控制的Fas基因的诱导可能是一种有前景的治疗恶性胶质瘤的方法[19]。
本研究结果显示,CLEC4M的过表达抑制了CCNB1、CCND3和APAF1抑癌基因的表达,促进了STEAP3、RRM2B和FAS促癌基因的表达,从而促进脑星形胶质母细胞瘤的增殖,然而未来还需要进一步实验验证。总之,本研究在细胞和分子水平上研究CLEC4M对脑星形胶质母细胞瘤生物行为学的影响和作用机制,首次发现CLEC4M促进脑星形胶质母细胞瘤的增殖和迁移,可为临床上脑星形胶质母细胞瘤的治疗和辅助诊断提供潜在生物靶点。
CLEC4M对脑星形胶质母细胞瘤的增殖和迁移的影响
Study on CLEC4M in promoting the proliferation and migration of brain astroblastoma
-
摘要:
目的探讨C型凝集素蛋白家族4成员M(CLEC4M)对脑星形胶质母细胞瘤增殖和迁移的影响及其作用机制。 方法慢病毒转染法构建过表达和干扰CLEC4M的脑星形胶质母细胞瘤细胞系;并用实时定量PCR法检测CLEC4M的转录水平。CCK-8细胞毒性实验和细胞划痕实验分别检测CLEC4M对细胞增殖和迁移的影响,流式细胞术分析CLEC4M对细胞周期的影响。转录组测序技术鉴定癌症信号通路上被CLEC4M调控的基因。 结果过表达和干扰CLEC4M脑星形母细胞瘤细胞株被成功构建,且过表达和干扰的效果显著(P < 0.01)。CLEC4M促进脑星形胶质母细胞瘤的增殖和迁移,且CLEC4M主要影响G0/G1和S期来调控细胞周期进程(P < 0.05~P < 0.01)。此外,转录组测序结果发现在脑星形胶质母细胞瘤中过表达CLEC4M导致5 857个基因在转录水平上有明显变化,其中2 897个基因显著上调,2 960个基因显著下调。KEGG富集通路分析显示这些差异表达的基因显著富集于核糖体、细胞周期以及癌症信号通路中。CLEC4M与癌症信号通路中的CCNB1、CCND3、APAF1、STEAP3、RRM2B、FAS这些基因相互作用共同促进脑星形胶质母细胞瘤增殖和迁移(P < 0.05~P < 0.01)。 结论CLEC4M促进脑星形胶质母细胞瘤的增殖和迁移。 -
关键词:
- 脑星形胶质母细胞瘤 /
- C型凝集素蛋白家族4成员M /
- 增殖 /
- 迁移
Abstract:ObjectiveTo investigate the effect of CLEC4M on brain astroblastoma proliferation and migration, as well as the mechanism behind it. MethodsBrain astroblastoma cell lines overexpressing and interfering with CLEC4M were constructed by lentivirus transfection. Real-time quantitative PCR was used to determine the level of CLEC4M expression. The effects of CLEC4M on the proliferation and migration of brain astroblastoma were studied using the CCK-8 test and the cell scratch assay, and the effect of CLEC4M on the cell cycle of brain astroblastoma was studied using flow cytometry. Transcriptome sequencing was used to identify genes in cancer signaling pathways regulated by CLEC4M. ResultsBrain astroblastoma cell lines overexpressing and interfering with CLEC4M were successfully constructed, and the overexpression and interference effect were significant(P < 0.01). CLEC4M increased astroblastoma proliferation and migration, and it mostly affected the G0/G1 and S phases of the cell cycle to regulate cell cycle progression(P < 0.05 to P < 0.01). In addition, overexpression of CLEC4M in brain astroblastoma also modified the expression levels of 5 857 genes, with 2 897 genes highly up-regulated and 2 960 genes significantly down-regulated, according to transcriptome sequencing studies. The differentially expressed genes were largely enriched in ribosomes, cell cycle, and cancer signaling pathways, according to KEGG analysis. CLEC4M interacted with CCNB1, CCND3, APAF1, STEAP3, RRM2B and FAS genes in cancer signaling pathways(P < 0.05 to P < 0.01). ConclusionsCLEC4M can increase the proliferation and migration of brain astroblastoma. -
Key words:
- brain astroblastoma /
- recombinant C-type lectin domain /
- proliferation /
- migration
-
表 1 CLEC4M干扰和过表达稳转细胞系中CLEC4M的mRNA水平(x±s)
分组 n CLEC4M mRMA t P U118-MG/shCon 3 1.00 50.87 < 0.01 U118-MG/shCLEC4M 3 0.45±0.02 U118-MG/Vector 3 1.00 4.70 < 0.01 U118-MG/CLEC4M 3 2151.00±792.25 U87-MG/shCon 3 1.00 6.16 < 0.01 U87-MG/shCLEC4M 3 0.22±0.22 U87-MG/Vector 3 1.00 7.06 < 0.01 U87-MG/CLEC4M 3 7276.40±1784.61 表 2 CLEC4M促进脑星形胶质母细胞瘤的增殖(x±s)
分组 n OD450(24 h) OD450(48 h) OD450(72 h) U118-MG/shCon 3 0.91±0.05 1.03±0.02 1.65±0.05 U118-MG/shCLEC4M 3 0.64±0.05 0.86±0.04 1.34±0.07 t — 7.03 5.98 6.14 P — < 0.01 < 0.01 < 0.01 U118-MG/Vector 3 0.70±0.04 0.86±0.03 1.52±0.06 U118-MG/CLEC4M 3 0.84±0.04 0.95±0.04 1.76±0.11 t — 4.36 3.29 3.32 P — < 0.05 < 0.05 < 0.05 U87-MG/shCon 3 0.44±0.03 0.51±0.04 0.91±0.06 U87-MG/shCLEC4M 3 0.35±0.02 0.40±0.02 0.64±0.03 t — 4.29 4.02 7.42 P — < 0.05 < 0.05 < 0.01 U87-MG/Vector 3 0.36±0.00* 0.44±0.03 0.63±0.02 U87-MG/CLEC4M 3 0.43±0.01 0.53±0.03 0.94±0.04 t — 15.81 3.92 11.09 P — < 0.01 < 0.05 < 0.01 注:0.00*代表 < 0.001 表 3 CLEC4M对细胞周期的影响(x±s)
分组 n G0/G1 S G2 U118-MG/Vector 3 60.60±1.65 25.70±2.14 12.09±2.63 U118-MG/CLEC4M 3 49.77±3.87 33.27±2.89 14.53±0.85 t — 4.46 3.65 1.53 P — < 0.05 < 0.05 >0.05 U87-MG/Vector 3 60.20±3.65 25.87±2.55 11.17±0.81 U87-MG/CLEC4M 3 49.77±0.31 31.77±0.40 13.10±1.01 t — 4.93 3.96 2.57 P — < 0.01 < 0.05 >0.05 表 4 CLEC4M促进脑星形胶质母细胞瘤的迁移(x±s)
分组 n 愈合率/% t P U118-MG/shCon 3 0.60±0.04 5.45 < 0.05 U118-MG/shCLEC4M 3 0.44±0.01 U118-MG/Vector 3 0.50±0.02 8.08 < 0.05 U118-MG/CLEC4M 3 0.73±0.03 U87-MG/shCon 3 0.66±0.07 4.75 < 0.05 U87-MG/shCLEC4M 3 0.39±0.03 U87-MG/Vector 3 0.58±0.01 6.25 < 0.05 U87-MG/CLEC4M 3 0.76±0.04 表 5 癌症信号通路中差异表达基因的转录水平(x±s)
分组 n CCNB1 CCND3 APAF1 STEAP3 RRM2B FAS U118-MG/Vector 3 108.67±4.33 10.52±0.43 3.43±0.45 52.27±2.14 14.62±1.24 3.67±0.18 U118-MG/CLEC4M 3 75.37±2.15 4.96±0.21 2.33±0.14 75.82±2.15 19.91 ±1.28 4.73±0.32 t — 11.93 20.16 4.08 13.44 5.13 4.96 P — < 0.01 < 0.01 < 0.05 < 0.01 < 0.01 < 0.01 -
[1] MUIR M, GOPAKUMAR S, TRAYLOR J, et al. Glioblastoma multiforme: novel therapeutic targets[J]. Expert Opin Ther Targets, 2020, 24(7): 605. doi: 10.1080/14728222.2020.1762568 [2] SARPER B, YAPARK BAYRAK B, HALIS H, et al. Malignant Astroblastoma[J]. Balkan Med J, 2020, 37(4): 224. [3] TORIGOE S, SCHUTT CR, YAMASAKI S. Immune discrimination of the environmental spectrum through C-type lectin receptors[J]. Int Immunol, 2021, 33(12): 847. doi: 10.1093/intimm/dxab074 [4] DROUIN M, SAENZ J, CHIFFOLEAU E. C-type lectin-like receptors: head or tail in cell death immunity[J]. Front Immunol, 2020, 18(11): 251. [5] LI XC, HONG W, CAI YL, et al. CSF-1-induced DC-SIGN+ macrophages are present in the ovarian endometriosis[J]. Reprod Biol Endocrinol, 2022, 20(1): 48. doi: 10.1186/s12958-022-00901-w [6] YU Q, GAO K. CLEC4M overexpression inhibits progression and is associated with a favorable prognosis in hepatocellular carcinoma[J]. Mol Med Rep, 2020, 22(3): 2245. doi: 10.3892/mmr.2020.11336 [7] LUO L, CHUO L, KE K, Zhao B, et al. High expression levels of CLEC4M indicate poor prognosis in patients with hepatocellular carcinoma[J]. Oncol Lett, 2020, 19(3): 1711. [8] TAN LM, LI X, QIU CF, et al. CLEC4M is associated with poor prognosis and promotes cisplatin resistance in NSCLC patients[J]. J Cancer, 2019, 10(25): 6374. doi: 10.7150/jca.30139 [9] NA H, LIU X, LI X, et al. Novel roles of DC-SIGNR in colon cancer cell adhesion, migration, invasion, and liver metastasis[J]. J Hematol Oncol, 2017, 10(1): 28. doi: 10.1186/s13045-016-0383-x [10] 全裔, 杨峻, 农林琳, 王秀娟, 等. 血管紧张素Ⅱ对肝癌细胞增殖的影响及其机制研究[J]. 蚌埠医学院学报, 2022, 47(1): 18. [11] 杨硕, 杨清玲. 外泌体介导的miR-18b-5p调控NEDD9对乳腺癌细胞增殖、迁移、侵袭的影响[J]. 蚌埠医学院学报, 2022, 47(2): 141. [12] 孙广卫, 张少军, 李健. 脑胶质瘤免疫治疗的进展[J]. 蚌埠医学院学报, 2012, 37(2): 244. doi: 10.3969/j.issn.1000-2200.2012.02.043 [13] CHEN H, HUANG Q, DONG J, et al. Overexpression of CDC2/CyclinB1 in gliomas, and CDC2 depletion inhibits proliferation of human glioma cells in vitro and in vivo[J]. BMC Cancer, 2008, 29(8): 29. [14] KETZER F, ABDELRASOUL H, VOGEL M, et al. CCND3 is indispensable for the maintenance of B-cell acute lymphoblastic leukemia[J]. Oncogenesis, 2022, 11(1): 1. doi: 10.1038/s41389-021-00377-0 [15] ZHANG X, ZHAO M, HUANG AY, et al. The effect of cyclin D expression on cell proliferation in human gliomas[J]. J Clin Neurosci, 2005, 12(2): 166. doi: 10.1016/j.jocn.2004.03.036 [16] SHINOURA N, SAKURAI S, SHIBASAKI F, et al. Co-transduction of Apaf-1 and caspase-9 highly enhances p53-mediated apoptosis in gliomas[J]. Br J Cancer, 2002, 86(4): 587 doi: 10.1038/sj.bjc.6600061 [17] HAN M, XU R, WANG S, et al. Six-transmembrane epithelial antigen of prostate 3 predicts poor prognosis and promotes glioblastoma growth and invasion[J]. Neoplasia, 2018, 20(6): 543. doi: 10.1016/j.neo.2018.04.002 [18] CHOUDHARY S, BURNS SC, MIRSAFIAN H, et al. Genomic analyses of early responses to radiation inglioblastoma reveal new alterations at transcription, splicing, and translation levels[J]. Sci Rep, 2020, 10(1): 8979. doi: 10.1038/s41598-020-65638-1 [19] SHINOURA N, OHASHI M, YPSHIDA Y, et al. Adenovirus-mediated overexpression of Fas induces apoptosis of gliomas[J]. Cancer Gene Ther, 2000, 7(2): 224. doi: 10.1038/sj.cgt.7700110 -





 下载:
下载: