-
胰腺癌发病隐匿、进展速度快,且预后较差[1-2]。目前,胰腺癌的发病机制尚不明确,基因靶点治疗是胰腺癌研究的热点。微小RNA(micro RNA,miRNA)可在转录后调控靶基因的表达,参与细胞增殖、凋亡、转移和分化等过程[3]。miR-431-5p在肺癌等肿瘤中表达下调,靶向上调其表达可抑制癌细胞的增殖、迁移、侵袭及血管生成[4-6],但其对胰腺癌细胞生物学行为的影响及其作用机制目前还不清楚。Targetscan生物信息学软件预测显示,丝氨酸/苏氨酸蛋白激酶1(AKT1)可能是miR-431-5p的靶基因。AKT1已被确定在胰腺癌等多种肿瘤中发挥致癌基因作用[7]。但miR-431-5p能否通过调控AKT1影响胰腺癌细胞的生物学行为尚不清楚。本研究主要探讨了miR-431-5p对胰腺癌细胞增殖、迁移、侵袭和凋亡的影响及其能否通过调控AKT1表达发挥作用,以期为寻找胰腺癌治疗潜在的分子靶点提供参考。现作报道。
-
人胰腺癌细胞株PANC-1、CFPAC-1和人正常胰腺细胞株hTERT-HPNE购自美国ATCC;DMEM高糖培养基、牛血清白蛋白、胰蛋白酶Trypsin、二甲基亚矾(DMSO)和四氮唑蓝(MTT)购自Sigma-Aldrich公司;Transwell板购自美国Corning公司;胎牛血清(fetal bovine serum, FBS)购自Gibco公司;Lipofectamine 2000转染试剂、RNA提取试剂Trizol、real-time PCR试剂盒、反转录试剂盒(RT-PCR)购自美国Invitrogen公司;Annexin V-FITC流式法细胞凋亡检测试剂盒购自美国BD公司;miR-431-5p模拟物(mimics)及模拟对照序列(miR-NC)、miR-431-5p抑制剂(anti-miR-431-5p)及阴性对照序列(anti-miR-NC)、AKT1过表达载体(pcDNA3.1-AKT1)及空载体(pcDNA3.1)购自上海吉玛制药技术有限公司;双荧光素酶活性检测试剂盒购自美国Promega公司;显微镜、酶标仪、发光仪及Real-time PCR仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
-
PANC-1、CFPAC-1和hTERT-HPNE细胞均用含10% FBS、1%青霉素-链霉素的DMEM高糖培养基培养。培养箱环境:温度37 ℃、CO2体积分数5%、湿度95%。待细胞生长密度至80%左右时,Trypsin消化,进行传代培养。
-
对数生长期的CFPAC-1细胞,以每孔2×105个细胞接种于6孔板中。待细胞生长密度至60%时,更换为不含FBS的DMEM高糖培养基。参照Lipofectamine 2000试剂盒说明书,分别将miR-NC(miR-NC组)、miR-431-5p mimics(miR-431-5p组)、anti-miR-NC(anti-miR-NC组)、anti-miR-431-5p(anti-miR-431-5p组)、miR-431-5p mimics与pcDNA3.1(miR-431-5p +pcDNA3.1组)、miR-431-5p mimics与pcDNA3.1-AKT1(miR-431-5p+pcDNA3.1-AKT1组)转染至CFPAC-1细胞。转染6 h后,弃培养液,换成含10% FBS DMEM高糖培养基。继续培养至48 h,收集细胞用于后续实验。
-
收集各组CFPAC-1细胞,用Trizol试剂提取细胞总RNA,然后根据反转录试剂盒说明书合成cDNA,反应程序为:50 ℃ 10 min;37 ℃ 50 min;72 ℃ 10 min。测定浓度和纯度,-80 ℃保存。取cDNA为模板,按照real-time PCR试剂盒的说明书进行反应,反应程序为:94 ℃ 4 min;90 ℃ 30 s、60 ℃ 30 s、72 ℃ 45 s,40个循环;72 ℃ 5 min。引物如下:miR-431-5p上游5′-ACG CGT GTC TTG CAG GCC GT-3′,下游5′-ATC CAG TGC AGG GTC CGA GG-3′;AKT1上游5′-TCT ATG GCG CTG AGA TTG TG-3′,下游5′-CTT AAT GTG CCC GTC CTT GT-3′。运用Bio-Rad PCR系统进行数据分析。
-
miR-NC组、miR-431-5p组、miR-431-5p +pcDNA3.1组和miR-431-5p+pcDNA3.1-AKT1组细胞,以每孔2×103个细胞接种于96孔板中。分别培养24 h、48 h和72 h后,每孔加入20 μL MTT溶液(5 mg/mL)。培养箱中继续培养4 h后,弃上清液,加入150 μL DMSO,室温振荡5 min,酶标仪测定490 nm吸光度(OD)值。
-
miR-NC组、miR-431-5p组、miR-431-5p +pcDNA3.1组和miR-431-5p+pcDNA3.1-AKT1组细胞,以每孔1×104个接种于6孔板中。培养48 h后,Trypsin消化,收集细胞。按照Annexin V-FITC凋亡试剂盒说明书,加入5 μL Annexin V-FITC,混匀后室温孵育10 min。加入5 μL碘化丙啶,混匀后室温孵育10 min,上流式细胞仪检测。
-
miR-NC组、miR-431-5p组、miR-431-5p +pcDNA3.1组和miR-431-5p+pcDNA3.1-AKT1组细胞用不含FBS的DMEM高糖培养基稀释为每毫升2×105个。迁移实验:Transwell小室置于24孔板中,上室加入100 μL稀释后的各组细胞悬液,下室加入500 μL含10% FBS的DMEM高糖培养基。培养48 h后,吸弃培养基。取出小室,棉签拭去上层小室的细胞,4 %甲醇固定细胞30 min,0.4 %结晶紫染色15 min。显微镜观察,随机选取5个视野,计数迁移细胞。侵袭实验:Matrigel基质胶4 ℃融化后,无血清DMEM高糖培养基1∶8比例稀释,然后铺于Transwell小室上层。自然晾干后,加入100 μL稀释后的各组细胞悬液,下室加入500 μL含10% FBS的DMEM高糖培养基。后续操作与迁移实验相同。
-
miR-NC组、miR-431-5p组、miR-431-5p+pcDNA3.1组和miR-431-5p+pcDNA3.1-AKT1组细胞,以每孔1×104个接种于6孔板中。培养48 h后,Trypsin消化,收集细胞。加入RIPA细胞裂解液,提取细胞中总蛋白,BCA法测定蛋白浓度。取适量蛋白溶液,100 ℃煮沸5 min。蛋白变性后,每孔25 μg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳后,电转移至聚偏乙烯二氟(PVDF)膜,于5%脱脂奶粉中封闭2 h。分别置于Cyclin D1、p21、Bax、Bcl-2、E-cadherin、MMP-2和AKT1一抗孵育液中,4 ℃孵育过夜。TBST洗膜后,置于辣根过氧化酶标记的二抗孵育液中,37 ℃孵育1 h。TBST洗膜,加入ELC显影液,避光显影,凝胶成像系统曝光拍照。
-
PCR扩增含miR-431-5p结合位点的AKT1的基因序列,分别构建的AKT1的野生型(WT-AKT1)和突变型(MUT-AKT1)双荧光素酶报告载体,由上海吉玛制药技术有限公司完成。CFPAC-1细胞以2×105个接种于6孔板中,待细胞生长密度至60%时,更换为不含FBS的DMEM高糖培养基。参照Lipofectamine 2000试剂盒说明书,分别将WT-AKT1、MUT-AKT1与miR-431-5p mimics或miR-NC共转染至CFPAC-1细胞。转染6 h后,更换含10% FBS的DMEM高糖培养基。继续培养至48 h,收集细胞,加入RIPA细胞裂解液充分裂解细胞,收集上清液。参照双荧光素酶活性检测试剂盒操作说明,检测荧光素酶活性。
-
采用独立样本t检验、单因素方差分析和q检验。
-
qRT-PCR结果表明,与hTERT-HPNE细胞相比,胰腺癌细胞PANC-1和CFPAC-1组的miR-431-5p表达量降低,且CFPAC-1细胞miR-431-5p表达量低于PANC-1组,差异均有统计学意义(P < 0.05)(见表 1),因此,选用胰腺癌细胞株CFPAC-1进行后续实验。
分组 n miR-431-5p hTERT-HPNE 9 1.10±0.08 PANC-1 9 0.89±0.06* CFPAC-1 9 0.43±0.03*△ F — 96.96 P — < 0.01 MS组内 — 0.352 q检验:与hTERT-HPNE细胞组比较*P < 0.05;与PANC-1细胞组比较△P < 0.05 表 1 miR-431-5p在PANC-1、CFPAC-1和hTERT-HPNE细胞中的表达(x±s)
-
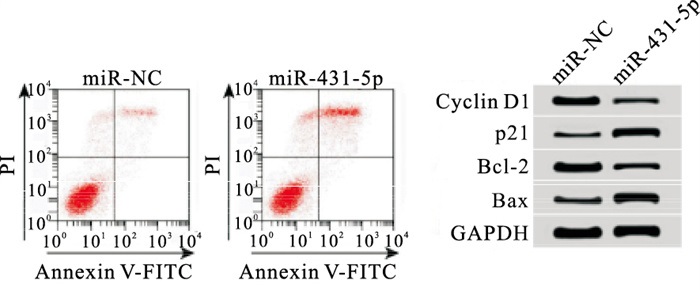
qRT-PCR结果表明,与miR-NC组相比,miR-431-5p组细胞中miR-431-5p表达量上升(P < 0.01),表明miR-431-5p mimics转染成功,细胞中miR-431-5p过表达。MTT、流式细胞术结果显示,与miR-NC组相比,miR-431-5p组细胞活性在48 h、72 h均下降,细胞凋亡率上升,Cyclin D1和Bcl-2蛋白表达下调,p21和Bax蛋白表达上调,差异均有统计学意义(P < 0.01)(见图 1、表 2)。
分组 n miR-431-5p OD值 凋亡率/% Cyclin D1 p21 Bcl-2 Bax 24 h 48 h 72 h miR-NC 3 0.31±0.03 0.38±0.03 0.83±0.05 1.53±0.06 8.24±0.57 0.69±0.03 0.16±0.01 0.84±0.02 0.24±0.03 miR-431-5p 3 0.76±0.05 0.36±0.03 0.44±0.04 0.61±0.05 26.67±1.58 0.21±0.02 0.59±0.02 0.28±0.02 0.79±0.02 t — 13.37 0.82 10.55 20.40 19.01 23.06 33.31 34.29 26.42 P — < 0.01 >0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 表 2 过表达miR-431-5p对细胞CFPAC-1增殖、凋亡的影响(x±s)
-
Transwell结果显示,与miR-NC组相比,miR-431-5p组细胞迁移细胞数和侵袭细胞数均下降,E-cadherin蛋白表达上升,N-cadherin蛋白表达下降,差异均有统计学意义(P < 0.01)(见表 3、图 2)。
分组 n 细胞数 E-cadherin N-cadherin 迁移 侵袭 miR-NC 3 97.00±2.94 78.67±2.05 0.28±0.02 0.69±0.01 miR-431-5p 3 38.00±1.63 25.67±2.49 0.85±0.01 0.20±0.03 t — 30.40 28.46 44.15 26.84 P — < 0.01 < 0.01 < 0.01 < 0.01 表 3 过表达miR-431-5p对细胞CFPAC-1迁移、侵袭的影响(x±s)
-
Targetscan软件预测结果显示,AKT1的3′UTR含有与miR-431-5p互补的核苷酸序列(见图 3)。双荧光素酶报告系统结果所示,与共转染WT-AKT1的miR-NC组相比,共转染WT-AKT1的miR-431-5p组荧光素酶相对活性下降(P < 0.01)(见表 4);与共转染MUT-AKT1的miR-NC组相比,共转染MUT-AKT1的miR-431-5p组荧光素酶相对活性差异无统计学意义(P>0.05);Western blotting结果表明,与miR-NC组相比,miR-431-5p组的AKT1蛋白表达量下降(P < 0.05);与anti-miR-NC组相比,anti-miR-431-5p组的AKT1蛋白表达量上升(P < 0.05)(见表 5和图 4)。
分组 n WT-AKT1 MUT-AKT1 miR-NC 3 1.10±0.03 1.12±0.02 miR-431-5p 3 0.37±0.04 1.08±0.03 t — 25.29 1.92 P — < 0.01 >0.05 表 4 双荧光素酶报告实验
分组 n AKT1 miR-NC 9 0.86±0.06 miR-431-5p 9 0.31±0.02* anti-miR-NC 9 0.88±0.06 anti-miR-431-5p 9 1.25±0.08△ F — 128.60 P — < 0.01 MS组内 — 0.450 q检验:与miR-NC组比较*P < 0.05;与anti-miR-NC组比较△P < 0.05 表 5 miR-431-5p调控AKT1蛋白的表达
-
MTT、流式细胞术、Western blotting结果显示,与miR-431-5p+pcDNA3.1组相比,miR-431-5p+pcDNA3.1-AKT1组细胞增殖活性上升,细胞凋亡率下降,AKT1、Cyclin D1和Bcl-2蛋白表达上升,p21和Bax蛋白表达下调,差异均有统计学意义(P < 0.05)(见图 5、表 6)。
分组 n OD值 凋亡率/% AKT1 Cyclin D1 p21 Bcl-2 Bax 24 h 48 h 72 h miR-NC 9 0.38±0.03 0.83±0.05 1.53±0.06 8.24±0.57 0.84±0.02 0.69±0.03 0.16±0.01 0.84±0.02 0.24±0.03 miR-431-5p 9 0.36±0.03 0.44±0.04* 0.61±0.05* 26.67±1.28* 0.33±0.03* 0.21±0.02* 0.59±0.02* 0.28±0.02* 0.79±0.02* miR-431-5p+pcDNA3.1 9 0.36±0.03 0.46±0.04 0.63±0.05 26.26±1.18 0.33±0.03 0.22±0.02 0.59±0.02 0.30±0.03 0.80±0.03 miR-431-5p+pcDNA3.1-AKT1 9 0.37±0.03 0.68±0.06△ 1.16±0.06△ 16.38±0.86△ 0.59±0.02△ 0.47±0.01△ 0.34±0.02△ 0.58±0.02△ 0.54±0.02△ F — 0.31 44.94 194.84 228.14 276.16 349.94 405.54 400.76 321.65 P — >0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.000 0.209 0.594 233.578 0.180 0.158 0.209 0.210 0.209 q检验:与miR-NC组比较*P < 0.05;与miR-431-5p+pcDNA3.1组比较△P < 0.05 表 6 过表达AKT1逆转miR-431-5p对细胞CFPAC-1增殖、凋亡的作用
-
Transwell、Western blotting结果显示,与miR-431-5p+pcDNA3.1组相比,miR-431-5p+pcDNA3.1-AKT1组的CFPAC-1迁移细胞数和侵袭细胞数均上升,E-cadherin蛋白表达量下降,N-cadherin蛋白表达量上升,差异均有统计学意义(P < 0.05)(见表 7、图 6)。
分组 n 细胞数 E-cadherin N-cadherin 迁移 侵袭 miR-NC 9 97.00±2.94 78.67±2.05 0.28±0.02 0.69±0.01 miR-431-5p 9 38.00±1.63* 25.67±2.49* 0.83±0.02* 0.20±0.03* miR-431-5p+pcDNA3.1 9 37.00±0.82 26.33±3.68 0.82±0.02 0.21±0.03 miR-431-5p+pcDNA3.1-AKT1 9 58.67±2.05△ 42.67±2.87△ 0.54±0.03△ 0.41±0.03△ F — 577.77 229.97 392.52 226.11 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 2 362.007 1 850.227 0.206 0.158 q检验:与miR-NC组比较*P < 0.05;与miR-431-5p+pcDNA3.1组比较△P < 0.05 表 7 过表达AKT1能逆转miR-431-5p对细胞CFPAC-1迁移、侵袭的作用(x±s)
-
miRNA是一类小分子非编码RNA,参与调控肿瘤细胞的增殖、迁移和侵袭等恶性生物学行为,是肿瘤治疗的潜在分子靶点[8-10]。KONG等[11]研究发现,miR-431-5p在肝癌组织和细胞系中表达下调,过表达miR-431-5p可通过靶向UROC28影响EMT过程,抑制肝癌细胞增殖和侵袭。但也有报道[12]称,过表达miR-431-5p靶向下调Smad4促进肺癌细胞增殖,并抑制肺癌细胞凋亡,发挥促癌基因作用。目前,miR-431-5p对胰腺癌细胞恶性生物学行为的影响还未明确。
本研究发现,miR-431-5p在胰腺癌细胞中表达量显著降低,过表达miR-431-5p可抑制胰腺癌细胞增殖、迁移和侵袭,并促进细胞凋亡,提示miR-431-5p在胰腺癌中发挥抗癌基因作用,是胰腺癌治疗的潜在分子靶点。为了进一步探讨miR-431-5p影响胰腺癌细胞增殖、凋亡、迁移和侵袭的作用机制,本研究通过生物信息学软件预测显示,AKT1可能是miR-431-5p生物靶基因。通过双荧光素酶报告基因实验显示,miR-431-5p可与AKT1的3′UTR靶向结合。此外,过表达CFPAC-1细胞中miR-431-5p表达后,AKT1蛋白表达降低;而沉默miR-431-5p表达后,AKT1蛋白表达升高。这些结果证实了miR-431-5p靶向负调控AKT1表达。
AKT1在多种肿瘤组织中表达异常,与肿瘤增殖、进展和放化疗耐受有关[13-15]。研究[16]显示,薯蓣皂苷通过上调miR-149-3p表达进而靶向抑制AKT1表达,降低了胰腺癌细胞的增殖能力,并促进细胞凋亡。非小细胞肺癌组织中miR-512-3p表达降低,其通过靶向上调AKT1促进非小细胞肺癌细胞增殖[17]。本研究发现,过表达AKT1可逆转上调miR-431-5p对胰腺癌CFPAC-1细胞增殖、凋亡、迁移和侵袭的作用,提示过表达miR-431-5p通过靶向下调AKT1抑制胰腺癌细胞增殖、迁移和侵袭,并诱导细胞凋亡。
综上所述,miR-431-5p在胰腺癌细胞中呈低表达,过表达miR-431-5p可抑制胰腺癌细胞增殖、迁移和侵袭,并促进细胞凋亡,其可能通过靶向抑制AKT1发挥作用,miR-431-5p/AKT1轴为胰腺癌的分子靶向治疗提供了新的方向。
miR-431-5p通过调控AKT1抑制胰腺癌细胞增殖、迁移、侵袭和促进凋亡研究
Study on the miR-431-5p inhibiting the proliferation, migration, invasion and promoting the apoptosis of pancreatic cancer cells by regulating AKT1
-
摘要:
目的研究miR-431-5p对胰腺癌细胞增殖、迁移、侵袭和凋亡的影响和潜在的分子机制。 方法qRT-PCR检测人正常胰腺上皮细胞hTERT-HPNE和胰腺癌细胞CFPAC-1和PANC-1中miR-431-5p表达水平。转染miR-431-5p模拟物至胰腺癌CFPAC-1细胞中过表达miR-431-5p后,MTT法测定细胞增殖活性,Transwell检测细胞迁移和侵袭,流式细胞术检测细胞凋亡,Western blotting检测细胞中Cyclin D1、p21、Bax、Bcl-2、E-cadherin、MMP-2和丝氨酸/苏氨酸蛋白激酶1(AKT1)蛋白表达。双荧光素酶报告基因实验验证miR-431-5p与AKT1的调控关系。 结果与hTERT-HPNE细胞相比,胰腺癌细胞PANC-1和CFPAC-1中miR-431-5p表达量降低(P < 0.05)。过表达miR-431-5p后,CFPAC-1细胞活性、迁移和侵袭细胞数降低,凋亡率升高,Cyclin D1、Bcl-2和MMP-2蛋白表达水平降低,p21、Bax和E-cadherin蛋白表达水平升高,差异均有统计学意义(P < 0.05~P < 0.01)。双荧光素酶报告基因实验结果显示,miR-431-5p在CFPAC-1细胞中靶向负调控AKT1表达。同时过表达miR-431-5p和AKT1后,CFPAC-1细胞活性、迁移和侵袭细胞数升高,凋亡率降低,Cyclin D1、Bcl-2和MMP-2蛋白表达水平升高,p21、Bax和E-cadherin蛋白表达水平降低,差异均有统计学意义(P < 0.05)。 结论miR-431-5p通过靶向抑制AKT1降低胰腺癌CFPAC-1细胞的增殖、迁移和侵袭能力,并促进细胞凋亡,可能是胰腺癌的潜在分子治疗靶点。 -
关键词:
- 胰腺肿瘤 /
- miR-431-5p /
- 丝氨酸/苏氨酸蛋白激酶1
Abstract:ObjectiveTo investigate the effects of miR-431-5p on the proliferation, migration, invasion and apoptosis of pancreatic cancer cells, and its underlying mechanism. MethodsThe qRT-PCR was used to detect the expression levels of miR-431-5p in human normal pancreatic epithelial cells hTERT-HPNE and pancreatic cancer cells CFPAC-1 and PANC-1. After the miR-431-5p mimics were transfected into the pancreatic cancer CFPAC-1 cells to overexpress miR-431-5p, the MTT assay was used to detect the cell proliferation activity, the Transwell assay was used to detect the cell migration and invasion, the flow cytometry was used to detect the apoptosis, and the Western blotting was used to detect the expression levels of Cyclin D1, p21, Bax, Bcl-2, E-cadherin, MMP-2 and AKT1 proteins. The regulatory relationship between miR-431-5p and AKT1 was investigated using the dual luciferase reporter gene experiment. ResultsCompared with hTERT-HPNE cells, the expression levels of miR-431-5p in pancreatic cancer cell PANC-1 and CFPAC-1 significantly decreased(P < 0.05). After the miR-431-5p in CFPAC-1 cells was overexpressed, the cells activity and number of migrating and invading cells decreased(P < 0.05), the apoptosis rate increased(P < 0.05), the expression levels of Cyclin D1, Bcl-2 and MMP-2 protein decreased(P < 0.05), and the expression levels of p21, Bax and E-cadherin protein increased(P < 0.05 to P < 0.01). The results of the dual luciferase reporter gene experiment showed that the miR-431-5p negatively regulated the AKT1 expression in CFPAC-1 cells. After the miR-431-5p and AKT1 in CFPAC-1 cells were overexpressed, the CFPAC-1 cell activity, the number of migrating and invading cells increased, the apoptosis rate decreased, the protein expression levels of Cyclin D1, Bcl-2 and MMP-2 increased, while the protein expression levels of p21, Bax and E-cadherin decreased, and the differences of which were statistically significant(P < 0.05). ConclusionsThe miR-431-5p can inhibit the proliferation, migration and invasion of pancreatic cancer CFPAC-1 cells, and promote apoptosis by targeting AKT1. It may be a potential molecular therapeutic target for pancreatic cancer. -
Key words:
- pancreatic neoplasms /
- miR-431-5p /
- AKT1
-
表 1 miR-431-5p在PANC-1、CFPAC-1和hTERT-HPNE细胞中的表达(x±s)
分组 n miR-431-5p hTERT-HPNE 9 1.10±0.08 PANC-1 9 0.89±0.06* CFPAC-1 9 0.43±0.03*△ F — 96.96 P — < 0.01 MS组内 — 0.352 q检验:与hTERT-HPNE细胞组比较*P < 0.05;与PANC-1细胞组比较△P < 0.05 表 2 过表达miR-431-5p对细胞CFPAC-1增殖、凋亡的影响(x±s)
分组 n miR-431-5p OD值 凋亡率/% Cyclin D1 p21 Bcl-2 Bax 24 h 48 h 72 h miR-NC 3 0.31±0.03 0.38±0.03 0.83±0.05 1.53±0.06 8.24±0.57 0.69±0.03 0.16±0.01 0.84±0.02 0.24±0.03 miR-431-5p 3 0.76±0.05 0.36±0.03 0.44±0.04 0.61±0.05 26.67±1.58 0.21±0.02 0.59±0.02 0.28±0.02 0.79±0.02 t — 13.37 0.82 10.55 20.40 19.01 23.06 33.31 34.29 26.42 P — < 0.01 >0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 表 3 过表达miR-431-5p对细胞CFPAC-1迁移、侵袭的影响(x±s)
分组 n 细胞数 E-cadherin N-cadherin 迁移 侵袭 miR-NC 3 97.00±2.94 78.67±2.05 0.28±0.02 0.69±0.01 miR-431-5p 3 38.00±1.63 25.67±2.49 0.85±0.01 0.20±0.03 t — 30.40 28.46 44.15 26.84 P — < 0.01 < 0.01 < 0.01 < 0.01 表 4 双荧光素酶报告实验
分组 n WT-AKT1 MUT-AKT1 miR-NC 3 1.10±0.03 1.12±0.02 miR-431-5p 3 0.37±0.04 1.08±0.03 t — 25.29 1.92 P — < 0.01 >0.05 表 5 miR-431-5p调控AKT1蛋白的表达
分组 n AKT1 miR-NC 9 0.86±0.06 miR-431-5p 9 0.31±0.02* anti-miR-NC 9 0.88±0.06 anti-miR-431-5p 9 1.25±0.08△ F — 128.60 P — < 0.01 MS组内 — 0.450 q检验:与miR-NC组比较*P < 0.05;与anti-miR-NC组比较△P < 0.05 表 6 过表达AKT1逆转miR-431-5p对细胞CFPAC-1增殖、凋亡的作用
分组 n OD值 凋亡率/% AKT1 Cyclin D1 p21 Bcl-2 Bax 24 h 48 h 72 h miR-NC 9 0.38±0.03 0.83±0.05 1.53±0.06 8.24±0.57 0.84±0.02 0.69±0.03 0.16±0.01 0.84±0.02 0.24±0.03 miR-431-5p 9 0.36±0.03 0.44±0.04* 0.61±0.05* 26.67±1.28* 0.33±0.03* 0.21±0.02* 0.59±0.02* 0.28±0.02* 0.79±0.02* miR-431-5p+pcDNA3.1 9 0.36±0.03 0.46±0.04 0.63±0.05 26.26±1.18 0.33±0.03 0.22±0.02 0.59±0.02 0.30±0.03 0.80±0.03 miR-431-5p+pcDNA3.1-AKT1 9 0.37±0.03 0.68±0.06△ 1.16±0.06△ 16.38±0.86△ 0.59±0.02△ 0.47±0.01△ 0.34±0.02△ 0.58±0.02△ 0.54±0.02△ F — 0.31 44.94 194.84 228.14 276.16 349.94 405.54 400.76 321.65 P — >0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 0.000 0.209 0.594 233.578 0.180 0.158 0.209 0.210 0.209 q检验:与miR-NC组比较*P < 0.05;与miR-431-5p+pcDNA3.1组比较△P < 0.05 表 7 过表达AKT1能逆转miR-431-5p对细胞CFPAC-1迁移、侵袭的作用(x±s)
分组 n 细胞数 E-cadherin N-cadherin 迁移 侵袭 miR-NC 9 97.00±2.94 78.67±2.05 0.28±0.02 0.69±0.01 miR-431-5p 9 38.00±1.63* 25.67±2.49* 0.83±0.02* 0.20±0.03* miR-431-5p+pcDNA3.1 9 37.00±0.82 26.33±3.68 0.82±0.02 0.21±0.03 miR-431-5p+pcDNA3.1-AKT1 9 58.67±2.05△ 42.67±2.87△ 0.54±0.03△ 0.41±0.03△ F — 577.77 229.97 392.52 226.11 P — < 0.01 < 0.01 < 0.01 < 0.01 MS组内 — 2 362.007 1 850.227 0.206 0.158 q检验:与miR-NC组比较*P < 0.05;与miR-431-5p+pcDNA3.1组比较△P < 0.05 -
[1] WANG HW, JIAO HM, JIANG ZR, et al. Propofol inhibits migration and induces apoptosis of pancreatic cancer PANC-1 cells through miR-34a-mediated E-cadherin and LOC285194 signals[J]. Bioengineered, 2020, 11(1): 510. doi: 10.1080/21655979.2020.1754038 [2] VON HOFF DD, ERVIN T, ARENA FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J]. N Engl J Med, 2013, 369(18): 1691. doi: 10.1056/NEJMoa1304369 [3] ABREU FB, LIU XY, TSONGALIS GJ. miRNA analysis in pancreatic cancer: the Dartmouth experience[J]. Clin Chem Lab Med, 2017, 55(5): 755. [4] JIANG Q, CHENG L, MA DY, et al. FBXL19-AS1 exerts oncogenic function by sponging miR-431-5p to regulate RAF1 expression in lung cancer[J]. Biosci Rep, 2019, 39(1): 1. [5] SU WB, LIU ZY. MiR-431 inhibits colorectal cancer cell invasion via repressing CUL4B[J]. Eur Rev Med Pharmacol Sci, 2018, 22(10): 3047. [6] LIU Y, LI L, LIU Z, et al. Downregulation of MiR-431 expression associated with lymph node metastasis and promotes cell invasion in papillary thyroid carcinoma[J]. Cancer Biomark, 2018, 22(4): 727. doi: 10.3233/CBM-181253 [7] XU RL, HE W, TANG J, et al. Primate-specific miRNA-637 inhibited tumorigenesis in human pancreatic ductal adenocarcinoma cells by suppressing Akt1 expression[J]. Exp Cell Res, 2018, 363(2): 310. doi: 10.1016/j.yexcr.2018.01.026 [8] WU XF. Expressions of miR-21 and miR-210 in breast cancer and their predictive values for prognosis[J]. Iran J Public Health, 2020, 49(1): 21. [9] CHEN YS, LU Y, REN YL, et al. Starvation-induced suppression of DAZAP1 by miR-10b integrates splicing control into TSC2-regulated oncogenic autophagy in esophageal squamous cell carcinoma[J]. Theranostics, 2020, 10(11): 4983. doi: 10.7150/thno.43046 [10] LI J, LIN TY, CHEN L, et al. miR-19 regulates the expression of interferon-induced genes and MHC class Ⅰ genes in human cancer cells[J]. Int J Med Sci, 2020, 17(7): 953. doi: 10.7150/ijms.44377 [11] KONG Q, HAN J, DENG H, et al. miR-431-5p alters the epithelial-to-mesenchymal transition markers by targeting UROC28 in hepatoma cells[J]. Onco Targets Ther, 2018, 11(3): 6489. [12] LI S, SUN Z, CHEN T, et al. The role of miR-431-5p in regulating pulmonary surfactant expression in vitro[J]. Cell Mol Biol Lett, 2019, 24(2): 25. [13] DU YM, WANG YB. MiR-637 inhibits proliferation and invasion of hepatoma cells by targeted degradation of AKT1[J]. Eur Rev Med Pharmacol Sci, 2019, 23(2): 567. [14] YAO J, ZHANG P, LI J, et al. MicroRNA-215 acts as a tumor suppressor in breast cancer by targeting AKT serine/threonine kinase 1[J]. Oncol Lett, 2017, 14(1): 1097. doi: 10.3892/ol.2017.6200 [15] WANG C, LIU H, QIU Q, et al. TCRP1 promotes NIH/3T3 cell transformation by over-activating PDK1 and AKT1[J]. Oncogenesis, 2017, 6(4): e323. doi: 10.1038/oncsis.2017.18 [16] SI L, XU L, YIN L, et al. Potent effects of dioscin against pancreatic cancer via miR-149-3P-mediated inhibition of the Akt1 signalling pathway[J]. Br J Pharmacol, 2017, 174(7): 553. doi: 10.1111/bph.13718 [17] ZHANG G, CHEN HX, YANG SN, et al. MAGI1-IT1 stimulates proliferation in non-small cell lung cancer by upregulating AKT1 as a ceRNA[J]. Eur Rev Med Pharmacol Sci, 2020, 24(2): 691. -





 下载:
下载: