-
去势治疗是晚期前列腺癌首要的治疗手段[1],几乎所有的病人都会进展为去势抵抗前列腺癌(mCRPC)[2-3],预后较差。作为CYP17A1抑制剂的醋酸阿比特龙(AA)[4],能够有效地阻断mCRPC病人肾上腺来源雄激素的合成,与小剂量泼尼松联用,可以明显延长病人的生存期,已成为mCRPC病人一线治疗方案[5]。mCRPC病人具有明显的个体差异性,不同病人对初始治疗反应和预后有明显的差异,如何精准判断病人对初始治疗反应和预后,对减少病人医疗费用和改善预后意义重大[6-8]。因为mCRPC病人在治疗期间可能出现前列腺特异性抗原(PSA)的闪烁现象(PSA Flare),所以临床上仅通过血清PSA水平来评估对AA治疗的初始疗效并不可靠[9]。文献[10]报道,有些生物标志物可以预测mCRPC病人的预后,但因高成本的分析和缺乏充分的循证学依据,很难在临床开展应用。
大量文献[11-16]证实许多实体肿瘤的预后与机体自身的炎症及营养状况有密切关系。其中预后营养指数(PNI)、中性粒细胞/淋巴细胞比(NLR)成为肿瘤独立的预后因素,广泛应用于评估肿瘤病人的营养及炎症综合状况[17-19]。综合临床治疗实践经验和相关文献报道,本课题组推测在AA治疗的mCRPC病人中,PNI、NLR不仅可用作预后预测因素,而且还可作为评价早期治疗反应的影响因素。现作报道。
-
mCRPC定义[20]:持续性雄激素剥夺治疗后疾病仍进展的前列腺癌。诊断标准:去势治疗后血清睾酮水平 < 1.7 nmol/L;测量PSA间隔1周或以上连续3次测量PSA上升,连续2次较最低值升高50%以上,且PSA水平>2.0 μg/L;或通过影像学骨扫描发现2个及以上的新病灶或符合实体瘤反应评价标准的软组织病灶增大。纳入标准:符合mCRPC诊断标准;年龄50岁及以上;TNM分期为Ⅳ期;随访调查资料完整。经医院医学伦理委员会审核通过,病人签署知情同意书。排除标准:长期免疫抑制剂治疗者;近期合并细菌或病毒感染者;脾切术者;器官移植术后者;存在免疫系统慢性基础疾病者;垂体或肾上腺皮质功能减退者;有肝病史或血清转氨酶浓度异常者;近期服用引起中性粒细胞、淋巴细胞数量改变的疾病或药物的病人;患可能引起白蛋白数值改变疾病的病人;不能按照医嘱服药者;治疗中途退出者。选择2017年12月至2021年10月我集团医院接受AA治疗的40例符合以上标准的mCRPC病人作为研究对象,年龄52~92岁。
-
符合标准的病人采用醋酸阿比特龙1 000 mg空腹口服(泽珂,西安杨森)每日1次,泼尼松5 mg每日2次口服。连续用药12周以上。
-
收集病人的年龄、血清PSA水平、体质量指数(BMI)、穿刺活检Gleason评分、骨转移个数等临床资料;AA治疗前及治疗后1个月空腹抽取病人外周血,检测血常规和血清白蛋白水平,计算PNI和NLR。
研究终点指标:总生存期(OS)、PSA无进展生存期(PSA-PFS)和影像学无进展生存期(rPFS)。根据前列腺癌临床试验工作组2(PCWG2)标准,判断PSA有无进展[21]。判断影像学有无进展是基于实体瘤的反应评估标准,或骨扫描显示2个及以上的新发骨病灶,或死亡。
-
PNI=血清白蛋白水平+5×外周血淋巴细胞计数;NLR=外周血中性粒细胞计数/外周血淋巴细胞计数;PSA Flare现象:治疗后PSA血清值初始升高,随后下降至基线水平以下的一种现象[22];初始有效:AA治疗期间血清PSA水平降至治疗前的50%及以下;OS:是指开始治疗至因病死亡日期或者至随访结束;PFS:是指病人开始治疗至任何有记录的肿瘤进展或任何原因的死亡的间隔时间。
-
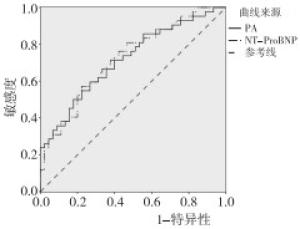
以AA治疗初始有效作为终点,ROC曲线分析结果:当PNI为48.30时曲线最佳敏感度为0.857,特异度为0.444,曲线下面积(AUC)为0.717(95%CI:0.610~0.824);当NLR为2.80时曲线最佳敏感度为0.810,特异度为0.533,AUC为0.724(95%CI:0.619~0.830)。因此, 将PNI及NLR的最佳临界值定为48.30和2.80(见图 1)。
-
以AA首次治疗作为观察起点,每1个月检测PSA、肝肾功能等指标,每2个月复查骨扫描、胸腹CT以及转移病灶部位CT或MRI检查。记录病情及死亡等信息。随访截止日期为2022年2月20日。
-
采用t检验、χ2检验、曼-惠特尼U检验、ROC曲线、Log-rank检验、logistic回归分析和Cox回归分析。
-
40例研究对象平均年龄(70.21±8.36)岁,BMI平均值(22.43±5.68)kg/m2,BMI正常组病人占45.00%,AA治疗前的PSA浓度中位数为61.58(27.16,215.34)ng/mL,基线PNI值>48.30有19例(47.50%),基线NLR值< 2.80有28例,Gleason评分≥8分21例,中位OS为19.7(10.1,26.5)个月。2例(5.00%)病人死亡。AA治疗后,31例PSA下降至基线水平的50%以下,初始有效率为77.50%。AA治疗初始效果在中位基线PSA、基线PNI值指标之间差异有统计学意义(P < 0.05)。Log-rank检验提示:AA治疗初始效果在中位PSA-PFS、中位rPFS、中位OS生存期指标之间差异有统计学意义(P < 0.05)(见表 1)。
临床特征 AA治疗初始有效(n=31) AA治疗初始抵抗(n=9) χ2 P 年龄/岁 70.58±8.25 69.36±10.17 0.37△ >0.05 BMI/(kg/m2) 22.03±5.51 23.54±7.14 0.68△ >0.05 < 18.5 4 2 0.81 < 0.05 18.5~24 15 3 >24 12 4 中位基线PSA/(ng/mL) 51.37(20.31,224.05) 81.23(32.54,368.86) 3.39* < 0.05 基线PNI值 ≤48.30 13 8 4.43 < 0.05 >48.30 18 1 基线NLR值 ≤2.80 22 6 0.03 >0.05 >2.80 9 3 Gleason评分/分 < 8 15 4 0.03 >0.05 ≥8 16 5 癌细胞转移类型 骨转移 22 6 0.18 >0.05 非区域淋巴转移 5 2 内脏转移 4 1 骨转移灶个数/个 ≤10 8 4 0.00 >0.05 >10 11 5 中位PSA-PFS/月 11.7(6.8,17.4) 5.6(4.2,11.2) 11.43* < 0.01 中位rPFS/月 12.7(6.2,18.5) 6.8(3.2,20.3) 9.73* < 0.05 中位OS/月 20.8(9.2,23.7) 14.3(8.4,25.5) 5.35* < 0.05 △示t值;*示Z值 表 1 40例mCRPC病人的临床特征及治疗初始效果比较(n)
-
不同等级的BMI在PNI不同水平组之间差异有统计学意义(P < 0.05)。不同等级的Gleason评分在PNI和NLR指标的组间差异均有统计学意义(P < 0.05)(见表 2)。
项目 PNI水平 NLR水平 ≤48.30组(n=21) >48.30组(n=19) χ2 P ≤2.80组(n=28) >2.80组(n=12) χ2 P BMI/(kg/m2) < 18.5 4 2 8.14 < 0.05 3 3 2.20 >0.05 18.5~24 5 13 12 6 >24 12 4 13 3 Gleason评分/分 < 8 6 13 0.35 < 0.05 10 9 5.20 < 0.05 ≥8 15 6 18 3 骨转移 是 16 12 0.81 >0.05 19 9 0.01 >0.05 否 5 7 9 3 PSA/(ng/mL) < 20 4 2 1.63 >0.05 5 1 1.81 >0.05 20~80 10 7 11 6 >80 7 10 9 8 表 2 PNI和NLR不同水平组临床相关指标的比较(n)
-
40例病人AA治疗期间PSA下降达到基线水平50%以上30例,其中10例(25.00%)在AA治疗期间出现PSA Flare现象。结果提示,中位基线PSA水平、低基线PNI值的病人在AA治疗过程中发生PSA Flare现象的可能性较大(P < 0.05);病人是否发生PSA Flare现象可能与年龄、BMI、基线NLR值无关(P>0.05)。经Log-rank检验后提示,治疗期间发生与不发生PSAFlare病人的中位PSA-PFS、中位rPFS和中位OS差异无统计学意义(P>0.05)(见表 3)。
项目 PSA Flare Z P 有(n=10) 无(n=30) 年龄/岁 71.34±10.22 69.46±9.59 0.53* >0.05 BMI/(kg/m2) 20.63±5.62 22.51±7.43 0.73* >0.05 中位基线PSA/(ng/mL) 99.54(35.56,273.36) 61.32(23.19,224.28) 3.36 < 0.05 基线PNI值 ≤48.30 9 12 5.23# < 0.05 >48.30 2 17 基线NLR值 ≤2.80 9 19 1.43# >0.05 >2.80 1 11 中位PSA-PFS/月 11.2(7.8,25.7) 12.5(6.5,27.2) 2.72 >0.05 中位rPFS/月 11.6(6.6,21.4) 13.3(7.3,26.7) 2.74 >0.05 中位OS/月 20.5(11.3,27.5) 21.4(12.5,26.5) 2.13 >0.05 *示t值;#示χ2值 表 3 有无PSA Flare病人的临床项目指标比较
-
以AA治疗初始疗效(有效=0、抵抗=1)为因变量,年龄、BMI、基线PSA值、基线PNI值(>48.3=0、≤48.3=1)、基线NLR值(≤2.8=0、>2.8=1)、Gleason评分(< 8=0、≥8=1)、骨转移(否=0、是=1)和骨转移灶个数为协变量,先行单因素logistic回归分析,再作多因素logistic回归分析(Enter法),结果显示, 基线PSA值、基线PNI值和基线NLR值可能是AA治疗初始疗效的影响因子(见表 4)。
影响因子 单因素分析 多因素分析 OR(95%CI) P OR(95%CI) P 年龄 1.097(0.896~1.208) >0.05 1.012(0.965~1.092) >0.05 BMI 0.921(0.736~1.231) >0.05 1.028(0.846~1.224) >0.05 基线PSA值 0.856(0.665~0.986) < 0.05 0.901(0.755~0.976) < 0.05 基线PNI值 2.452(1.263~6.401) < 0.01 2.361(1.210~7.536) < 0.01 基线NLR值 2.825(1.568~5.236) < 0.05 1.995(1.326~3.869) < 0.01 Gleason评分 1.303(0.858~3.539) >0.05 1.023(0.910~2.861) >0.05 骨转移 1.224(0.911~2.886) >0.05 1.115(0.854~3.223) >0.05 骨转移灶个数 1.525(0.855~3.442) >0.05 1.443(0.736~4.122) >0.05 表 4 mCRPC病人AA治疗初始疗效的单因素及多因素logistic回归分析
-
以PSA-PFS、rPFS、OS为生存期因变量,年龄、BMI、基线PSA值、基线PNI值(>48.3=0、≤48.3=1)、基线NLR值(≤2.8=0、>2.8=1)、Gleason评分(< 8=0、≥8=1)、骨转移(否=0、是=1)和骨转移灶个数为协变量,作多因素Cox回归分析(逐步法)。结果显示, PSA-PFS的预测因素有基线PSA值、基线PNI值和基线NLR值(P < 0.01);rPFS的预测因素有Gleason评分、基线PNI值和基线NLR值(P < 0.01);OS的预测因素有BMI、Gleason评分、基线PNI值和基线NLR值(P < 0.05~P < 0.01)。基线PNI值和基线NLR值可能是mCRPC病人AA治疗预后的独立预测因素(见表 5)。
影响因子 PSA-PFS rPFS OS HR(95%CI) P HR(95%CI) P HR(95%CI) P BMI — — — — 1.836(1.303~3.146) < 0.05 Gleason评分 — — 2.965(1.265~6.023) < 0.01 2.253(1.134~6.334) < 0.05 基线PSA值 2.533(1.953~5.121) < 0.01 — — — — 基线PNI值 4.668(2.146~9.551) < 0.01 3.628(1.253~8.566) < 0.01 5.016(1.365~12.147) < 0.01 基线NLR值 4.023(2.334~9.269) < 0.01 3.866(1.410~7.668) < 0.01 2.338(1.231~6.553) < 0.01 表 5 mCRPC病人AA治疗生存期的多因素Cox回归分析
-
本研究的40例病人在接受AA治疗前均为晚期的mCRPC病人,治疗后初始有效率77.50%,高于相关研究[23]报道的PSA缓解率68.00%,可能原因是本研究病人样本量少,变异性大,样本来源只局限于一家医院,而不是多中心来源,可能出现选择偏倚引起结果偏高。我们也看到病人基线越好时使用AA,病人的生存获益就越大,但就AA药物最佳介入时机仍值得后续研究。
mCRPC病人疾病进展迅速,这要求临床医师必须快速制定治疗方案,目前临床医师多采用血清PSA来判断对治疗的反应。然而,PSA Flare现象的出现在一定程度上会干扰临床医师的判断。但考虑到治疗初期PSA升高也可能是初始治疗抵抗现象(本研究有9例),故临床上还是要寻找明确区别PSA Flare现象与初始治疗抵抗的方法。
本研究中AA联合泼尼松治疗未经化疗的40例mCRPC病人中,30例治疗期间PSA下降达到基线水平50%以上,其中10例(25.00%)病人出现PSA Flare,低于李俊等[24]研究结果(27.20%)。研究结果提示,mCRPC病人初始血清PNI和NLR水平可能与基线PSA水平无关,初始高基线PSA水平、低基线PNI值的病人在AA治疗过程中发生PSA Flare可能性较大,提示基线PNI与AA治疗中的PSA变化有关,可能的机制有待深入研究。经过生存分析后发现,AA治疗期间有无发生PSA Flare病人的中位PSA-PFS、中位rPFS和中位OS没有差异,也进一步说明在PSA Flare并未影响mCRPC病人的预后,与BURGIO等[25-26]报道基本一致。
OKADA等[27]研究提示肿瘤病人治疗前的营养状况及免疫功能与病情进展和预后关系密切。临床上通过测定血清白蛋白水平来评估病人营养状况,用来反映病人是否伴有营养不良。发挥细胞免疫的淋巴细胞在各类肿瘤中发挥重要作用,由于肿瘤的免疫应答依赖于淋巴细胞功能,因此,外周血低淋巴细胞计数可能预示病人预后较差。PNI是由血清白蛋白水平和外周血淋巴细胞计数比值获得的指标,可以综合反映病人营养状况和免疫功能。PNI用于评估肿瘤病人的预后具有重要临床意义,可作为对多种实体肿瘤预后的独立预测因子,高PNI值可能代表病人有相对较好的营养状态和较强的免疫水平[28]。本研究也证实PNI是接受AA治疗的mCRPC病人预后的独立预测因子,高PNI组病人预后生存明显优于低PNI组。本研究发现正常BMI值病人的比例在PNI值>48.30组中最高。不同等级的BMI在PNI 2组之间差异有统计学意义,提示维持病人的BMI值在正常范围可能有利于病人的PNI提升。国内学者[29]研究发现炎症在肿瘤的发生、发展中起到重要作用,NLR是临床上常用的炎症指标。有研究[30]证实mCRPC病人进展中炎症起重要作用,高NLR值预后低于低NLR值,本研究结果与他们研究一致。
本研究属于病例队列研究,存在一些局限性,首先随访时间短,其次样本量少,在后续的研究中应扩大样本量,延长随访时间,进一步验证现有的研究结果。
综上所述,mCRPC病人治疗方案的选择依据前列腺癌临床实践指南、治疗药物的可获得性和病人对于治疗经费的可接受度。如何精准评价mCRPC病人对AA治疗的初始疗效和预后,在科学研究及临床实践上显得极为重要。本研究发现PNI、NLR可作为对mCRPC病人简便、有效的预测指标,低基线PNI值会增加病人发生PSA Flare现象的风险,低基线PNI值和高基线NLR值可能是AA治疗初始疗效的不利影响因素,基线PNI值和基线NLR值可能是mCRPC病人AA治疗预后的独立预测因素,这必将为mCRPC病人个性化治疗方案选择和改善预后提供帮助。当然,这类新的预测标志物还需要在前列腺癌临床队列中进一步验证。
PNI、NLR在醋酸阿比特龙联合泼尼松治疗转移去势抵抗前列腺癌病人的初始疗效和预后预测中的意义
Significance of PNI and NLR for predicting initial efficacy and prognosis in the metastatic castration-resistant prostate cancer patients treated
-
摘要:
目的探寻基线预后营养指数(PNI)及中性粒细胞/淋巴细胞比(NLR)在醋酸阿比特龙(AA)联合泼尼松治疗转移去势抵抗前列腺癌(mCRPC)病人的初始疗效和预后预测中的意义。 方法采用病例队列研究手段,收集AA联合泼尼松治疗的40例mCRPC病人资料,治疗前及治疗1个月后门诊随访病人,检测血清白蛋白、中性粒细胞计数和外周血淋巴细胞计数等指标,计算PNI和NLR。分析AA治疗初始疗效的影响因素,筛查可能与前列腺特异性抗原(PSA)无进展生存期(PSA-PFS)、影像学无进展生存期(rPFS)和总生存期(OS)相关的预测因素。 结果AA治疗初始效果在中位基线PSA、基线PNI值指标之间差异有统计学意义(P < 0.05)。AA治疗初始效果在中位PSA-PFS、中位rPFS、中位OS生存期指标之间差异有统计学意义(P < 0.05)。不同等级的体质量指数在PNI不同水平组之间差异有统计学意义(P < 0.05)。不同等级的Gleason评分在PNI和NLR指标的组间差异均有统计学意义(P < 0.05)。中位基线PSA水平、低基线PNI值的病人在AA治疗过程中发生PSA闪烁现象的可能性较大(P < 0.05)。基线PSA值、基线PNI值和基线NLR值可能是AA治疗初始疗效的影响因子(P < 0.05~P < 0.01)。 结论PNI和NLR可作为独立指标预测AA治疗mCRPC病人的预后情况,同时它们可能是AA治疗mCRPC病人初始效果的重要影响因子。 -
关键词:
- 前列腺肿瘤 /
- 醋酸阿比特龙 /
- 预后营养指数 /
- 中性粒细胞淋巴细胞比
Abstract:ObjectiveTo explore the significance of prognostic nutritional index(PNI) and neutrophil to lymphocyte ratio(NLR) in the prediction of initial efficacy and prognosis of metastatic castration-resistant prostate cancer(mCRPC) patients treated with abiraterone acetate(AA) and prednisone. MethodsThe data of 40 mCRPC patients treated with AA combined with prednisone were collected using the cohort study method.The patients were followed up in outpatient clinics before and 1 month after treatment.Serum albumin, neutrophil count, and peripheral blood lymphocyte count of patients were detected and the corresponding PNI and NLR were further calculated.The influencing factors of initial efficacy of AA treatment were analyzed, and the factors associated with prostate-specific antigen(PSA), progression-free survival(PSA-PFS), radiological progression-free survival(rPFS), and overall survival(OS) were also screened. ResultsThe initial efficacy of AA treatment was significantly different between the median baseline PSA and baseline PNI values(P < 0.05).The initial efficacy of AA treatment was significantly different among the median PSA-PFS, median rPFS, and median OS survival indicators(P < 0.05).There were significant differences in body mass index of different grades between groups with different levels of PNI(P < 0.05).Gleason scores were significantly different between groups in PNI and NLR indexes(P < 0.05).Patients with median baseline PSA level and low baseline PNI value were more likely to develop PSA flare phenomenon during AA treatment(P < 0.05).Baseline PSA value, baseline PNI value, and baseline NLR value may be the influencing factors of initial efficacy of AA treatment(P < 0.05 to P < 0.01). ConclusionsPNI and NLR can be used as independent indicators to predict the prognosis of mCRPC patients treated with AA.Moreover, they may be important influencing factors of the initial efficacy of AA in mCRPC patients. -
表 1 40例mCRPC病人的临床特征及治疗初始效果比较(n)
临床特征 AA治疗初始有效(n=31) AA治疗初始抵抗(n=9) χ2 P 年龄/岁 70.58±8.25 69.36±10.17 0.37△ >0.05 BMI/(kg/m2) 22.03±5.51 23.54±7.14 0.68△ >0.05 < 18.5 4 2 0.81 < 0.05 18.5~24 15 3 >24 12 4 中位基线PSA/(ng/mL) 51.37(20.31,224.05) 81.23(32.54,368.86) 3.39* < 0.05 基线PNI值 ≤48.30 13 8 4.43 < 0.05 >48.30 18 1 基线NLR值 ≤2.80 22 6 0.03 >0.05 >2.80 9 3 Gleason评分/分 < 8 15 4 0.03 >0.05 ≥8 16 5 癌细胞转移类型 骨转移 22 6 0.18 >0.05 非区域淋巴转移 5 2 内脏转移 4 1 骨转移灶个数/个 ≤10 8 4 0.00 >0.05 >10 11 5 中位PSA-PFS/月 11.7(6.8,17.4) 5.6(4.2,11.2) 11.43* < 0.01 中位rPFS/月 12.7(6.2,18.5) 6.8(3.2,20.3) 9.73* < 0.05 中位OS/月 20.8(9.2,23.7) 14.3(8.4,25.5) 5.35* < 0.05 △示t值;*示Z值 表 2 PNI和NLR不同水平组临床相关指标的比较(n)
项目 PNI水平 NLR水平 ≤48.30组(n=21) >48.30组(n=19) χ2 P ≤2.80组(n=28) >2.80组(n=12) χ2 P BMI/(kg/m2) < 18.5 4 2 8.14 < 0.05 3 3 2.20 >0.05 18.5~24 5 13 12 6 >24 12 4 13 3 Gleason评分/分 < 8 6 13 0.35 < 0.05 10 9 5.20 < 0.05 ≥8 15 6 18 3 骨转移 是 16 12 0.81 >0.05 19 9 0.01 >0.05 否 5 7 9 3 PSA/(ng/mL) < 20 4 2 1.63 >0.05 5 1 1.81 >0.05 20~80 10 7 11 6 >80 7 10 9 8 表 3 有无PSA Flare病人的临床项目指标比较
项目 PSA Flare Z P 有(n=10) 无(n=30) 年龄/岁 71.34±10.22 69.46±9.59 0.53* >0.05 BMI/(kg/m2) 20.63±5.62 22.51±7.43 0.73* >0.05 中位基线PSA/(ng/mL) 99.54(35.56,273.36) 61.32(23.19,224.28) 3.36 < 0.05 基线PNI值 ≤48.30 9 12 5.23# < 0.05 >48.30 2 17 基线NLR值 ≤2.80 9 19 1.43# >0.05 >2.80 1 11 中位PSA-PFS/月 11.2(7.8,25.7) 12.5(6.5,27.2) 2.72 >0.05 中位rPFS/月 11.6(6.6,21.4) 13.3(7.3,26.7) 2.74 >0.05 中位OS/月 20.5(11.3,27.5) 21.4(12.5,26.5) 2.13 >0.05 *示t值;#示χ2值 表 4 mCRPC病人AA治疗初始疗效的单因素及多因素logistic回归分析
影响因子 单因素分析 多因素分析 OR(95%CI) P OR(95%CI) P 年龄 1.097(0.896~1.208) >0.05 1.012(0.965~1.092) >0.05 BMI 0.921(0.736~1.231) >0.05 1.028(0.846~1.224) >0.05 基线PSA值 0.856(0.665~0.986) < 0.05 0.901(0.755~0.976) < 0.05 基线PNI值 2.452(1.263~6.401) < 0.01 2.361(1.210~7.536) < 0.01 基线NLR值 2.825(1.568~5.236) < 0.05 1.995(1.326~3.869) < 0.01 Gleason评分 1.303(0.858~3.539) >0.05 1.023(0.910~2.861) >0.05 骨转移 1.224(0.911~2.886) >0.05 1.115(0.854~3.223) >0.05 骨转移灶个数 1.525(0.855~3.442) >0.05 1.443(0.736~4.122) >0.05 表 5 mCRPC病人AA治疗生存期的多因素Cox回归分析
影响因子 PSA-PFS rPFS OS HR(95%CI) P HR(95%CI) P HR(95%CI) P BMI — — — — 1.836(1.303~3.146) < 0.05 Gleason评分 — — 2.965(1.265~6.023) < 0.01 2.253(1.134~6.334) < 0.05 基线PSA值 2.533(1.953~5.121) < 0.01 — — — — 基线PNI值 4.668(2.146~9.551) < 0.01 3.628(1.253~8.566) < 0.01 5.016(1.365~12.147) < 0.01 基线NLR值 4.023(2.334~9.269) < 0.01 3.866(1.410~7.668) < 0.01 2.338(1.231~6.553) < 0.01 -
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115. doi: 10.3322/caac.21338 [2] 曾浩, 种铁, 贺大林, 等. 去势抵抗型前列腺癌最新指南解读暨中国西部专家共识[J]. 现代泌尿外科杂志, 2017, 20(2): 85. doi: 10.3969/j.issn.1009-8291.2017.02.002 [3] 闫传武, 赵江. 术前外周血血小板/淋巴细胞比值与前列腺癌患者临床病理特征及根治术后生存时间的相关性分析[J]. 国际泌尿系统杂志, 2019, 39(1): 5. doi: 10.3760/cma.j.issn.1673-4416.2019.01.002 [4] 方晓, 郭建功, 黄金明, 等, 预后营养指数预测转移性去势抵抗前列腺癌患者阿比特龙初始耐药和预后[J]. 上海交通大学学报(医学版), 2019, 39(3): 316. [5] SUN Y, ZOU Q, SUN Z, et al. Abiraterone acetate for metastatic castrationresistant prostate cancer after docetaxel failure: a randomized, double-blind, placebo-controlled phase 3 bridging study[J]. Int J Urol, 2016, 23(5): 404. doi: 10.1111/iju.13051 [6] RYAN CJ, SMITH MR, FIZAZI K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomized, double-blind, placebo-controlled phase 3 study[J]. Lancet Oncol, 2015, 16(2): 152. [7] BEER TM, ARMSTRONG AJ, RATHKOPF DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy[J]. N Engl J Med, 2014, 371(5): 424. [8] PARKER C, NILSSON S, HEINRICH D, et al. Alpha emitter radium-223 and survival in metastatic prostate cancer[J]. N Engl J Med, 2013, 369(3): 213. doi: 10.1056/NEJMoa1213755 [9] UEDA Y, MATSUBARA N, TABATA KI, et al. Prostate-specific antigen flare phenomenon induced by abiraterone acetate in chemotherapy-naive patients with metastatic castration-resistant prostate cancer[J]. Clin Genitourin Cancer, 2017, 15(2): 320. [10] FAN L, WANG Y, CHENFEI C, et al. Chromogranin A and neurone-speciflc enolase variations during the flrst 3 months of abiraterone therapy predict outcomes in patients with metastatic castration-resistant prostate cancer[J]. BJU Int, 2017, 120(2): 226. [11] 陶丹, 郭莲怡. NLR、PLR、MPV预测结直肠腺瘤性息肉和结直肠癌的临床意义[J]. 胃肠病学, 2020, 25(3): 162. [12] 王水莲, 杨芳. 预后营养指数对癌症患者预后的临床意义[J]. 现代肿瘤学, 2019, 27(6): 184. [13] 刘涛, 王辉, 王杰, 等. 术前中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值对肾透明细胞癌的预后评估价值[J]. 临床泌尿外科杂志, 2021, 36(1): 7. [14] 贾王强, 倪红谚, 袁龙. 外周血炎症细胞因子在结直肠癌预后中的研究进展[J]. 癌症进展, 2020, 18(15): 1522. [15] 徐翠芳, 翟艳慧, 张崇阳. 姑息性干预对晚期恶性肿瘤患者生活质量及癌因性疲乏的影响[J]. 癌症进展, 2019, 17(22): 2721. [16] 杨瑞娜, 袁小志, 任婧, 等. 晚期肿瘤患者营养风险及影响因素的研究[J]. 现代肿瘤医学, 2021, 29(12): 2130. [17] Japan Esophageal Society. Japanese classification of esophageal cancer, 11th edition: part II and III[J]. Esophagus, 2017, 14(1): 37. [18] FU H, ZHENG J, CAI J, et al. Systemic immune-inflammation index(SII) is useful to predict survival outcomes in patients after liver transplantation for hepatocellular carcinoma within hangzhou criteria[J]. Cell Physiol Biochem, 2018, 47(1): 293. [19] 韩克松, 张帆, 李翠玲, 等. 结直肠癌患者中性粒细胞淋巴细胞比值和T淋巴细胞CD69变化的意义[J]. 中国中西医结合外科杂志, 2021, 27(2): 263. [20] 中国抗癌协会泌尿肿瘤专业委员会. 中国去势抵抗性前列腺癌诊治专家共识[J]. 中华外科杂志, 2016, 54(7): 481. [21] SCHER HI, HALABI S, TANNOCK I, et al. Design and end points of clinical trials for patients with progressive prostate cancer and castrate levels of testosterone: recommendations of the Prostate Cancer Clinical Trials Working Group[J]. J Clin Oncol, 2008, 26(7): 1148. [22] ANGELERGUES A, MAILLET D, FLECHON A, et al. Prostate-specific antigen flare induced by cabazitaxel-based chemotherapy in patients with metastatic castration-resistant prostate cancer[J]. Eur J Cancer, 2014, 50(9): 1602. [23] RYAN CJ, SMITH MR, FIZAZI K, et al. Abriaterone acetate plus prenisone versus placebo plus prednisone in chemotherapy -naive men with metastatic castration-resistant prostate cancer(COU-AA-302): final overall survival analysis of a randomised, double -blind, placebocontrolled phase 3 study[J]. Lancet Oncol, 2015, 16(2): 152. [24] 李俊, 杜鸿, 熊国兵, 等. 去势抵抗性前列腺癌患者使用醋酸阿比特龙治疗后发生前列腺特异性抗原闪烁现象的相关因素[J]. 临床与病理杂志, 2018, 38(6): 1228. [25] BURGIO SL, CONTEDUCA V, RUDNAS B, et al. PSA flare with abiraterone in patients with metastatic castration-resistant prostate cancer[J]. Clin Genitourin Cancer, 2015, 13(1): 39. [26] NARMALA SK, BOULMAY BC. PSA flare after initiation of abiraterone acetate[J]. J Community Support Oncol, 2014, 12(5): 191. [27] OKADA S, SHIMADA J, TERAMUKAI S, et al. Risk stratification according to the prognostic nutritional index for predicting postoperative complications after lung cancer surgery[J]. Ann Surg Oncol, 2018, 25(5): 1254. [28] 胡小剑, 郑亮, 张志刚, 等. 前列腺癌根治术患者治疗前后血小板/淋巴细胞比值变化及其与预后相关性分析[J]. 实用癌症杂志, 2020, 35(9): 1558. [29] 赵雅文, 董頔, 薛茜文, 等. 术前外周血中NLR、PLR、LMR与早期宫颈癌患者预后的相关性研究[J]. 新疆医科大学学报, 2020, 43(8): 997. [30] 高军, 宋伟杰, 刘祥虎, 等. 系统免疫炎症指数对初诊前列腺癌患者骨转移的预测价值[J]. 中华泌尿外科杂志, 2021, 42(10): 752. -




 下载:
下载:


