-
食管癌是一种消化道多发的恶性肿瘤,其恶性程度及致死率较高,2018年全球食管癌流行病学数据显示,约57.2万新发食管癌病例中有一半以上病人来自中国,该病严重威胁我国居民生命健康[1-2]。食管癌预后状况和临床进展的关系密切,早期食管癌5年生存率90%以上,但由于其早期症状不明显,起病隐匿,多数病人确诊时疾病已进展至中晚期[3-4]。目前,临床可采取根治性手术、联合放化疗等手段治疗食管癌,但疗效仍不够理想。随着适形调强放疗技术(IMRT)广泛应用于临床,其对于中晚期食管癌疗效较常规放疗技术的优势明显,能够有效提高整体治疗效果,同时可减少不良反应的发生[5-6]。而由于常用的TNM分期系统对食管癌预后的预测效果一般,故研究食管癌IMRT预后的危险因素并构建一种新的食管癌生存预测模型的临床意义重大。本研究旨在通过对食管癌IMRT的预后危险因素进行多因素分析,然后根据结果建立个体化适用的列线图,即Nomogram生存预测模型,为临床医生判断病人状态和选择治疗方案提供参考依据,现作报道。
-
回顾性分析2012年9月至2015年10月于我院接受IMRT的80例食管癌病人,其中男54例,女26例;年龄42~78岁,中位年龄62岁,≤62岁32例,>62岁48例;肿瘤长度 < 5 cm 31例,≥5 cm 49例。TNM分期和临床分期参考2010年非手术治疗食管癌的临床分期标准(草案)[4]。T分期:T1+2 19例,T3+4 61例;N分期:N0 27例,N1+2 53例;TNM分期:Ⅰ期5例,Ⅱ期15例,Ⅲ期55例,Ⅳ期5例。未化疗44例,化疗36例。
纳入标准:均有病理证实;自愿接受IMRT;既往无影响放化疗的疾病史;知情并同意治疗方案。排除标准:合并其他恶性肿瘤或有既往肿瘤病史;合并出血、穿孔等症状;临床信息有缺失,如缺失原发部位、TNM分期等资料;多发性原发肿瘤;死于其他原因而非食管癌。本研究已获得医院伦理研究委员会知悉批准。
-
病人均接受IMRT。结合纤维食管镜检查、食管钡造影X线片及CT强化扫描图像,靶区勾画大体肿瘤淋巴结体积(GTV nd)、大体肿瘤体积(GTV)及邻近累积脏器(心、肺、脊髓)。临床肿瘤体积(clinical tumor volume, CTV)为以GTV为基础横向外扩1.5 cm,上下方向外扩2.5 cm;计划肿瘤体积(PLV)为以CTV为基础各方向外扩0.5 cm。予以GTV及GTV nd相同的放射治疗剂量。全组放疗剂量59.4~70.0 Gy,每次1.8~2.2 Gy,中位放疗剂量为60.0 Gy。
-
记录病人的1~5年生存率,并绘制生存曲线图。分析可能影响IMRT预后的相关因素,包括性别、年龄、T分期、N分期、TNM分期、化疗应用、GTV、肿瘤长度、放疗剂量、单个或多发病灶。建立Nomogram模型预测食管癌病人预后。
-
80例病人从接受治疗起,即采用门诊复诊和家访、电话随访、信访等方式进行每3个月1次的随访。随访截至2020年10月31日,全组病人无失访,随访率为100.00%,全组随访时间为3~ 60个月,中位随访时间为36个月。
-
采用Kaplan-Meier法计算生存率,以Log Rank法检验行单因素预后分析,以Cox回归模型行多因素分析,COX回归分析的变量代号及量化值见表 1,检验水准α=0.05(双侧)。并利用R软件(R 3.4.1)建立Nomogram预后预测模型。
变量 变量名 赋值 X1 肿瘤长度 < 5 cm=0, ≥5 cm=1 X2 T分期 T1+2=0, T3+4=1 X3 N分期 N0=0, N1+2=1 X4 TNM分期 Ⅰ期+Ⅱ期=0, Ⅲ期+Ⅳ期=1 X5 化疗应用 否=0, 是=1 X6 GTV ≤64 cm3=0, >64 cm3=1 X7 单个或多发病灶 单个=0, 多发=1 X8 放疗剂量 ≤60.0 Gy=0, >60.0 Gy=1 表 1 COX回归分析的变量及赋值表
-
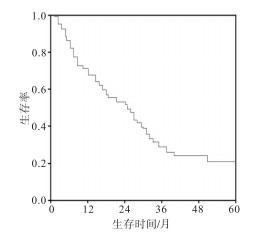
病人1、2、3、5年生存率依次为72.50%、61.25%、53.75%和22.50%,中位生存时间为36个月(见图 1)。至随访截止日,80例食管癌病人死亡61例,其中死于食管癌复发或转移54例,放疗相关死亡5例,其他原因2例。
-
单因素分析显示,肿瘤长度、T分期、N分期、TNM分期、化疗应用、GTV、单个或多发病灶、放疗剂量与病人IMRT预后有关(P < 0.05~ P < 0.01)(见表 2)。
项目 n 生存情况 χ2 P 1年 2年 3年 5年 性别 男
女54
2636(72.22)
19(73.08)33(61.11)
16(61.54)28(51.85)
14(53.85)12(22.22)
6(23.08)0.01 >0.05 年龄 ≤62岁
>62岁32
4823(71.88)
35(72.92)20(62.50)
29(60.42)17(53.13)
26(54.17)7(21.88)
11(22.92)0.01 >0.05 肿瘤长度 < 5 cmbr
≥5 cm31
4924(77.42)
34(69.39)22(70.97)
27(55.10)19(61.29)
24(48.98)11(35.48)
7(14.29)4.89 < 0.05 T分期 T1+2
T3+419
6116(84.21)
42(68.85)15(78.95)
34(55.74)13(68.42)
30(49.18)8(42.11)
10(16.39)4.12 < 0.05 N分期 N0
N1+227
5322(81.48)
36(67.92)20(74.07)
29(54.72)18(66.67)
25(47.17)10(37.04)
8(15.09)4.94 < 0.05 TNM分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ20
6017(85.00)
42(70.00)15(75.00)
33(55.00)14(70.00)
29(48.33)9(45.00)
9(15.00)5.28 < 0.05 化疗应用 无
有44
3629(65.91)
29(80.56)23(52.27)
26(72.22)21(47.73)
22(61.11)6(13.64)
12(33.33)4.41 < 0.05 GTV ≤64 cm3
>64 cm346
3437(80.43)
21(61.76)33(71.74)
16(47.06)32(69.57)
11(32.35)16(34.78)
2(5.88)9.36 < 0.01 单个或多发病灶 单个
多发35
4527(77.14)
31(68.89)24(68.57)
25(55.56)22(62.86)
21(46.67)12(34.29)
6(13.33)4.96 < 0.05 放疗剂量 >60.0 Gy
≤60.0 Gy58
2244(75.86)
14(63.64)39(67.24)
10(45.45)36(62.07)
7(31.82)17(29.31)
1(4.55)4.28 < 0.05 表 2 病人的预后单因素分析结果[n; 百分率(%)]
-
Cox多因素分析显示,N分期、化疗应用、放疗剂量、GTV是影响食管癌IMRT预后的独立预测因素(P < 0.01)(见表 3)。
因素 B SE Waldχ2 P HR(95%CI) 肿瘤长度 0.18 0.214 0.68 >0.05 1.192(0.922~1.412) T分期 0.66 0.396 2.77 >0.05 1.933(0.821~1.215) N分期 0.79 0.257 9.33 < 0.01 2.192(2.014~2.302) TNM分期 0.33 0.207 2.60 >0.05 1.397(0.886~1.521) 化疗应用 0.71 0.214 11.01 < 0.01 2.034(1.926~2.214) GTV 0.69 0.207 11.08 < 0.01 1.992(1.885~2.182) 单个或多发病灶 0.41 0.267 2.37 >0.05 1.508(0.786~1.714) 放疗剂量 0.78 0.158 24.25 < 0.01 2.177(2.016~2.315) 表 3 食管癌病人预后的多因素分析
-
根据多因素分析结果,确定了病人N分期、化疗应用、放疗剂量、GTV可作为预后的预测因子,进一步以R软件建立Nomogram模型,获得的一致性指数C-index为0.746(95%CI:0.633~0.895),对预后的预测效果良好(见图 2)。由此预测1年、3年、5年的生存概率,根据Nomogram可以看出GTV>64 cm3评分最高(86分),其次是N分期N2评分(8.2分),放疗剂量≤60.0 Gy评分(2.8分),未应用化疗评分(2.2分)。每个病人的总得分在0~21.8分。病人总评分越高,病人1、3、5年的生存率越低。
-
食管癌早期的首选治疗方式是手术切除,但由于该病起病较为隐匿,多数病人确诊时已至中晚期,丧失了根治性手术治疗的机会,因此中晚期食管癌主要采取放疗、化疗,然而单纯放疗或化疗的病人5年生存率较低[7]。随着IMRT技术的发展及应用,精确放疗的不良反应显著减少,使同期化疗应用得以实施,可有效提升治疗效果。但IMRT治疗后,病人的预后情况仍可能受到多种因素的影响[8-9]。以往临床常根据TNM分期或其他临床分期系统对肿瘤作出评估,进而参照肿瘤分期判断病人的预后情况,虽可在一定程度上反映病人预后,但由于该判断方式忽略了许多其他非肿瘤的重要因素的影响,故预测精确度一般[10]。因此,为提供更精确且个体化的预后预测信息,构建一个纳入尽可能多的临床影响因素的预测模型是有必要的。而近年来,可通过多指标联合预测疾病发病风险或预后状况的Nomogram模型,因为其具有直观性、准确性的优势而被广泛用于构建肿瘤预后预测模型[11-12]。目前,国内关于食管癌IMRT预后的影响因素探讨及Nomogram预测模型构建的报道较少,本研究通过对80例食管癌IMRT病人预后的分析,旨在为临床对食管癌病人进行IMRT时,提供治疗方案选择和预后生存评估的参考依据。
本研究结果显示,病人1、2、3、5年生存率依次为61.25%、36.25%、26.25%和17.50%,中位生存时间为36个月,其5年生存率较张耀文等[13]研究结果高,可能与研究对象的选择及放疗剂量的不同有关,本研究中病理类型除鳞癌外,还包括腺癌或其他类型,且中位放疗剂量为60.0 Gy。目前临床对放疗剂量的意见分歧较大,国际大多推荐放疗剂量在50.0~50.4 Gy,而由于我国食管癌的病理类型、生物学行为等与西方国家差异较大,故在放疗剂量仍倾向于60.0 Gy[14-15]。REN等[16]对691例食管癌鳞状细胞癌病人进行标准剂量50.4~54.0 Gy和高剂量60 Gy对比研究发现,高剂量组病人的生存率及局控率明显更高;而程志远等[17]的研究指出,不同病理类型可影响病人预后,其中鳞癌类型病人较腺癌或其他类型食管癌病人的5年生存率低。
本研究单因素分析结果显示,肿瘤长度、T分期、N分期、TNM分期、化疗应用、GTV、单个或多发病灶、放疗剂量与食管癌病人IMRT预后有关;多因素分析发现,N分期、化疗应用、GTV、放疗剂量是影响食管癌病人IMRT预后的独立因素,结果基本符合既往报道。研究[18]表明,淋巴结转移的数目可能是影响食管癌病人预后的重要因素;而本研究结果也显示,N0期病人的5年生存率明显高于N1+2期病人,与吴盛喜等[19]报道结果类似。WU等[20]指出GTV能在一定程度上反映T分期程度,二者呈正相关。本研究单因素分析显示T分期、肿瘤长度、GTV均可影响病人预后,但多因素分析仅有GTV为影响适形调强病人预后的独立因素。原因可能是因为单纯T分期、肿瘤长度评估预后均存在片面性,而结合二者信息,同时还可反映肿瘤直径信息的GTV指标更全面客观,故能有效反映食管癌IMRT预后。同步放化疗可明显优化病人整体治疗效果,改善预后,其较单纯放疗或化疗的5年生存率明显提高。当前临床关于放疗剂量的争议问题仍较大。FANG等[21]研究中,放疗剂量≤60 Gy是影响食管癌病人放疗预后的独立危险因素;但NCDB数据指出过高放疗剂量有可能降低食管癌病人生存率,不能改善其预后[22]。因此,提高放疗剂量是否能增加生存效益仍是临床研究的热点。本研究中,>60.0 Gy生存率为食管癌病人适形调强预后的保护性因素。
此外,本研究结果的Nomogram模型的C-index为0.746(95%CI:0.633~0.895),表明对食管癌适形调强病人预后的预测价值良好。Nomogram模型根据不同因素得分值而获得的总分,通过可视化结果显示出对病人预后状况的评估[23]。如一例食管癌病人,N0分期(0分)、无应用化疗(2.2分)、放疗剂量≤60.0 Gy(2.8分)、GTV≤64 cm3(0分),预后分值为5.0分,那么从Nomogram模型可看出其1年生存率约为70%,3年生存率约为45%,5年生存率约为22%。此模型能更直观反映预后评估信息,更符合个体化精确判断。
综上所述,N分期、化疗应用、放疗剂量、GTV是影响食管癌IMRT预后的独立因素,而基于以上结果构建的Nomogram模型预测食管癌病人预后的效果良好,可作为该类食管癌病人预后生存评估和治疗方案选择的依据。本研究存在样本量较小的缺点,此外,由于食管癌影响因素众多,难以全部列举,为进一步完善和精确Nomogram预后预测模型,仍需进行进一步的大样本、大数据的研究验证。
食管癌适形调强放疗病人预后多因素回归分析及其预测模型构建
Multivariate regression analysis of the prognosis of esophageal cancer patients with intensity modulated radiotherapy and its prediction model construction
-
摘要:
目的探究食管癌适形调强放疗病人预后的影响因素,并根据可能影响因素构建可预测病人预后的Nomogram模型。 方法回顾性分析2012年9月至2015年10月接受适形调强放疗的80例食管癌病人。采用Kaplan-Meier法计算食管癌病人1、2、3、5年生存率,以Log Rank法行单因素预后分析,以Cox法多因素分析筛选影响病人生存的独立因素,并利用R软件建立Nomogram预测模型。 结果病人随访中位时间是36个月,1、2、3、5年生存率依次为72.50%、61.25%、53.75%和22.50%。单因素分析显示,肿瘤长度、T分期、N分期、TNM分期、化疗应用、大体肿瘤体积(GTV)、单个或多发病灶、放疗剂量与病人适形调强放疗预后有关(P < 0.05~P < 0.01);Cox多因素分析显示,N分期、化疗应用、放疗剂量、GTV是影响食管癌适形调强放疗预后的独立预测因素(P < 0.01)。获得Nomogram预测模型的一致性指数C-index为0.746(95%CI:0.633~0.895)。 结论N分期、化疗应用、放疗剂量、GTV是影响食管癌适形调强放疗病人预后的独立影响因素,基于以上结果构建的Nomogram模型预测食管癌病人预后的效果良好。 Abstract:ObjectiveTo investigate the prognostic factors of intensity modulated radiotherapy(IMRT) in esophagus cancer, and construct a Nomogram model to predict the prognosis of patients. MethodsThe clinical data of 80 esophageal cancer patients treated with IMRT from September 2012 to October 2015 were retrospectively analyzed.The Kaplan-Meier method was used to calculate the 1-year, 2-year, 3-year and 5-year survival rates of esophageal cancer patients, the Log Rank method was used to perform univariate prognostic analysis, the Cox method was used to screen the independent factors affecting survival, and the R software was used to establish a Nomogram prediction model. ResultsThe median time of follow-up was 36 months.The 1-year, 2-year, 3-year and 5-year survival rates were 72.50%, 61.25%, 53.75% and 22.50%, respectively.The results of univariate analysis showed that the tumor length, T stage, N stage, TNM stage, chemotherapy application, gross tumor volume(GTV), single or multiple lesions, radiotherapy dose were related to the prognosis of patients with IMRT(P < 0.05 to P < 0.01).The results of Cox multivariate analysis showed that the N stage, chemotherapy application, radiotherapy dose and GTV were the independent predictors of the prognosis of esophageal cancer(P < 0.01).The C-index of this Nomogram prediction model was 0.746(95%CI: 0.633-0.895). ConclusionsThe N stage, chemotherapy application, radiotherapy dose and GTV are the independent factors of influencing the prognosis of patients with esophageal cancer, and this Nomogram model based on the above results can well predict the prognosis of patients with esophageal cancer. -
Key words:
- esophagus neoplasms /
- intensity modulated radiotherapy /
- prognosis /
- multi-factor /
- prediction model
-
表 1 COX回归分析的变量及赋值表
变量 变量名 赋值 X1 肿瘤长度 < 5 cm=0, ≥5 cm=1 X2 T分期 T1+2=0, T3+4=1 X3 N分期 N0=0, N1+2=1 X4 TNM分期 Ⅰ期+Ⅱ期=0, Ⅲ期+Ⅳ期=1 X5 化疗应用 否=0, 是=1 X6 GTV ≤64 cm3=0, >64 cm3=1 X7 单个或多发病灶 单个=0, 多发=1 X8 放疗剂量 ≤60.0 Gy=0, >60.0 Gy=1 表 2 病人的预后单因素分析结果[n; 百分率(%)]
项目 n 生存情况 χ2 P 1年 2年 3年 5年 性别 男
女54
2636(72.22)
19(73.08)33(61.11)
16(61.54)28(51.85)
14(53.85)12(22.22)
6(23.08)0.01 >0.05 年龄 ≤62岁
>62岁32
4823(71.88)
35(72.92)20(62.50)
29(60.42)17(53.13)
26(54.17)7(21.88)
11(22.92)0.01 >0.05 肿瘤长度 < 5 cmbr
≥5 cm31
4924(77.42)
34(69.39)22(70.97)
27(55.10)19(61.29)
24(48.98)11(35.48)
7(14.29)4.89 < 0.05 T分期 T1+2
T3+419
6116(84.21)
42(68.85)15(78.95)
34(55.74)13(68.42)
30(49.18)8(42.11)
10(16.39)4.12 < 0.05 N分期 N0
N1+227
5322(81.48)
36(67.92)20(74.07)
29(54.72)18(66.67)
25(47.17)10(37.04)
8(15.09)4.94 < 0.05 TNM分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ20
6017(85.00)
42(70.00)15(75.00)
33(55.00)14(70.00)
29(48.33)9(45.00)
9(15.00)5.28 < 0.05 化疗应用 无
有44
3629(65.91)
29(80.56)23(52.27)
26(72.22)21(47.73)
22(61.11)6(13.64)
12(33.33)4.41 < 0.05 GTV ≤64 cm3
>64 cm346
3437(80.43)
21(61.76)33(71.74)
16(47.06)32(69.57)
11(32.35)16(34.78)
2(5.88)9.36 < 0.01 单个或多发病灶 单个
多发35
4527(77.14)
31(68.89)24(68.57)
25(55.56)22(62.86)
21(46.67)12(34.29)
6(13.33)4.96 < 0.05 放疗剂量 >60.0 Gy
≤60.0 Gy58
2244(75.86)
14(63.64)39(67.24)
10(45.45)36(62.07)
7(31.82)17(29.31)
1(4.55)4.28 < 0.05 表 3 食管癌病人预后的多因素分析
因素 B SE Waldχ2 P HR(95%CI) 肿瘤长度 0.18 0.214 0.68 >0.05 1.192(0.922~1.412) T分期 0.66 0.396 2.77 >0.05 1.933(0.821~1.215) N分期 0.79 0.257 9.33 < 0.01 2.192(2.014~2.302) TNM分期 0.33 0.207 2.60 >0.05 1.397(0.886~1.521) 化疗应用 0.71 0.214 11.01 < 0.01 2.034(1.926~2.214) GTV 0.69 0.207 11.08 < 0.01 1.992(1.885~2.182) 单个或多发病灶 0.41 0.267 2.37 >0.05 1.508(0.786~1.714) 放疗剂量 0.78 0.158 24.25 < 0.01 2.177(2.016~2.315) -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394. doi: 10.3322/caac.21492 [2] 王洛伟, 李兆申. 食管癌早诊早治现状及展望[J]. 中国实用内科杂志, 2019, 39(7): 605. [3] LYU S, LU J, CHEN W, et al. High expression of eIF4A2 is associated with a poor prognosis in esophageal squamous cell carcinoma[J]. Oncol Lett, 2020, 20(5): 177. [4] MOON SH, SUH YG. The role of modern radiotherapy technology in the treatment of esophageal cancer[J]. Korean J Thorac Cardiovasc Surg, 2020, 53(4): 184. doi: 10.5090/kjtcs.2020.53.4.184 [5] BOUSTANI J, RIVIN DEL CAMPO E, et al. Quality assurance of dose-escalated radiation therapy in a randomized trial for locally advanced oesophageal cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 105(2): 329. doi: 10.1016/j.ijrobp.2019.06.2542 [6] LIU S, REN SN, DING WX, et al. Concurrent liposomal paclitaxel and cisplatin chemotherapy improved outcomes for locally advanced esophageal squamous cell carcinoma treated with intensity-modulated radiotherapy[J]. Ann Transl Med, 2019, 7(14): 331. doi: 10.21037/atm.2019.06.45 [7] 曹晓岚, 胡旭东. 化疗方案对食管癌放疗的增效作用研究进展[J]. 肿瘤, 2017, 37(11): 1238. [8] CHEN NB, QIU B, ZHANG J, et al. Intensity-modulated radiotherapy versus three-dimensional conformal radiotherapy in definitive chemoradiotherapy for cervical esophageal squamous cell carcinoma: comparison of survival outcomes and toxicities[J]. Cancer Res Treat, 2020, 52(1): 31. doi: 10.4143/crt.2018.624 [9] 白文文, 宋玉芝, 乔永志, 等. 食管鳞癌SIB-IMRT疗效及预后因素分析[J]. 中华放射肿瘤学杂志, 2018, 27(6): 570. [10] 方文涛. 通过食管癌TNM新分期(第八版)解读2017年NCCN食管鳞癌诊疗指南[J]. 中华胃肠外科杂志, 2017, 20(10): 1122. [11] MIN BH, YANG JW, MIN YW, et al. Nomogram for prediction of lymph node metastasis in patients with superficial esophageal squamous cell carcinoma[J]. J Gastroenterol Hepatol, 2020, 35(6): 1009. doi: 10.1111/jgh.14915 [12] LI W, LIU J, ZHAO H. Identification of a nomogram based on long non-coding RNA to improve prognosis prediction of esophageal squamous cell carcinoma[J]. Aging(Albany NY), 2020, 12(2): 1512. [13] 张耀文, 郑安平, 郑志勇, 等. 食管鳞癌术后局部复发三维适形调强放疗预后因素分析[J]. 中华肿瘤防治杂志, 2015, 22(12): 969. [14] 赵晶晶, 庞青松, 王平. 食管癌根治性放疗剂量研究进展[J]. 中华放射肿瘤学杂志, 2020, 29(7): 589. [15] ISHIDA Y, SAKANAKA K, FUJⅡ K, et al. Intensity-modulated radiotherapy for cervical esophageal squamous cell carcinoma without hypopharyngeal invasion: dose distribution and clinical outcome[J]. J Radiat Res, 2019, 60(4): 517. doi: 10.1093/jrr/rrz019 [16] REN X, WANG L, HAN C, et al. Retrospective analysis of safety profile of high-dose concurrent chemoradiotherapy for patients with oesophageal squamous cell carcinoma[J]. Radiother Oncol, 2018, 129(2): 293. doi: 10.1016/j.radonc.2018.09.006 [17] 程志远, 孙枫原, 孟茜茜, 等. 食管癌单纯性骨转移183例预后因素分析及预测模型构建[J]. 中国实用内科杂志, 2019, 39(7): 624. [18] BETANCOURT-CUELLAR SL, BENVENISTE MFK, PALACIO DP, et al. Esophageal cancer: tumor-node-metastasis staging[J]. Radiol Clin North Am, 2021, 59(2): 219. doi: 10.1016/j.rcl.2020.11.008 [19] 吴盛喜, 罗何三, 张晓平, 等. 胸中段食管癌放化疗后远期生存Nomogram预测模型建立[J]. 中华肿瘤防治杂志, 2018, 25(6): 417. [20] WU L, OU J, CHEN TW, et al. Tumour volume of resectable oesophageal squamous cell carcinoma measured with MRI correlates well with T category and lymphatic metastasis[J]. Eur Radiol, 2018, 28(11): 4757. doi: 10.1007/s00330-018-5477-0 [21] FANG FM, TSAI WL, CHIU HC, et al. Quality of life as a survival predictor for esophageal squamous cell carcinoma treated with radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 58(5): 1394. doi: 10.1016/j.ijrobp.2003.09.100 [22] DE B, RHOME R, DOUCETTE J, et al. Dose escalation of definitive radiation is not associated with improved survival for cervical esophageal cancer: a National Cancer Data Base(NCDB) analysis[J]. Dis Esophagus, 2017, 30(4): 1. [23] TANG X, ZHOU X, LI Y, et al. A novel nomogram and risk classification system predicting the cancer-specific survival of patients with initially diagnosed metastatic esophageal cancer: a seer-based Study[J]. Ann Surg Oncol, 2019, 26(2): 321. doi: 10.1245/s10434-018-6929-0 -





 下载:
下载: