-
乳腺癌病因复杂,病人预后欠佳。癌细胞发生转移是影响肿瘤病人预后的重要因素[1]。腋窝淋巴结(axillary lymph node, ALN)是乳腺癌常见的转移路径。前哨淋巴结活检(sentinel lymph node biopsy, SLNB)是临床资料阴性病人腋窝淋巴结清扫(axillary lymph node dissection, ALND)的依据,但两者均易导致病人发生上肢麻木、肩部疼痛、局部水肿等不适症状。研究报道,40%~70%的早期乳腺癌病人并未发生ALN转移[2],或仅前哨淋巴结受累,若直接对这些病人行ALND,则属过度治疗,易引起争议。但因ALN转移而未采取ALND,会严重影响预后。因而本研究基于多维度指标分析,筛选出危险因素用于构建乳腺癌病人ALN转移的预测模型,以便区分哪类病人适合SLNB手术或ALND,降低非必要的淋巴结活检术或ALND带给病人的创伤与并发症。
-
回顾性选取2014年3月至2020年5月我院收治的242例单侧乳腺癌女性病人作为研究对象,根据病人的病理结果确认有无ALN转移分为转移组(n=66)和非转移组(n=176)。纳入标准:(1)符合《乳腺癌诊疗指南》[3]中的原发性乳腺癌诊断标准;(2)临床分期为Ⅰ~Ⅱ期;(3)有miRNA-203表达量检测结果者。排除标准:(1)合并心、脑、肺等系统疾病;(2)除乳腺癌,合并其他恶性肿瘤;(3)乳腺癌确诊前有过腋窝手术史、腹部或胸腔手术史。
-
通过病案科收集病人入院时的年龄、月经状态、乳腺超声特征(肿瘤的直径、边缘、形态、回声)、腋窝超声特征(ALN的皮质厚度、长径、短径、短径/长径的比值)、临床分期、组织学分级、癌组织病理标本[雌激素受体(estrogen receptor, ER),孕激素受体(progesterone receptor, PR),人表皮生长因子受体2(human epidermal growth factor receptor-2, Her-2),肿瘤增殖抗原(Ki-67)]、肿瘤标志物[糖链抗原153(carbohydrate antigen 153, CA153),血清癌胚抗原(carcinoembryonic antigen, CEA)]、生化指标[白细胞计数(white blood cell count, WBC)、血小板计数(blood platelet count, PLT)、D-二聚体、白蛋白(albumin, Alb)、血清miRNA-203表达量]等。其中ER表达≥1%为阳性;PR表达≥1%为阳性;Her-2以免疫组织化学结果判断,0或1+为阴性,3+为阳性,2+根据进一步荧光原位杂交检测有无基因扩增分为阳性/阴性;Ki-67表达≥14%为阳性。
-
参照《WHO乳腺肿瘤分类(2019版)》[4]进行诊断,即常规苏木精伊红染色(HE)切片,高倍镜下阅片,若见转移灶>2.0 mm则归为宏转移(阳性)、0.2 mm < 转移灶≤2.0 mm归为微转移(阳性),仅孤立细胞的淋巴结归阴性。
-
采用t(或t′)检验、χ2检验、非参数Mann-Whitney秩和检验和多因素logistic回归分析。用受试者工作特征(ROC)曲线分析评价模型的区分度,用拟合优度检验评价模型的校准度,验证模型的正确率。
-
转移组和非转移组在肿瘤边缘模糊、ALN皮质厚度、ALN短径、ALN短径/长径的比值、分级程度、miRNA-203表达量方面的比较,差异均有统计学意义(P < 0.05~P < 0.01),其余指标差异均无统计学意义(P>0.05)(见表 1)。
临床资料 转移组
(n=66)非转移组
(n=176)t P 年龄/岁 54.63±5.94 53.46±5.75 1.39 >0.05 已绝经 29 61 1.77* >0.05 肿瘤最大直径/cm 3.65±1.14 3.41±1.03 1.57 >0.05 肿瘤边缘模糊 32 49 9.19* < 0.05 肿瘤形态不规则 41 92 1.88* >0.05 肿瘤回声不均 44 96 3.16* >0.05 ALN皮质厚度/mm 3.32±0.79 1.83±0.42 14.57# < 0.01 ALN长径/mm 14.18±3.75 13.63±3.74 1.02 >0.05 ALN短径/mm 8.72±1.31 5.23±1.35 18.05 < 0.01 ALN短径/长径 0.61±0.17 0.38±0.09 10.46# < 0.01 临床分期 Ⅰ期 37 114 1.55* >0.05 Ⅱ期 29 62 分级程度 Ⅲ级 24 37 2.55△ < 0.05 Ⅱ级 31 91 Ⅰ级 11 48 ER阳性 23 45 2.05* >0.05 PR阳性 26 59 0.73* >0.05 Her-2阳性 25 51 1.77* >0.05 Ki-67阳性 32 66 2.40* >0.05 CA153/(U/mL) 29.24±5.28 28.32±4.36 1.38 >0.05 CAE/(ng/mL) 7.31±2.15 6.83±2.08 1.25 >0.05 WBC/(×109/L) 6.94±1.48 6.77±1.42 0.82 >0.05 PLT/(×109/L) 237.63±62.47 230.58±60.15 0.80 >0.05 D-二聚体/(μg/L) 184.56±46.73 179.75±41.87 0.75 >0.05 白蛋白/(g/L) 29.48±6.84 30.86±7.32 1.31 >0.05 miRNA-203表达量 4.53±0.87 4.07±0.56 4.00# < 0.01 *示χ2值; #示t′值; △示zc值 表 1 临床资料的比较(x±s,n)
-
以病理确诊是否(0=否;1=是)存在ALN转移为因变量,将表 1分析P < 0.05的特征为自变量,分类资料赋值[肿瘤边缘模糊(0=否;1=是)、肿瘤的分级程度(0=Ⅰ级;1=Ⅱ级;2=Ⅲ级)],计量资料原值录入。经多因素logistic回归分析表明,肿瘤边缘模糊、ALN皮质厚度厚、ALN短径短、ALN短径/长径的比值大、分级程度高、miRNA-203表达量高均是乳腺癌病人ALN转移的危险因素(P < 0.05~P < 0.01)(见表 2)。
变量 B SE Waldχ2 P OR(95%CI) 肿瘤边缘模糊 0.648 0.275 5.55 < 0.05 1.912(1.273~3.508) ALN皮质厚度 1.026 0.351 8.54 < 0.05 2.789(1.615~4.954) ALN短径 0.824 0.297 7.70 < 0.05 2.280(1.473~3.165) ALN短径/长径比值 1.328 0.472 7.92 < 0.05 3.773(2.354~6.281) 分级程度 0.742 0.246 8.66 < 0.05 2.101(1.549~3.087) miRNA-203表达量 1.261 0.405 9.69 < 0.05 3.529(2.187~5.942) 常数项 -30.724 8.436 13.264 < 0.01 — 表 2 多因素logistic分析结果
-
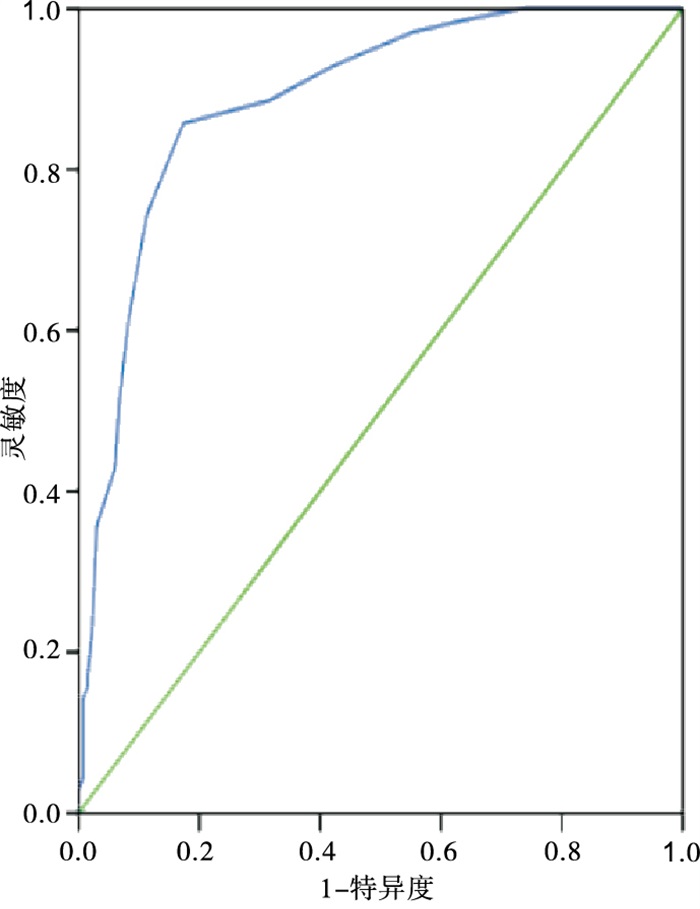
以表 2回归系数和常数项构建乳腺癌病人ALN转移的预测模型,得出预测模型方程为:预测概率Prob =1/(e^-Y),Y=-30.724+0.648×肿瘤边缘模糊(0=否;1=是)+ 1.026×ALN皮质厚度(实际值)+0.824×ALN短径(实际值)+1.328×ALN短径/长径的比值(实际值)+ 0.742×肿瘤的分级程度(0=Ⅰ级,1=Ⅱ级,2=Ⅲ级)+ 1.261×miRNA-203表达量(实际值)。将模型的预测概率值作为检验变量,以是否发生ALN转移为状态变量。绘制ROC评价预测模型区分度,结果提示ROC曲线下AUC面积为0.889(95%CI: 0.840~0.934),以最大约登指数(0.679)计算出模型阈值为0.504,对应灵敏度和特异度分别为88.62%、83.92%,说明模型区分度较好(见图 1);经拟合优度检验(χ2=2.06,P>0.05),表明模型不存在过拟合现象(见图 2)。
-
选择2020年7月至2022年3月我院收治的93例单侧乳腺癌女性病人作为预测模型的临床验证。以病理结果为“金标准”,验证模型效能,结果模型预测的灵敏度为88.46%(23/26),特异度为83.58%(56/67),准确率为84.95%(79/93)(见表 3)。
模型预测结果 实际结果 合计 ALN转移 ALN未转移 ALN转移 23 11 34 ALN未转移 3 56 59 合计 26 67 93 表 3 预测模型的临床验证结果
-
乳腺癌病人的死亡率高,且多数病人死亡并非由原发肿瘤所致,更多是因癌细胞发生转移而增加治疗难度而引起。在乳腺癌中,ALN是最常见的转移路径[5],因而ALN也成为乳腺癌分期中的重要凭证,但部分早期乳腺癌病人ALND存在阴性结果。因而有效鉴别高风险病人至关重要。
本研究对242例乳腺癌病人临床资料进行分析发现ALN转移率为27.27%(66/242),低于王宋等[6]报道乳腺癌ALN转移的48.5%,但高于周子君等[7]报道乳腺癌ALN转移的13.1%。可能是与筛选病例标准不同因素导致结果差异。乳腺癌发生ALN转移可能受诸多因素相互作用所致。肿瘤边缘模糊不清或呈毛刺样症状,表示癌细胞浸润周围正常组织明显,癌细胞生长特性活跃、侵袭力强,易侵犯微血管,可加快癌细胞转移速度和扩散范围[8],因而ALN转移风险较高。本研究发现肿瘤边缘模糊是乳腺癌病人ALN转移的危险因素结果与之相符。ALN形态是判断乳腺癌病人有无腋窝淋巴结转移的重要凭证。通常正常健康人群的ALN形态是呈椭圆形的,其短径范围在2~5 mm、长经范围在7~18 mm[9]。当癌细胞侵袭ALN并定植,ALN的短径和皮质变厚会发生较大改变,因为癌细胞向ALN转移时,首先要经过ALN边缘部位,然后在逐渐延伸至髓窦、小梁旁窦,直至充满整个ALN,使淋巴结体积增大,皮质变厚和变硬,会由最初呈椭圆形演变成圆形[10]。因此短经和皮质厚度变化较大,长经变化相对要小。这与本研究发现ALN短径短、短径/长径的比值大、皮质厚度厚是乳腺癌ALN转移的危险因素的结果基本相符。但单纯通过ALN形态来预测乳腺癌病人的ALN是否受累,也存在一些片面性,如病人的ALN存在反应性增生、炎症等,也可导致淋巴结形态改变成类似圆形。因而要准确判定乳腺癌病人是否存在ALN转移,还需观察病人的癌细胞病理恶性化程度、分子调控等。癌细胞与正常细胞差异越大,说明分级程度越高,癌细胞分裂繁殖特性活跃,恶性程度高,侵袭力强,易向乳腺周围正常组织、毛细血管、淋巴管侵袭和转移。WU等[11]报道,病理分级与乳腺癌病人ALN转移密切相关,本研究结果与之相符。关于恶性肿瘤发生转移的分子调控,以高度保守型的内源性miRNA序列的微小分子成了近年研究的热点类型。miRNA广泛涉及人类生命的重要过程,如细胞的代谢、增殖、迁移、分化等。正常表达的miRNA能有效的够调控细胞分化、增殖,异常表达则可促进肿瘤发生发展。miRNA-203作为微小分子中表达量较好且研究较多的一种。miRNA-203不仅在恶性肿瘤组织中异常表达[12],在外周血中稳定存在[13-14]。有研究[15]表明,miRNA-203具有抑制癌细胞分化、侵袭、迁移的作用。本研究发现乳腺癌病人存在ALN转移的miRNA-203表达量高于未转移病人,且miRNA-203是乳腺癌病人ALN转移的危险因素。高表达的miR-203可靶向血管内皮生长因子(vascular endothelial growth factor, VEGF)调控肿瘤细胞的生物学行为[16]。VEGF参与供应肿瘤血管系统形成[17]。腋窝淋巴管引流着乳房绝大多数的淋巴液,会给高表达miRNA-203调控VEGF促进肿瘤血管生长提供方向,使癌细胞快速随淋巴液流向迁移,致使ALN转移风险上升。
乳腺癌病人ALN转移是由部分原癌细胞游离到达腋窝中继续增殖。本研究以筛选的各危险因素变量回归系数和常数项构建预测模型,发现该方式构建的预测模型在临床验证中的总体正确率达84.95%。可能首先对乳腺癌病人入院时的多维度指标进行独立样本验证,过滤掉不相关或相关不大的指标,避免模型出现过拟合现象;将显著相关指标进行组合,实现信息互补,增强诊断效能。这也提示通过乳腺癌病人ALN转移的各种危险因素构建风险预测模型,不仅能有效为临床发现高危病人提供指导,也佐证临床变量的组学数据模型预测效果具有一定实用价值,尤其对开展病理组织检查条件有限的医院,其可通过这些指标组合的诊断方式,提高诊断效能。
综上所述,乳腺癌病人ALN转移的危险因素有肿瘤边缘模糊、分级程度高、miRNA-203表达量高以及ALN的皮质厚度厚、短径短、短径/长径的比值大。根据危险因素构建预测模型,能有效评估病人ALN转移风险。
基于多维度指标建立预测模型在乳腺癌病人腋窝淋巴结转移的应用价值
Application value of prediction model based on multi-dimensional indicators in axillary lymph node metastasis in breast cancer patients
-
摘要:
目的探讨以多维度指标建立预测模型在乳腺癌病人腋窝淋巴结(ALN)转移的应用价值。 方法回顾性选取242例单侧乳腺癌女性病人作为研究对象。以病理检测结果确认有无ALN转移,划分为转移组(n=66)和非转移组(n=176)。对比2组的临床资料,用多因素logistic回归分析乳腺癌病人ALN转移的危险因素并建立预测模型。应用ROC曲线分析模型的区分度,应用拟合优度检验模型的校准度。另选93例单侧乳腺癌女性病人用于模型的临床验证。 结果多因素logistic回归分析显示,肿瘤边缘模糊(OR=1.912)、ALN皮质厚度厚(OR=2.789)、ALN短径短(OR=2.280)、ALN短径/长径的比值大(OR=3.773)、分级程度高(OR=2.101)、miRNA-203表达量高(OR=3.529)是乳腺癌病人ALN转移的危险因素(P < 0.05~P < 0.01)。根据危险因素得出预测模型方程:Prob =1/(e^-Y),Y=-30.724+0.648×肿瘤边缘模糊+ 1.026×ALN皮质厚度+ 0.824×ALN短径+1.328×ALN短径/长径的比值+ 0.742×分级程度+ 1.261×miRNA-203表达量。ROC曲线分析显示模型预测乳腺癌病人ALN转移的AUC面积为0.889(95%CI: 0.840~0.934),说明模型区分度较好;拟合优度检验χ2=2.06,P>0.05,说明模型无过拟合现象。预测模型在临床验证得到的灵敏度为88.46%、特异度为83.58%、准确率为84.95%。 结论以血清miRNA-203表达量、肿瘤分级程度、肿瘤边缘及ALN的皮质厚度、短径、短径/长径的比值来构建的乳腺癌病人ALN转移的预测模型有一定价值。 Abstract:ObjectiveTo explore the application value of establishing a prediction model based on multi-dimensional indicators in axillary lymph node(ALN) metastasis in breast cancer patients. MethodsA total of 242 female patients with unilateral breast cancer were retrospectively selected as the research subjects.The presence or absence of ALN metastasis were confirmed by pathological test results.Patients were divided into metastatic group(n=66) and non-metastatic group(n=176).The clinical data of two groups were compared.Multivariate logistic regression analysis was used to analyze the risk factors of ALN metastasis in breast cancer patients and establish a prediction model.ROC curve was used to analyze the discrimination of the model, and goodness of fit was used to test the calibration of the model.Another 93 female patients with unilateral breast cancer were selected for clinical validation of the model. ResultsMultivariate logistic regression analysis showed that blurred tumor margin(OR=1.912), thick ALN cortex(OR =2.789), short ALN diameter(OR=2.280), large ratio of short ALN diameter to long ALN diameter(OR=3.773), high grade of pathological(OR=2.101), and high expression of miRNA-203(OR=3.529) were risk factors for ALN metastasis in breast cancer patients(P < 0.05 to P < 0.01).The prediction model equation derived from the risk factors was Prob =1/(e^-Y), Y=-30.724+0.648×tumor margin blur+1.026×ALN cortical thickness+0.824×ALN short diameter+1.328×ALN short diameter/long diameter ratio+0.742×pathological grade +1.261×miRNA-203 expression level.ROC curve analysis showed that the AUC area of ALN metastasis in breast cancer patients predicted by the model was 0.889(95%CI: 0.840-0.934), indicating that the model had good discrimination.Goodness of fit test was χ2=2.06, P>0.05, indicating that the model had no overfitting phenomenon.The sensitivity, specificity and accuracy of the prediction model were 88.46%, 83.58% and 84.95%, respectively. ConclusionsThe prediction model of ALN metastasis in breast cancer patients constructed by serum miRNA-203 expression, tumor pathological grade, tumor margin and cortical thickness of ALN, short diameter, and short diameter/long diameter ratio has certain value. -
Key words:
- breast neoplasms /
- axillary lymph node metastasis /
- risk factors /
- prediction model
-
表 1 临床资料的比较(x±s,n)
临床资料 转移组
(n=66)非转移组
(n=176)t P 年龄/岁 54.63±5.94 53.46±5.75 1.39 >0.05 已绝经 29 61 1.77* >0.05 肿瘤最大直径/cm 3.65±1.14 3.41±1.03 1.57 >0.05 肿瘤边缘模糊 32 49 9.19* < 0.05 肿瘤形态不规则 41 92 1.88* >0.05 肿瘤回声不均 44 96 3.16* >0.05 ALN皮质厚度/mm 3.32±0.79 1.83±0.42 14.57# < 0.01 ALN长径/mm 14.18±3.75 13.63±3.74 1.02 >0.05 ALN短径/mm 8.72±1.31 5.23±1.35 18.05 < 0.01 ALN短径/长径 0.61±0.17 0.38±0.09 10.46# < 0.01 临床分期 Ⅰ期 37 114 1.55* >0.05 Ⅱ期 29 62 分级程度 Ⅲ级 24 37 2.55△ < 0.05 Ⅱ级 31 91 Ⅰ级 11 48 ER阳性 23 45 2.05* >0.05 PR阳性 26 59 0.73* >0.05 Her-2阳性 25 51 1.77* >0.05 Ki-67阳性 32 66 2.40* >0.05 CA153/(U/mL) 29.24±5.28 28.32±4.36 1.38 >0.05 CAE/(ng/mL) 7.31±2.15 6.83±2.08 1.25 >0.05 WBC/(×109/L) 6.94±1.48 6.77±1.42 0.82 >0.05 PLT/(×109/L) 237.63±62.47 230.58±60.15 0.80 >0.05 D-二聚体/(μg/L) 184.56±46.73 179.75±41.87 0.75 >0.05 白蛋白/(g/L) 29.48±6.84 30.86±7.32 1.31 >0.05 miRNA-203表达量 4.53±0.87 4.07±0.56 4.00# < 0.01 *示χ2值; #示t′值; △示zc值 表 2 多因素logistic分析结果
变量 B SE Waldχ2 P OR(95%CI) 肿瘤边缘模糊 0.648 0.275 5.55 < 0.05 1.912(1.273~3.508) ALN皮质厚度 1.026 0.351 8.54 < 0.05 2.789(1.615~4.954) ALN短径 0.824 0.297 7.70 < 0.05 2.280(1.473~3.165) ALN短径/长径比值 1.328 0.472 7.92 < 0.05 3.773(2.354~6.281) 分级程度 0.742 0.246 8.66 < 0.05 2.101(1.549~3.087) miRNA-203表达量 1.261 0.405 9.69 < 0.05 3.529(2.187~5.942) 常数项 -30.724 8.436 13.264 < 0.01 — 表 3 预测模型的临床验证结果
模型预测结果 实际结果 合计 ALN转移 ALN未转移 ALN转移 23 11 34 ALN未转移 3 56 59 合计 26 67 93 -
[1] BUNDRED NJ, BARNES NL, RUTGERS E, et al. Is axillary lymph node clear ance required in node-positive breast cancer[J]. Nat Rev Clin Oncol, 2015, 12(1): 55. doi: 10.1038/nrclinonc.2014.188 [2] JOO JH, KIM SS, SON BH, et al. Evaluation of the prognostic stage in the 8th edition of the American joint committee on cancer in pa tients with breast cancer and internal mammary lymph node metas tasis[J]. Anticancer Res, 2018, 38(9): 5357. doi: 10.21873/anticanres.12864 [3] 中国临床肿瘤学会乳腺癌专家委员会发布. 2021年CSCO《乳腺癌诊疗指南》更新要点解读[J]. 中国肿瘤外科杂志, 2021, 13(3): 209. doi: 10.3969/j.issn.1674-4136.2021.03.001 [4] 方三高, 魏建国, 陈真伟. WHO(2019)乳腺肿瘤分类[J]. 临床与实验病理学杂志, 2020, 36(6): 755. [5] 郭斌. 乳腺癌病人腋窝淋巴结转移相关因素分析[J]. 蚌埠医学院学报, 2021, 46(2): 206. [6] 王宋, 权毅. Luminal A型乳腺癌发生腋窝淋巴结转移的风险因素分析[J]. 中国普外基础与临床杂志, 2021, 28(6): 789. [7] 周子君, 古林, 张乃千, 等. T1a~1b期老年乳腺癌腋窝淋巴结转移的相关影响因素[J]. 中国老年学杂志, 2021, 41(19): 4209. doi: 10.3969/j.issn.1005-9202.2021.19.016 [8] 刘信礼, 王雯, 牛学才, 等. 早期浸润性乳腺癌患者腋窝淋巴结转移的影响因素分析[J]. 山东医药, 2021, 61(28): 62. doi: 10.3969/j.issn.1002-266X.2021.28.015 [9] ANDERSSON Y, BERGKVIST L, FRISELL J, et al. Long-term breast cancer survival in relation to the metastatic tumor burden in axillary lymph nodes[J]. Breast Cancer Res Treat, 2018, 171(2): 359. doi: 10.1007/s10549-018-4820-0 [10] SUSINI T, NORI J, OLIVIERIL S, et al. Predicting the status of axillary lymph nodes in breast cancer: a multiparameter approach including axillary ultra-sound scanning[J]. Breast, 2009, 18: 103. doi: 10.1016/j.breast.2009.02.001 [11] WU JL, TSENG HS, YANG LH, et al. Prediction of axillary lymph node metastases in breast cancer patients based on pathologic information of the primary tumor[J]. Med Sci Monit, 2014, 8(20): 577. [12] 王晓芳, 徐新宇, 许里, 等. 胃癌组织miR-203、miR-4317的表达及临床意义[J]. 现代生物医学进展, 2021, 21(3): 480. [13] WANG C, ZHENG X, SHEN C, et al. MicroRNA-203 suppresses cell proliferation and migration by targeting BIRC5 and LASP1 in human triple-negative breast cancer cells[J]. J Exp Clin Cancer Res, 2012, 31(1): 58. doi: 10.1186/1756-9966-31-58 [14] 赵高传, 陈卿奇, 庞莉, 等. 血清miR-144及miR-203表达水平对胃癌诊断及预后评估的价值[J]. 中国免疫学杂志, 2021, 37(3): 351. doi: 10.3969/j.issn.1000-484X.2021.03.017 [15] GAO G, GE R, LI Y, et al. Luteolin exhibits anti-breast cancer property through up-regulating miR-203[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 3265. doi: 10.1080/21691401.2019.1646749 [16] 杨雯迪, 李亚军. miR-203a-3p靶向调控VEGF-C表达对卵巢癌恶性生物学特征的影响[J]. 中国妇幼健康研究, 2022, 33(1): 66. [17] ZHANG L, WANG H, LI C, et al. VEGF-A/Neuropilin 1 pathway confers cancer stemness via activating wnt/β-Catenin axis in breast cancer cells[J]. Cell Physiol Biochem, 2017, 44(3): 1251. doi: 10.1159/000485455 -




 下载:
下载: