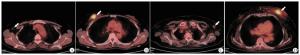
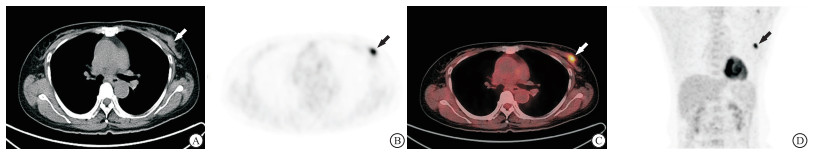
-
乳腺癌是女性常见的恶性肿瘤之一,浸润性导管癌是乳腺癌最常见的病理类型,乳腺癌在临床分期、分子生物学分型中的异质性会导致病人预后差异明显。浸润性导管癌的T分期、临床分期与手术切除、新辅助化疗等治疗方式的选择密切相关,雌激素受体(estrogen receptor,ER)、孕激素受体(progestogen receptor,PR)、表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)及增殖细胞相关抗原Ki-67等生物学指标是乳腺癌分子分型的重要依据,不同分型的乳腺癌靶向治疗方式和预后各有不同[1]。因此术前使用影像学对浸润性导管癌肿瘤分期和分子生物学特征的评估十分重要。
随着分子影像学的发展,18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)正电子发射计算机断层扫描(positron emission tomography-computed tomography,PET-CT)在乳腺病变良恶性鉴别、乳腺癌临床分期和分子分型中的应用逐渐广泛。既往研究[2]显示,18F-FDG PET-CT的最大标准摄取值(SUVmax)、肿瘤代谢体积(MTV)及糖酵解总量(TLG)等代谢参数在评估乳腺癌临床分期和分子生物学特征等方面有重要作用,但上述研究未在乳腺癌精准病理学分型的基础上进行研究,且未关注PET-CT代谢参数与Ki-67的关系。本研究回顾性分析了35例共40个乳腺浸润性导管癌原发病灶的PET-CT代谢参数,并与分子生物学指标进行对比研究,进一步分析不同T分期、临床分期和淋巴结转移状态乳腺癌原发病灶的PET-CT代谢参数的差异,探讨PET-CT预测乳腺癌分子生物学特征和临床分期的价值。现作报道。
-
回顾性分析安徽医科大学第一附属医院2017年1月至2021年6月行18F-FDG PET-CT全身扫描的乳腺癌病人35例,共40个原发灶(其中2例为双侧乳腺癌,2例为单侧多发乳腺癌);病人均为女性,年龄23~87岁,中位年龄56岁。所有病人扫描前均无乳腺手术史或放化疗史,术后病理或穿刺结果证实为浸润性导管癌,所有病例均行ER、PR、HER-2和Ki-67病理学免疫组织化学分析,所有病人均按照第8版美国癌症联合委员会(AJCC)TNM分期标准进行T分期和临床分期。
-
18F-FDG显像剂购自南京江原安迪科正电子研究发展有限公司,放射化学纯度>95%。检查前病人空腹6 h以上,血糖 < 11.0 mmol/L,静脉注射18F-FDG(3.70~5.55 MBq/kg)后平卧休息50~60 min,随后使用德国西门子公司Biography 64 TruePoint PET-CT扫描仪进行图像采集。扫描范围:颅顶至股骨中段。PET成像使用3D模式采集,5~6个床位,每床位1.5 min,用CT图像进行衰减校正、迭代重建分别获得全身或局部冠状位、矢状位、横断位的CT、PET及融合图像。
-
由2名具有10年以上PET-CT诊断经验的医生对乳腺癌病灶进行测量、计算,存在分歧时通过协商取得一致性意见。将乳腺内18F-FDG摄取高于周围正常组织且除外腺体本身生理性摄取的病灶判定为乳腺癌原发灶,用MedEx后处理工作站软件通过迭代自适应算法测定勾画肿瘤边缘的阈值。工作站根据感兴趣区自动测量乳腺癌原发病灶的SUVmax、SUVmean和MTV,TLG=SUVmean×MTV(cm3)。对有腋窝淋巴结转移的病例,测量18F-FDG摄取最高的转移淋巴结的SUVmax。
-
肿瘤切除后经甲醛固定、无水乙醇脱水、石蜡包埋等步骤处理,随后进行ER、PR、HER-2和Ki-67的免疫组织化学检测。ER(+)或PR(+)定义为肿瘤组织切片内着色为棕黄色的阳性细胞核或细胞膜计数≥1%。HER-2(+)定义为着色为棕黄色的阳性细胞膜计数(3+),或棕黄色阳性细胞膜计数(2+)且荧光原位杂交(FISH)结果阳性。HER-2(-)定义为棕黄色细胞膜计数(1+)或(-),或棕黄色阳性细胞膜计数(2+)且FISH检测阴性。Ki-67计数仅将细胞核出现棕黄色颗粒定义为阳性,血管内皮阳性细胞不计在内。
-
采用独立样本t(或t′)检验、方差分析、Mann-Whitney U检验和Kruskal-Wallis秩和检验。绘制受试者工作特征(ROC) 曲线,计算曲线下面积(AUC),确定最佳临界值及其敏感性、特异性。采用Pearson相关性或Spearman相关性进行相关性分析。
-
35例共40个乳腺癌病灶均表现为乳腺内软组织结节或肿块,18F-FDG摄取较正常乳腺组织显著增高(见图 1~2)。40个乳腺癌病灶的SUVmax为6.53±2.43,SUVmean为3.96±1.52,MTV为14.50 cm3(5.27 cm3, 31.95 cm3),TLG为33.5 g(16.41 g,83.17 g)。
-
40个乳腺癌原发病灶中,PR(+)27个,PR(-)13个;ER(+)21个,ER(-)19个;HER-2(+)28个,HER-2(-)12个。PR(-)组SUVmax和MTV高于PR(+)组(P < 0.01和P < 0.05);ER(-)组的SUVmax、SUVmean、TLG和MTV均高于ER(+)组(P < 0.05~P < 0.01);HER-2(-)组MTV低于HER-2(+)组,差异有统计学意义(P < 0.05)(见表 1)。40个乳腺癌原发病例中T1~T2期共21例,T3~T4期共19例。T1~T2期肿瘤的SUVmax、SUVmean、TLG和MTV均小于T3~T4期(P < 0.05~P < 0.01);40个乳腺癌病灶中,有腋窝淋巴结转移的病例共26例,无淋巴结转移的病例共14例,有腋窝淋巴结转移组SUVmax,SUVmean和TLG均高于无腋窝淋巴结转移组(P < 0.05~P < 0.01)(见表 1)。40个乳腺癌原发病例临床分期Ⅱ期12例,Ⅲ期11例,Ⅳ期17例,Ⅳ期肿瘤的TLG值高于其他临床分期(P < 0.05),其他指标在不同临床分期病人中差异无统计学意义(P>0.05)(见表 2)。
临床病理指标 n SUVmax SUVmean MTV[M(Q25,Q75)]/cm3 TLG [M(Q25,Q75)]/g PR 阴性 23 8.38±2.19 4.16±1.69 67.8(42.4,243.0) 4.23(3.31,236) 阳性 17 5.45±2.91 3.30±1.49 19.2(14.6,53.2) 5.31(4.81, 16.00) t — 3.64 1.11 2.13* 1.99* P — < 0.01 >0.05 < 0.05 >0.05 ER 阴性 17 7.62±2.12 4.60±1.04 24.2(13.6, 136.6) 67.8(18.9,476.5) 阳性 23 4.83±1.73 2.96±1.08 5.31(4.81,14.9) 18.1(5.74,42.47) t — 4.58 4.82 2.40* 2.22* P — < 0.01 < 0.01 < 0.05 < 0.05 HER-2 阴性 19 5.67±2.56 3.24±1.40 4.98(1.66, 5.31) 9.87(2.51, 42.47) 阳性 21 7.17±2.58 4.14±1.80 16.01(7.71,115) 38.1(16.78,77.42) t — 1.84 0.83 2.04* 3.45* P — >0.05 >0.05 < 0.05 >0.05 T分期 T1~T2 21 5.20±1.90 3.11±1.31 4.97(2.61, 13.4) 17.68(5.20, 21.89) T3~T4 19 9.63±4.16 5.41±2.34 15.10(5.27,192.3) 66.69(25.5,529.5) t — 4.26△ 3.78△ 2.53* 3.60* P — < 0.01 < 0.01 < 0.05 < 0.01 淋巴结转移 有 26 9.91±3.77 7.36±3.75 6.39(3.50,21.69) 20.06(10.08,66.10) 无 14 5.14±2.41 2.96±1.07 9.37(4.43,15.97) 18.06(6.60,37.14) t — 4.27 5.58△ 0.11* 2.34* P — < 0.01 < 0.01 >0.05 < 0.05 *示zc值;△示t′值 表 1 乳腺癌原发灶PET-CT代谢参数与临床病理特征的关系(x±s)
临床分期 n SUVmax SUVmean MTV[M(Q25,Q75)] /cm3 TLG [M(Q25,Q75)]/g Ⅱ期 12 5.87±2.87 3.41±1.21 5.18(4.54,12.1) 18.6(13.8,24.9) Ⅲ期 11 7.93±2.56 4.50±1.25 17.8(6.24,95.3) 17.7(7.46,67.9) Ⅳ期 17 7.08±3.07 4.13±1.44 5.31(2.40,16.2) 32.9(15.6,374) F — 0.38 0.34 3.50* 6.55* P — >0.05 >0.05 >0.05 < 0.05 MS组内 — 28.400 9.080 — — *示Hc值 表 2 不同临床分期乳腺癌原发灶PET-CT代谢参数的比较(x±s)
-
对上述评估乳腺癌生物学特征、临床分期和淋巴结转移中存在统计学差异的代谢参数分别绘制ROC曲线并计算敏感性和特异性。在乳腺癌生物学特征的评估中,PR组SUVmax和MTV的ROC曲线见图 3A,AUC分别为0.792和0.688,SUVmax以6.18为临界值时,敏感性和特异性分别为85.7%和54.5%,MTV以11.7为临界值时,敏感性和特异性分别为71.7%和72.7%。ER组SUVmax、SUVmean、TLG和MTV的ROC曲线见图 3B,AUC分别为0.786、0.766、0.818和0.818,SUVmax以3.06为临界值时敏感性和特异性分别为63.6%和85.7%,SUVmean以6.75为临界值时,敏感性和特异性分别为79.8%和57.1%,TLG以47.5为临界值时,敏感性和特异性分别为63.6%和85.7%,MTV以10.5为临界值时,敏感性和特异性分别为90.0%和71.4%。HER-2组MTV的ROC曲线见图 3C,MTV以6.52为临界值时,敏感性和特异性分别为81.8%和85.7%。在乳腺癌临床分期的评估中、MTV和TLG鉴别乳腺癌临床分期的ROC曲线见图 3D,AUC分别为0.864和0.755,MTV以25.6为临界值时,敏感性和特异性分别为78.0%和89.0%,TLG以12.4为临界值时,敏感性和特异性分别为64.0%和77.0%。在淋巴结转移的评估中,SUVmax、SUVmean和TLG评估乳腺癌淋巴结转移的ROC曲线见图 3E,AUC分别为0.728、0.664和0.700,SUVmax以3.62为临界值时,敏感性和特异性分别为96.0%和60.0%,SUVmean以2.35为临界值时,敏感性和特异性分别为60.0%和70.0%,TLG以31.10为临界值时,敏感性和特异性分别为64.0%和70.0%。
-
40个乳腺癌原发病灶的SUVmax(r=0.783)、MTV(rs=0.868)与肿瘤Ki-67表达呈正相关关系(P < 0.01)。26例有腋窝淋巴结转移的病例中,腋窝淋巴结的SUVmax与相应肿瘤原发灶Ki-67表达呈正相关关系(r=0.857)(P < 0.01)。
-
SUV是临床应用最广泛的18F-FDG PET-CT半定量指标,通过描述病灶摄取显像剂与全身平均摄取显像剂之比反映肿瘤的恶性程度,SUV值越大提示肿瘤的侵袭性越强、预后越差[3]。在本研究中,ER(-)组和PR(-)组肿瘤的SUVmax值、SUVmean值显著高于ER(+)和PR(+)组,说明ER、PR表达阴性肿瘤的恶性程度可能高于表达阳性肿瘤。既往研究[4-5]显示,ER、PR表达阳性乳腺癌病人的无复发生存时间、总生存时间等预后指标均优于ER、PR表达阴性病人,本研究中ER(+)组、PR(+)组肿瘤恶性程度较低的结果与之相符。目前关于HER-2表达状态与18F-FDG摄取程度相关性的研究仍存在较大争议,鲁胜男等[6]对119例不同分子分亚的局部晚期乳腺癌的PET-CT定量研究显示,HER-2阳性型乳腺癌与luminal A型、luminal B/HER-2阳性、luminal B/HER-2阴性乳腺癌直接的SUVmax值差异均无统计学意义。本研究中SUV值在HER-2表达阴性和阳性病人中同样没有出现明显的差异,可能与样本量小及其临床分期各异有关。
虽然SUV能够预测乳腺癌的生物学特征,但它仅代表所选择目标肿瘤组织的代谢特征,不能反映肿瘤整体的异质性,因此SUVmax可能导致假阴性。通过综合评估肿瘤体积和功能代谢计算出的MTV、TLG等代谢体积参数可以评估肿瘤整体的代谢特点,且不受肿瘤组织内部囊变坏死区的影响,在临床的应用越来越广泛[7-8]。本研究中,ER(-)组乳腺癌病灶的TLG和MTV均高于ER(+)组,PR(-)组乳腺癌病灶的TLG高于PR(+)组,与既往研究[9]结果相符。本研究中HER-2(-)组与HER-2(+)组乳腺癌病人的MTV差异亦有统计学意义,与既往的文献[10]研究存在差异,原因可能是部分国外研究的样本量较大,且包含多种病理类型的乳腺癌,而本研究仅选择了Ⅱ~Ⅲ级的浸润性导管癌,病理类型和分级较为统一。此外,不同后处理软件设置的SUVmax阈值不同,也会影响MTV和TLG的测量。
-
PET-CT优于传统影像学检查方法之处是一次显像可同时对原发肿瘤和远处转移进行全身评估,从而在乳腺癌的临床分期中发挥重要作用。李艳等[11]研究发现PET-CT对乳腺癌的N分期和M分期诊断的准确率分别为87.92%和100%,在M分期诊断中具有不可取代的优势。还有学者[12]报道65例乳腺癌的TLG与肿瘤大小、分期、淋巴结转移等均存在显著相关性,且与肿瘤体积、Ki-67指数存在相关性。本研究发现T1~T2期与T3~T4期浸润性导管癌原发病灶的MTV、TLG差异有统计学意义,TLG在不同临床分期的浸润性导管癌病例中也表现出差异,与上述国内外研究结果一致,说明MTV、TLG在浸润性导管癌的临床分期中具有重要的作用。
-
能否利用PET-CT代谢参数的差异鉴别乳腺癌转移性与反应增生淋巴结性仍具有争议,部分文献认为PET-CT诊断腋窝淋巴结转移的特异度较高,但敏感度低于MRI检查,假阴性主要与原发乳腺癌病灶代谢不活跃、摄取18F-FDG程度不高有关[13]。但在本研究中,有腋窝淋巴结转移组的原发乳腺癌病灶SUVmax、SUVmean和TLG均显著高于无转移组,说明PET-CT具有鉴别浸润性导管癌转移性淋巴结的价值。浸润性导管癌的肿瘤细胞密集、代谢活跃,肿瘤摄取18F-FDG越高,说明肿瘤的恶程度越高、血供越丰富,发生淋巴结转移的可能性越大[14-15]。
-
Ki-67指数是检测肿瘤细胞增殖程度最重要的病理学指标之一,能够预测肿瘤的预后[16-17]。张倩等[18]研究发现,乳腺癌的Ki-67指数越大,表示肿瘤细胞增殖越活跃,细胞的能量代谢和耗氧量大幅度增加,从而导致乳腺癌肿瘤组织对葡萄糖摄取率增加,因此反映18F-FDG摄取率的PET-CT半定量指标SUVmax显著增大。MTV、TLG等代谢体积参数剔除了肿瘤组织内坏死区的影响,理论上可能比SUVmax更能够准确反映肿瘤的代谢特征。本研究结果显示,乳腺癌病灶的SUVmax和MTV均与Ki-67指数间存在较强的正相关性关系,与既往文献报道[19-20]一致。转移性淋巴结SUVmax与Ki-67指数间的正相关性提示浸润性导管癌的细胞增殖越活跃越容易发生淋巴结转移,说明淋巴结的SUVmax在乳腺癌临床分期中能够提供参考价值。
总之,18F-FDG PET-CT的SUVmax、MTV和TLG等代谢参数能够反映乳腺浸润性导管癌的分子生物学特征和肿瘤分期、腋窝淋巴结转移等临床特征,且与细胞增殖指数Ki-67存在正性相关关系,在术前指导乳腺癌临床治疗方案的制定并预后判断中具有主要的价值。
18F-FDG PET-CT评估乳腺浸润性导管癌临床及病理特征的研究
Study on the value of 18F-FDG PET-CT in the evaluation of the clinical and pathological features of invasive ductal carcinoma of breast
-
摘要:
目的评估18F-脱氧葡萄糖正电子发射计算机断层扫描(18F-FDG PET-CT)代谢参数与乳腺浸润性导管癌临床病理学特征的关系。 方法回顾性分析术前行18F-FDG PET-CT扫描且经病理学确诊为浸润性导管癌的40个病灶,测量最大标准摄取值(SUVmax)、平均标准摄取值(SUVmean)、肿瘤代谢体积(MTV)并计算糖酵解总量(TLG)。 结果40个浸润性导管癌中,孕激素受体(PR)(-)组SUVmax和MTV高于PR(+)组,雌激素受体(ER)(-)组SUVmax、SUVmean、MTV和TLG均高于ER(+)组,表皮生长因子受体-2(HER-2)(-)组MTV低于HER-2(+)组,T1~T2期肿瘤的SUVmax、SUVmean、TLG和MTV均小于T3~T4期,有腋窝淋巴结转移病例的SUVmax、SUVmean和TLG均高于无腋窝淋巴结转移病例(P < 0.05~P < 0.01)。原发灶的SUVmax、MTV与Ki-67表达呈正相关关系(P < 0.01)。腋窝淋巴结的SUVmax与原发灶Ki-67表达呈正相关关系(P < 0.01)。 结论18F-FDG PET-CT代谢参数能够评估乳腺浸润性导管癌的临床病理特征。 -
关键词:
- 乳腺肿瘤 /
- 体层摄影术 /
- 正电子发射计算机断层扫描 /
- 脱氧葡萄糖
Abstract:ObjectiveTo evaluate the relationship between the metabolic parameters of 18F-deoxyglucose positron emission computed tomography(18F-FDG PET-CT) and clinical and pathological characteristics of invasive ductal carcinoma of breast. MethodsThe clinical data of 40 primary lesions of invasive ductal carcinoma of breast diagnosed by pathology and scanned by 18F-FDG PET-CT before operation were retrospectively analyzed.The max of standardized uptake value(SUVmax), mean of standardized uptake value(SUVmean) and metabolic tumor volume(MTV) of lesions were measured, and the total lesion glycolysis(TLG) of lesions were calculated. ResultsThe SUVmax and MTV of the PR(-) group were higher than those of the PR(+) group.The SUVmax, SUVmean, TLG and MTV of the ER(-) group were higher than those of the ER(+) group.The MTV of the HER-2(-) group was lower than that of HER-2(+) group, the SUVmax, SUVmean, TLG and MTV of the stage T1-T2 tumors were less than those of the stage T1-T2 tumors, and the SUVmax, SUVmean, TLG and MTV in cases with axillary lymph node metastasis were higher than those in cases without axillary lymph node metastasis(P < 0.05 to P < 0.01).The SUVmax and MTV were positively correlated with the expression of Ki-67 in primary lesions(P < 0.01).The SUVmax of axillary lymph nodes was positively correlated with the expression of Ki-67 in the primary lesions(P < 0.01). ConclusionsThe 18F-FDG PET-CT metabolic parameters can evaluate the biological and clinical characterstics of invasive ductal carcinoma of breast. -
表 1 乳腺癌原发灶PET-CT代谢参数与临床病理特征的关系(x±s)
临床病理指标 n SUVmax SUVmean MTV[M(Q25,Q75)]/cm3 TLG [M(Q25,Q75)]/g PR 阴性 23 8.38±2.19 4.16±1.69 67.8(42.4,243.0) 4.23(3.31,236) 阳性 17 5.45±2.91 3.30±1.49 19.2(14.6,53.2) 5.31(4.81, 16.00) t — 3.64 1.11 2.13* 1.99* P — < 0.01 >0.05 < 0.05 >0.05 ER 阴性 17 7.62±2.12 4.60±1.04 24.2(13.6, 136.6) 67.8(18.9,476.5) 阳性 23 4.83±1.73 2.96±1.08 5.31(4.81,14.9) 18.1(5.74,42.47) t — 4.58 4.82 2.40* 2.22* P — < 0.01 < 0.01 < 0.05 < 0.05 HER-2 阴性 19 5.67±2.56 3.24±1.40 4.98(1.66, 5.31) 9.87(2.51, 42.47) 阳性 21 7.17±2.58 4.14±1.80 16.01(7.71,115) 38.1(16.78,77.42) t — 1.84 0.83 2.04* 3.45* P — >0.05 >0.05 < 0.05 >0.05 T分期 T1~T2 21 5.20±1.90 3.11±1.31 4.97(2.61, 13.4) 17.68(5.20, 21.89) T3~T4 19 9.63±4.16 5.41±2.34 15.10(5.27,192.3) 66.69(25.5,529.5) t — 4.26△ 3.78△ 2.53* 3.60* P — < 0.01 < 0.01 < 0.05 < 0.01 淋巴结转移 有 26 9.91±3.77 7.36±3.75 6.39(3.50,21.69) 20.06(10.08,66.10) 无 14 5.14±2.41 2.96±1.07 9.37(4.43,15.97) 18.06(6.60,37.14) t — 4.27 5.58△ 0.11* 2.34* P — < 0.01 < 0.01 >0.05 < 0.05 *示zc值;△示t′值 表 2 不同临床分期乳腺癌原发灶PET-CT代谢参数的比较(x±s)
临床分期 n SUVmax SUVmean MTV[M(Q25,Q75)] /cm3 TLG [M(Q25,Q75)]/g Ⅱ期 12 5.87±2.87 3.41±1.21 5.18(4.54,12.1) 18.6(13.8,24.9) Ⅲ期 11 7.93±2.56 4.50±1.25 17.8(6.24,95.3) 17.7(7.46,67.9) Ⅳ期 17 7.08±3.07 4.13±1.44 5.31(2.40,16.2) 32.9(15.6,374) F — 0.38 0.34 3.50* 6.55* P — >0.05 >0.05 >0.05 < 0.05 MS组内 — 28.400 9.080 — — *示Hc值 -
[1] SINGH S, RAGHAVAN B, GEETHAPRIYA S, et al. PET-CT upstaging of unilateral operable breast cancer and its correlation with molecular subtypes[J]. Indian J Radiol Imaging, 2020, 30(3): 319. doi: 10.4103/ijri.IJRI_59_20 [2] PAYDARY K, SERAJ SM, ZADEH MZ, et al. The evolving role of FDG-PET/CT in the diagnosis, staging, and treatment of breast cancer[J]. Mol Imaging Biol, 2019, 21(1): 1. doi: 10.1007/s11307-018-1181-3 [3] 胡永全, 袁超, 陶新全, 等. 18F-FDG PET/CT检测卵巢癌术后CA125升高病人转移或复发的临床分析[J]. 蚌埠医学院学报, 2020, 45(9): 1163. [4] 母予馨, 张频, 马飞, 等. 乳腺癌原发灶和转移灶受体表达的异质性及其临床意义[J]. 中华肿瘤杂志, 2018, 40(7): 506. doi: 10.3760/cma.j.issn.0253-3766.2018.07.005 [5] 汤泊, 张银, 周锦, 等. 18F-FDG PET-CT代谢参数与乳腺癌临床病理特征的关系[J]. 中华肿瘤杂志, 2017, 39(4): 280. doi: 10.3760/cma.j.issn.0253-3766.2017.04.008 [6] 鲁胜男, 冯彦林, 李雯, 等. 局部晚期乳腺癌18F-FDG PET/CT显像和分子分型与预后相关性研究[J]. 中华肿瘤防治杂志, 2019, 26(5): 324. [7] GARCIA-VICENTE AM, PÉREZ-BETETA J, PÉREZ-GARCÍA VM, et al. Metabolic tumor burden assessed by dual time point 18F-FDG PET/CT in locally advanced breast cancer: relation with tumor biology[J]. Mol Imaging Biol, 2017, 19(4): 636. doi: 10.1007/s11307-016-1034-x [8] QU YH, LONG N, RAN C, et al. The correlation of 18F-FDG PET/CT metabolic parameters, clinicopathological factors, and prognosis in breast cancer[J]. Clin Transl Oncol, 2021, 23(3): 620. doi: 10.1007/s12094-020-02457-w [9] 牛增志. 乳腺癌原发灶18F-FDG PET-CT代谢参数与患者临床病理特征的关系研究[J]. 中国CT与MRI杂志, 2019, 17(4): 79. [10] HIGUCHI T, NISHIMUKAI A, OZAWA H, et al. Prognostic significance of preoperative 18F-FDG PET/CT for breast cancer subtypes[J]. Breast, 2016, 30: 5. doi: 10.1016/j.breast.2016.08.003 [11] 李艳, 代永亮, 张卫善, 等. 18F-FDG PET/CT在乳腺癌诊断和分期中的应用价值[J]. 实用放射学杂志, 2019, 35(9): 1436. doi: 10.3969/j.issn.1002-1671.2019.09.014 [12] EGE AKTAS G, TAŞTEKIN E, SARIKAYA A. Assessment of biological and clinicalaggressiveness of invasive ductal breast cancer using baseline 18F-FDG PET/CT derived volumetric parameters[J]. Nucl Med Commun, 2018, 39(1): 83. doi: 10.1097/MNM.0000000000000779 [13] BORM KJ, VOPPICHLER J, DVSBERG M, et al. FDG/PET-CT-based lymph node atlas in breast cancer patients[J]. Int J Radiat Oncol Biol Phys, 2019, 103(3): 574. doi: 10.1016/j.ijrobp.2018.07.2025 [14] 阳宁静, 任静, 李吉满. 乳腺癌Ⅰ、Ⅱ组淋巴结Ki-67定性、定量表达差异及相关分析[J]. 蚌埠医学院学报, 2018, 43(9): 1125. [15] AN YS, KANG DK, JUNG Y, et al. Volume-based metabolic parameter of breast cancer on preoperative 18F-FDG PET/CT could predict axillary lymph node metastasis[J]. Medicine(Baltimore), 2017, 96(45): e8557. [16] 宋旗, 胡友庭, 杨泳, 等. 乳腺癌组织细胞核增殖抗原的异常表达与病理特征相关性[J]. 中华实验外科杂志, 2020, 37(2): 317. [17] AN YS, KANG DK, JUNG Y, et al. Hormone receptor, human epidermal growth factor receptor-2, and Ki-67 status in primary breast cancer and corresponding recurrences or synchronous axillary lymph node metastases[J]. Surg Today, 2020, 50(7): 657. doi: 10.1007/s00595-019-01831-8 [18] 张倩, 辛军, 李红, 等. 18F-FDG PET/CT显像半定量参数MTV、TLG联合SUV在乳腺癌诊断中的应用价值[J]. 中国临床医学影像杂志, 2016, 27(9): 620. [19] ARSLAN E, CAN TRABULUS D, MERMUT Ö, et al. Alternative volumetric PET parameters for evaluation of breast cancer cases with 18F-FDG PET/CT imaging: Metabolic tumour volume and total lesion glycolysis[J]. J Med Imaging Radiat Oncol, 2021, 65(1): 38. doi: 10.1111/1754-9485.13114 [20] ORSARIA P, CHIARAVALLOTI A, CAREDDA E, et al. Evaluation of the usefulness of FDG-PET/CT for nodal staging of breast cancer[J]. Anticancer Res, 2018, 38(12): 6639. doi: 10.21873/anticanres.13031 -




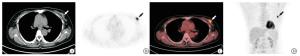
 下载:
下载: