-
直肠癌是临床常见的消化道恶性肿瘤[1-2]。随着近年来社会老龄化及饮食生活习惯的改变,直肠癌发病率逐年上升,严重威胁病人的生活质量[3]。是否存在淋巴结转移(lymph nodes metastasis, LNM)对于直肠癌的手术方式的选择、放化疗疗效具有重要影响,也是直肠癌最重要的预后因素之一[4-5]。因此,术前准确评估直肠癌淋巴结转移对于病人治疗方案的制订及预后评估具有重要的临床意义[6]。本文旨在分析多层螺旋CT(multi-spiral computed tomography, MSCT)在术前无创性评估直肠癌淋巴结转移风险的价值,为临床制定合理的治疗策略提供帮助。现作报道。
-
收集我院2016年12月至2022年1月在我院经手术病理证实的41例直肠癌病人的临床病理及影像学资料。其中男23例,女18例;年龄43~88岁。病理显示病灶侵犯局限于黏膜内2例,侵犯黏膜下2例,侵犯浅肌层1例,深肌层13例,侵犯浆膜层19例,突破浆膜4例。共检出390枚淋巴结,其中良性淋巴结330枚,恶性淋巴结60枚。将纳入病人按照有无淋巴结转移分为淋巴结转移(LNM+)组14例和无淋巴结转移(LNM-)组27例。
-
采用统一GE Optima680 128层螺旋CT扫描仪进行平扫和增强扫描,空腹8 h以上,检查前2 h口服等渗甘露醇(2.5%甘露醇250 mL加温水1 750 mL)2000 mL,检查前10 min肌肉注射山莨菪碱(654-2)20 mg。管电流为仪器自动设定毫安秒,管电压120 kV,旋转时间0.5 s,层厚5 mm,间距5 mm,矩阵512×512,视野350 mm×350 mm。先行CT平扫,后经肘前静脉注射碘帕醇对比剂1.5 mL/kg,速率3 mL/s增强扫描,动脉期25~30 s,静脉期60~70 s,延迟期120 s。CT重建层厚0.625 mm,重建层间距0.625 mm。所有CT图像数据上传至工作站进行后处理。
-
采集图像由2名具有5~10年以上腹部肿瘤放射诊断经验的中级和高级职称放射医生,采用双盲法在工作站上进行评估。主要分析的影像学指标包括:肿瘤位置(低、中、高);肿块距肛门距离(cm);病灶长度(cm);侵犯范围(< 1/2周长、≥1/2周长);生长方式(壁增厚型、增厚-肿块型、肿块型);强化方式(均匀、不均匀);强化程度(轻度、中度、重度);浸润深度(黏膜-肌层、浆膜层/突破浆膜层);T分期(T1~2、T3、T4);肿瘤平扫CT值;肿瘤CTmax值;CT增强差值(CTmax-平扫CT值);CT增强率(CTmax值-平扫CT值)/平扫CT值×100%);淋巴结短径(≥0.5 cm、 < 0.5 cm)。当诊断意见不一致时,请第三位高年资医生协商统一后决定。
-
采用t检验、χ2检验和logistic回归分析及ROC曲线分析。
-
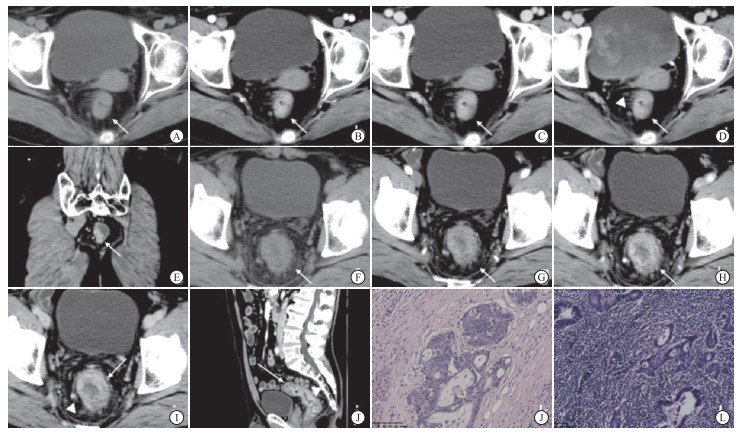
年龄、性别、肿瘤位置、肿块距肛门距离、病灶长度、生长方式、强化方式、强化程度、浸润深度、T分期、平扫CT值、CTmax值、CT增强率在LNM-组和LNM+组间差异均无统计学意义(P>0.05),而侵犯范围、CT增强差值、淋巴结短径在2组间差异均有统计学意义(P < 0.05~P < 0.01)(见表 1)。2组典型病例见图 1。
参数 LNM-组(n=27) LNM+组(n=14) χ2 P 年龄(x±s)/岁 66.30±9.57 69.43±11.61 0.92△ >0.05 性别 女
男10(37.0)
17(63.0)8(57.1)
6(42.9)1.51 >0.05 肿瘤位置 低 8(29.6) 4(28.6) 中 8(29.6) 5(35.7) 0.17 >0.05 高 11(40.8) 5(35.7) 肿块距肛门距离(x±s)/cm 7.57±3.02 7.23±2.61 0.36△ >0.05 病灶长度(x±s)/cm 4.42±1.70 4.95±1.07 1.07△ >0.05 侵犯范围 < 1/2周长
≥1/2周长13(48.1)
14(51.9)2(14.3)
12(85.7)4.56 < 0.05 生长方式 壁增厚型 16(59.3) 9(64.3) 增厚-肿块型 9(33.3) 5(35.7) 1.09 >0.05 肿块型 2(7.4) 0(0) 强化方式 均匀
不均匀25(92.6)
2(7.4)13(92.9)
1(7.1)0.001 >0.05 强化程度 轻度 3(11.2) 0(0) 中度 12(44.4) 5(35.7) 2.43 >0.05 重度 12(44.4) 9(64.3) 浸润深度 黏膜-肌层 7(25.9) 4(28.6) 浆膜层 19(70.4) 8(57.1) 1.68 >0.05 突破浆膜层 1(3.7) 2(14.3) T分期/期 T1~2 7(25.9) 4(28.6) T3 19(70.4) 8(57.1) 1.68 >0.05 T4 1(3.7) 2(14.3) 平扫CT值(x±s) 43.00±10.94 41.43±7.87 0.48△ >0.05 CTmax值(x±s) 83.26±10.75 91.29±15.49 1.95△ >0.05 CT增强差值(x±s) 40.26±9.41 49.86±16.54 2.38△ < 0.05 CT增强率(x±s) 1.02±0.40 1.28±0.60 1.66△ >0.05 淋巴结短径(x±s) < 0.5 cm
≥0.5 cm18(66.7)
9(33.3)2(14.3)
12(85.7)10.12 < 0.01 △示t值 表 1 2组病人临床及CT影像特征[n;百分率(%)]
-
将单因素分析中有统计学意义的指标进一步纳入多因素分析中,结果显示,CT增强差值和淋巴结短径均为直肠癌淋巴结转移的独立危险因素(P < 0.05)(见表 2)。Kappa一致性分析显示,侵犯范围、生长方式、强化方式、强化程度的一致性为优(Kappa值均>0.8);在浸润深度和T分期的评估中的一致性为良好(Kappa值0.61~0.8)。
变量 B SE Waldχ2 P OR(95%CI) 侵犯范围(< 1/2周长) -2.170 1.355 2.57 >0.05 0.114(0.008~1.625) CT增强差值 0.116 0.047 6.03 < 0.05 1.123(1.024~1.232) 淋巴结短径(≥0.5 cm) 2.812 1.182 5.66 < 0.05 16.637(1.639~169.851) 表 2 直肠癌淋巴结转移风险的logistic多因素回归分析
-
将CT增强差值和淋巴结短径纳入ROC曲线分析,结果显示,CT增强差值的AUC(95%CI)、cut-off值、敏感度、特异度分别为0.665(0.501~0.805)、59 Hu、28.57%、100%;淋巴结短径的AUC(95%CI)、敏感度、特异度分别为0.762(0.603~0.881)、85.71%、66.67%;二者联合的AUC(95%CI)、敏感度、特异度得到提高,分别为0.868(0.725~0.953)、78.57%、81.48%。
-
直肠癌淋巴结转移不仅是直肠癌主要的转移方式,同时也是直肠癌预后不良的重要独立危险因素之一。有无淋巴结转移病人的临床分级和治疗方案也有明显区别[3]。根据美国国立综合癌症网络发布的指南,当出现淋巴结转移时直肠癌分级由Ⅱ期上升为Ⅲ期[8]。另外,当病人出现淋巴结转移时,在手术后需要进一步化学治疗,而对于无高危因素的淋巴结转移阴性的病人仅需要根治性手术治疗即可[6, 8]。因此,术前精准评估直肠癌淋巴结转移对于病人的临床分级、治疗方案制订及预后评估具有重要价值。目前,术前常用于直肠癌淋巴结转移评估的影像学手段包括CT、MRI和PET-CT,然而目前最优的检查及评估方式尚无统一定论[4, 9-10]。
MSCT检查是临床最为常用、检查费用相对较低的一种影像学检查,目前在基层医院已经得到广泛应用。既往研究[11]显示,CT成像对于直结肠癌具有较高的诊断准确率,但仍存在一定的误诊率及漏诊率。随着多排螺旋CT的不断发展和普及,其在直肠癌的诊断和TNM分期中的应用价值日益受到关注[12]。既往CT主要通过单独评估淋巴结的大小和形态来评估,对于肿瘤增强CT值及直肠癌形态、侵犯等整体征象的研究较少。既往研究[13]常以淋巴结短径5~10 mm作为转移性淋巴结的阈值。本研究以5 mm为淋巴结短径的阈值,结果表明,当CT图像中显示的淋巴结短径>5 mm时,病人出现淋巴结转移的风险时明显增加,预测的敏感度较高为85.71%,但特异度相对较低,仅为66.67%。这表明CT显示的淋巴结大小对淋巴结转移风险预测具有较好的提示作用,但缺陷在于较高的假阳性率存在,这与既往的研究[14]结果类似。笔者认为,放射科医生在观察淋巴结大小的同时,需要结合其他指标进一步进行更为精准的评估,不能盲目武断地单独根据淋巴结短径进行转移风险评估,以免误导临床医生,造成更大的手术创伤。本研究经多因素分析显示,淋巴结的CT强化差值也是淋巴结转移的独立影响因素,当肿瘤增强后的CT差值大于59 HU时,淋巴结转移的风险明显提高。尽管这项指标敏感度较低,但其特异度为100%,这一方面可以很好地弥补假阳性率较高的淋巴结短径。进一步将两种指标进行联合,结果显示,二者联合的预测效能大大提升,AUC值可达0.868,而敏感性及特异性均有提升,分别达78.57%和81.48%。笔者认为,在进行直肠癌淋巴结转移风险的评估时,不仅需要观察淋巴结的大小,同时应该关注肿瘤本身的形态、强化等特征,尽量结合多种CT特征进行更为精准的评估,当存在有2种独立危险因素时可以进一步提高诊断的准确性。
此外,既往有学者提出CT图像中的淋巴结形态及强化方式可能与淋巴结转移相关。ROLLVÉN等[15]研究显示,CT的形态学征象,包括强化不均匀和形态不规则,对于直肠癌病人的淋巴结转移具有一定提示作用。张瑜等[16]研究显示,结直肠癌CT增强时淋巴结出现强化不均匀或者边界不规则有可能是预测淋巴结转移的风险因素。然而,本研究中CT提示的强化方式、侵犯范围、强化程度均无统计学意义,推测可能与本研究样本量相对较少且为单中心样本导致。
本研究尚存在一定不足:(1)回顾性研究存在一定的选择偏倚,同时样本量相对较少,且为单中心实验,需要今后更大样本量的前瞻性研究进一步验证结论;(2)将样本分为有无转移淋巴结2组,并未将CT提示的淋巴结与病理上的淋巴结一一对比,今后需要开展更加精细化的实验研究,以揭示CT征象与淋巴结转移病理之间的更多联系;(3)并未使用影像组学或深度学习等进行深入分析和预测模型的建立,未来将进一步扩大样本量,利用多种AI技术进行更加精准的风险预测模型的建立。
综上,术前MSCT的特征,包括淋巴结短径及肿瘤CT增强差值,均为直肠癌淋巴结转移的独立影响因素,联合不同CT特征将进一步提高淋巴结转移风险预测的效能。
基于MSCT特征在术前预测直肠癌淋巴结转移风险的价值研究
The study on the value of MSCT characteristics in preoperative prediction of the risk of lymph node metastasis of rectal cancer
-
摘要:
目的探讨术前多层螺旋CT(multi-spiral computed tomography, MSCT)影像学征象在评估直肠癌淋巴结转移中的应用价值。 方法回顾性分析41例经手术病理证实的直肠癌病人的影像及临床病理资料,所有病人均在术前进行MSCT扫描。根据淋巴结有无转移分为淋巴结转移(LNM+)组14例和无淋巴结转移(LNM-)组27例,分析2组临床指标及CT特征差异。 结果41例直肠癌病人共检出390枚淋巴结,其中良性330枚,恶性60枚。2组肿块侵犯范围、CT增强差值和淋巴结短径差异均有统计学意义(P < 0.05)。Logistic多因素回归分析显示,CT增强差值和淋巴结短径均为直肠癌淋巴结转移的独立影响因素(P < 0.05)。CT增强差值、淋巴结短径和二者联合预测直肠癌淋巴结转移的AUC分别为0.665、0.762、0.868。 结论术前MSCT特征,包括淋巴结短径及CT增强差值均为直肠癌淋巴结转移的独立影响因素,联合不同CT影像学特征可进一步提高术前直肠癌淋巴结转移风险预测的效能。 Abstract:ObjectiveTo explore the application value of preoperative multi-spiral computed tomography(MSCT) imaging features in the evaluation of lymph node metastasis of rectal cancer. MethodsThe imaging and clinicopathological data of 41 patients with rectal cancer confirmed by surgical pathology were analyzed retrospectively.All patients underwent MSCT scan before surgery.According to lymph node metastasis, they were divided into lymph node metastasis group(LNM+, 14 cases) and non-lymph node metastasis group(LNM-, 27 cases).The differences of clinical and CT features between the two groups were analyzed. ResultsA total of 394 lymph nodes were detected in 41 patients with rectal cancer, including 362 benign lymph nodes and 32 malignant lymph nodes.The range of tumor invasion, CT enhancement differences and short diameter of lymph nodes were statistically significant between the two groups(P < 0.05).Multivariate regression analysis showed that CT enhancement differences(OR=1.123) and short diameter of lymph nodes(OR=16.637) were independent risk factors for lymph node metastasis of rectal cancer.The AUC of CT enhancement differences, lymph node short diameter and combination parameters were 0.665, 0.762 and 0.868, respectively. ConclusionsPreoperative MSCT features, including short diameter of lymph node and CT enhancement differences, are independent risk factors for lymph node metastasis of rectal cancer.Combination the two CT imaging features will further improve the efficacy of preoperative prediction of lymph node metastasis of rectal cancer. -
Key words:
- rectal neoplasms /
- computer tomography /
- lymph node metastasis
-
表 1 2组病人临床及CT影像特征[n;百分率(%)]
参数 LNM-组(n=27) LNM+组(n=14) χ2 P 年龄(x±s)/岁 66.30±9.57 69.43±11.61 0.92△ >0.05 性别 女
男10(37.0)
17(63.0)8(57.1)
6(42.9)1.51 >0.05 肿瘤位置 低 8(29.6) 4(28.6) 中 8(29.6) 5(35.7) 0.17 >0.05 高 11(40.8) 5(35.7) 肿块距肛门距离(x±s)/cm 7.57±3.02 7.23±2.61 0.36△ >0.05 病灶长度(x±s)/cm 4.42±1.70 4.95±1.07 1.07△ >0.05 侵犯范围 < 1/2周长
≥1/2周长13(48.1)
14(51.9)2(14.3)
12(85.7)4.56 < 0.05 生长方式 壁增厚型 16(59.3) 9(64.3) 增厚-肿块型 9(33.3) 5(35.7) 1.09 >0.05 肿块型 2(7.4) 0(0) 强化方式 均匀
不均匀25(92.6)
2(7.4)13(92.9)
1(7.1)0.001 >0.05 强化程度 轻度 3(11.2) 0(0) 中度 12(44.4) 5(35.7) 2.43 >0.05 重度 12(44.4) 9(64.3) 浸润深度 黏膜-肌层 7(25.9) 4(28.6) 浆膜层 19(70.4) 8(57.1) 1.68 >0.05 突破浆膜层 1(3.7) 2(14.3) T分期/期 T1~2 7(25.9) 4(28.6) T3 19(70.4) 8(57.1) 1.68 >0.05 T4 1(3.7) 2(14.3) 平扫CT值(x±s) 43.00±10.94 41.43±7.87 0.48△ >0.05 CTmax值(x±s) 83.26±10.75 91.29±15.49 1.95△ >0.05 CT增强差值(x±s) 40.26±9.41 49.86±16.54 2.38△ < 0.05 CT增强率(x±s) 1.02±0.40 1.28±0.60 1.66△ >0.05 淋巴结短径(x±s) < 0.5 cm
≥0.5 cm18(66.7)
9(33.3)2(14.3)
12(85.7)10.12 < 0.01 △示t值 表 2 直肠癌淋巴结转移风险的logistic多因素回归分析
变量 B SE Waldχ2 P OR(95%CI) 侵犯范围(< 1/2周长) -2.170 1.355 2.57 >0.05 0.114(0.008~1.625) CT增强差值 0.116 0.047 6.03 < 0.05 1.123(1.024~1.232) 淋巴结短径(≥0.5 cm) 2.812 1.182 5.66 < 0.05 16.637(1.639~169.851) -
[1] BONIFACIO C, VIGANO L, FELISAZ P, et al. Diffusion-weighted imaging and loco-regional N staging of patients with colorectal liver metastases[J]. Eur J Surg Oncol, 2019, 45(3): 347. doi: 10.1016/j.ejso.2018.11.018 [2] MENG X, XIA W, XIE P, et al. Preoperative radiomic signature based on multiparametric magnetic resonance imaging for noninvasive evaluation of biological characteristics in rectal cancer[J]. Eur Radiol, 2019, 29(6): 3200. doi: 10.1007/s00330-018-5763-x [3] LEE HG, KIM SJ, PARK IJ, et al. Effect of Responsiveness of Lymph Nodes to Preoperative Chemoradiotherapy in Patients With Rectal Cancer on Prognosis After Radical Resection[J]. Clin Colorectal Cancer, 2019, 18(2): e191. doi: 10.1016/j.clcc.2019.03.001 [4] CHEN Y, WEN Z, MA Y, et al. Metastatic lymph node calcification in rectal cancer: comparison of CT and high-resolution MRI[J]. JPN J Radiol, 2021, 39(7): 642. doi: 10.1007/s11604-021-01108-6 [5] PEACOCK O, CHANG GJ. The Landmark Series: Management of Lateral Lymph Nodes in Locally Advanced Rectal Cancer[J]. Ann Surg Oncol, 2020, 27(8): 2723. doi: 10.1245/s10434-020-08639-8 [6] WILLIAMSON JS, QUYN AJ, SAGAR PM. Rectal cancer lateral pelvic sidewall lymph nodes: a review of controversies and management[J]. Br J Surg, 2020, 107(12): 1562. doi: 10.1002/bjs.11925 [7] SUN H, ZHANG S, LIU K, et al. MRI-based nomogram estimates the risk of recurrence of primary nonmetastatic pancreatic neuroendocrine tumors after curative resection[J]. J Magn Reson Imaging, 2019, 50(2): 397. doi: 10.1002/jmri.26603 [8] LI J, SHIOMI A. Lateral lymph node dissection in advanced low rectal cancer treatment[J]. Int J Colorectal Dis, 2021, 36(11): 2361. doi: 10.1007/s00384-021-03975-x [9] HEMACHANDRAN N, GOYAL A, BHATTACHARJEE HK, et al. Radiology of anal and lower rectal cancers[J]. Clin Radiol, 2021, 76(12): 871. doi: 10.1016/j.crad.2021.06.007 [10] YANG X, CHEN Y, WEN Z, et al. Non-invasive MR assessment of the microstructure and microcirculation in regional lymph nodes for rectal cancer: a study of intravoxel incoherent motion imaging[J]. Cancer Imaging, 2019, 19(1): 70. doi: 10.1186/s40644-019-0255-z [11] 欧文, 胡宇, 阮俊. 超声内镜联合MSCT检查对结直肠癌术前TNM分期诊断价值研究[J]. 中国CT和MRI杂志, 2021, 19(01): 167. [12] 田卫兵, 袁春兰. 低剂量CT灌注成像在直肠癌诊断中的应用[J]. 中国CT和MRI杂志, 2021, 19(05): 103. [13] 王唯成, 李睿, 陈天武, 等. 多层螺旋CT对结肠癌术前淋巴结转移诊断价值的研究[J]. 国际医学放射学杂志, 2018, 41(05): 542. [14] 肖翠丽, 杨强, 李艳彩. 多层螺旋CT与剪切波超声弹性成像对直肠癌淋巴结转移的预测价值[J]. 医学影像学杂志, 2020, 30(11): 2138. [15] ROLLVÉN E, BLOMQVIST L, ÖISTÄMÖ E, et al. Morphological predictors for lymph node metastases on computed tomography in colon cancer[J]. Abdom Radiol(NY), 2019, 44(5): 1712. [16] 张瑜, 侯炜寰, 张广文, 等. 增强CT的形态学特征在预测结直肠癌淋巴结转移中的价值研究[J]. 临床放射学杂志, 2020, 39: 2018. -





 下载:
下载: