-
肝癌是最常见的恶性肿瘤之一,严重威胁着人类的健康。研究[1]表明近年来其发病率逐渐上升,在美国其每年新发病例超过42 000例,预计死亡病例约30000例,且在发展中国家保持着较高的发病率。肝癌治疗的常用手段有手术治疗和非手术治疗,其中手术切除是首选的治疗方式[2]。但很多病人在肿瘤发现时即处于终末状态, 手术已无意义, 即便能够通过外科手术去干预切除, 约2/3的病人仍然会出现复发转移[3]。近年来, 放化疗以及靶向治疗和免疫治疗等方面取得很大进展, 但由于其高侵袭性、转移、复发等因素, 肝癌病人预后仍相对较差[4]。因此进一步探究肝癌的发病机制,寻找新的潜在的治疗靶点和预后相关因素,对于提高肝癌病人的生存率,改善其生活质量至关重要。人类NOP2核仁蛋白(NOP2 nucleolar protein, NOP2)也被称为RNA甲基转移酶家族成员2(RNA methyltransferase 2, NSUN2),是SUN结构域家族成员之一,其是在mRNA和非编码RNA中通过共价键催化5-甲基胞嘧啶M5C形成的主要酶[5-7]。既往已有研究[8-9]证实NOP2可促进小鼠成纤维细胞生长和肿瘤的形成,在多种肿瘤如头颈部鳞癌、结肠癌、口腔癌、食管癌、胃癌、肝癌、胰腺癌和乳腺癌细胞及组织中高表达,发挥重要作用,但在正常组织中不表达。因此NOP2目前被证实可作为一种预测肿瘤预后的标志物。本研究旨在通过生物信息学分析,探究NOP2在肝癌发生及进展过程中的作用及其相关通路,进一步研究其对于肝癌病人预后的预测价值,为肝癌的临床治疗提供相关思路和策略。
-
从TCGA数据库(https://portal.gdc.cancer.gov/)下载497例肝癌病例(肿瘤样本497例。癌旁样本54例)的RNA序列数据和486例临床特征的相应数据。
-
肿瘤微环境中每个样本的免疫成分的比率以3个分数的形式表示:ImmuneScore、StormalScore和ESTIMATEScore,这3个分数由ESTIMATE算法(R语言版本4.0.2)实现。分数越高,肿瘤免微环境中相应成分的比例越大。
-
使用R语言中的Survminer包执行生存分析。在497例病人中,477例肿瘤样本具有详细的生存信息,能够纳入生存分析。生存曲线采用Kaplan-Meier法绘制,采用对数秩检验作为检验方式,P < 0.05时认为差异有统计学意义。
-
根据ImmuneScore和StormalScore的中位数,将497例肿瘤标本分为高、低表达2组。使用limma软件包进行差异分析,通过比较高表达组和低表达组样本生成DEGs。log2(高表达组/低表达组)变化>1的DEGs和错误发现率(FDR) < 0.05时认为差异具有统计学意义。
-
DEGs的热图由R语言和pheatmap软件包生成。
-
与肝癌样本对应的临床数据从TCGA下载。根据R软件中比较的临床分期,采用Wilcoxon秩和检验或Kruskal-Wallis秩和检验进行显著性检验。
-
GSEA采用软件GSEA-4.1.0(从BroadInstitute下载)Hallmark作为目标集(从Molecular SignaturesDatabase下载)。所有纳入样本,NOM的P < 0.05时认为差异有统计学意义。
-
采用CIBERSORT计算方法估算所有肿瘤样本中肿瘤浸润免疫细胞的分布,并进行质量筛选,P < 0.05时认为差异有统计学意义,纳入研究。该数据均下载自TCGA数据库(https://portal.gdc.cancer.gov)。
-
从蚌埠医学院第一附属医院2021年6月至2022年6月行肝切除术的原发性肝癌病人中获得的10对石蜡切片对癌巢及相邻癌旁组织进行qRT-PCR试验。根据厂家说明书,使用TRIzol试剂提取总RNA,合成cDNA,采用2-△△Ct方法进行qRT-PCR计算。相关引物显示如下: NOP2, F: 5′-AAG GGT GCC GAG ACA GAA CT-3′,R: 5′-GAG CAC GAC TAG ACA GCC TC-3′; β-actin, F: 5′-CTC GCC TTT GCC GAT CC-3′,R: 5′-TTC TCC ATG TCG TCC CAG TT-3′。本研究获得蚌埠医学院第一附属医院机构研究伦理委员会批准。
-
所有统计分析和绘图均使用R软件(版本4.0.2)或GraphPad Prism(版本8.0.1)完成。Student′s t检验用于比较基因的表达差异。Spearman相关分析用于评估NOP2表达水平与各种免疫相关细胞表达之间的关系。生存分析基于Kaplan Meier方法,P < 0.05被认为有统计学意义。
-
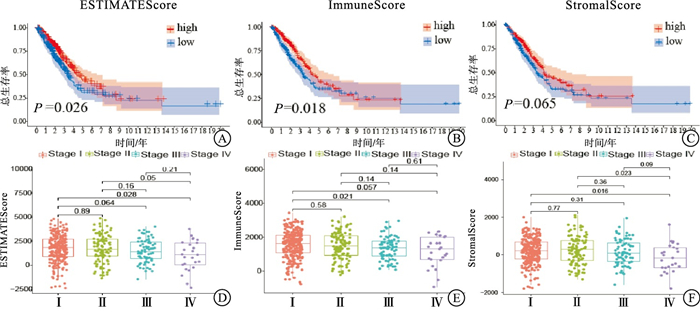
采用Kaplan-Meier生存分析计算ESTIMATEScore、ImmuneScore和StormalScore,以确定估计评分与肝癌病人生存期之间的关系。较高的ESTIMATEScore表明肿瘤微环境中的相应成分含量较多,ESTIMATEScore是两种成分的总和,代表所有免疫相关成分的综合百分比。结果显示,ESTIMATEScore和ImmuneScore与肝癌病人的总生存率呈负相关(P < 0.05)(见图 1A、1B);而StormalScore与肝癌病人总生存率无显著相关性(P>0.05)(见图 1C)。
-
在T1与T2、T3、T4分期方面,ESTIMATEScore和ImmuneScore表现出较大的相关性(P < 0.05);M分期方面,ESTIMATEScore、ImmuneScore和StormalScore均呈明显正相关(见图 1D~1F)。
-
将差异表达基因分为高评分组和低评分组,随后进行比较分析。交叉的结果显示,共有3个上调基因和3个下调基因与免疫评分和基质评分均相关。
-
将所有的肝癌病人样本分为高表达组和低表达组,通过生存分析结果表明,NOP2与肝癌病人的生存率表现出明显相关性,NOP2高表达组的生存期低于低表达组(P < 0.01)(见图 2A),此外,Wilcoxon秩和检验的结果显示,NOP2在肝癌肿瘤样本中的表达明显高于癌旁组织样本(见图 2B)。
-
GSEA结果显示NOP2的高表达与部分免疫活动相关,如肿瘤坏死因子介导的信号通路、辅助T细胞分化的调控、CD4+T细胞分化调控和自然杀伤(NK)细胞活化的调控等(见图 3A),因此本研究进一步探究NOP2与肿瘤微环境之间的关系。在肝癌样本中有15种免疫细胞在肿瘤和邻近组织之间呈现明显不同的表达水平(见图 3B),然后进行免疫细胞相关分析,共有15个免疫细胞与NOP2的表达相关。在差异表达的免疫细胞和相关细胞交叉后,最终获得了11个与肿瘤微环境相关的免疫细胞(见图 4A)。6种免疫细胞与NOP2表达呈正相关,包括M0巨噬细胞、静止期NK细胞、激活期CD4+记忆T细胞、CD8+ T细胞、滤泡辅助性T细胞、调节性T细胞(Treg)。5种免疫细胞与NOP2的表达水平呈负相关,包括记忆B细胞、嗜酸性粒细胞、M2巨噬细胞、单核细胞、休止期CD4+记忆T细胞(见图 4B~4L)。
-
结果显示, NOP2在癌组织中高表达(1.137±0.02),在癌旁组织中低表达(0.443±0.03),差异有统计学意义(t= 25.41,P < 0.01)。
-
虽然目前对于肝癌的病理分级、临床分期和治疗方案有一套成熟的国际指南,但对于每个肝癌病人的个体化最佳治疗方案,仍有许多问题未得到解决,手术肝切除作为早期肝癌的重要治疗方案,但其仍然存在一定的局限性,如病灶不可切除、术后复发、肿瘤转移等[10]。但大多数病人在诊断时已属中晚期,病情复杂,预后差,目前我国肝癌病人5年总体生存率不足15%[11]。近年来,针对肝癌的靶向联合免疫治疗取得了一系列积极进展。如晚期肝癌病人常用靶向联合免疫药物如索拉非尼、仑伐替尼以及PD-1单抗,然而,鉴于肝癌的异质性,只有不到30%的病人从该疗法中获益,并且其耐药性明显[12]。基于此,我们迫切需要寻找新的治疗和潜在的预测靶点,从而对小分子抑制剂、单克隆抗体和表观遗传因子的进一步研究提供方案,对于延长肝癌病人生存时间以及改善晚期肝癌病人生活质量至关重要。
目前,肿瘤微环境作为癌症治疗的起点,发挥着重要作用,寻找和探索与特定肿瘤相关的肿瘤微环境机制,改变肿瘤微环境状态,可为未来肿瘤治疗提供新的潜在靶点[13]。本研究目的在于从TCGA数据库中寻找与肿瘤微环境相关的基因,从而帮助预测肝癌病人的临床特征。本研究结果表明肿瘤微环境中的免疫组分与肝癌病人的生存表现出明显的相关性,较晚的M分期与较高的免疫评分相关,因此可推断肿瘤微环境中的免疫基质和免疫成分可促进肝癌的恶性生物学行为如转移和侵袭等。经过一系列生物信息学分析,最终NOP2被认为是一个潜在的与肝癌发生发展相关的基因,其表达与肝癌病人的生存率表现出明显的相关性。Wilcoxon秩和检验的结果表明,NOP2在肝癌肿瘤样本中的表达明显高于癌旁组织样本,与在同一病人的癌旁组织和肿瘤组织之间的配对分析结果一致。从而证明肿瘤微环境中NOP2的表达水平与肝癌病人的生存时间呈负相关。
前期研究[14]表明,NOP2与细胞增殖、干细胞分化和人类癌症有关,Frye和Watt首先描述了NOP2在细胞增殖中的作用,认为NOP2是细胞增殖状态的关键调控因子,他们发现NOP2的表达在MYC激活后明显升高,并能够调控整个细胞周期,使细胞周期发生显著的变化。在肿瘤恶性程度方面,NOP2基因拷贝数在口腔癌和结直肠癌中明显增加且呈高表达状态,认为NOP2参与肿瘤的发生与发展。在宫颈癌中,tRNA修饰酶因子NOP2和METTL1,参与宫颈癌HeLa细胞的增殖、侵袭与转移,并增强了宫颈癌HeLa细胞对氟尿嘧啶化疗的敏感性[15]。在胆囊癌中,高表达的NOP2通过调控转录下游因子RPL6,在体内外均促进胆囊癌的增殖、侵袭与转移,并参与胆囊癌的致瘤功能[16]。在干细胞分化方面,lncRNA-mPvt1是一种癌胎儿RNA,被发现可促进细胞增殖、细胞循环和小鼠细胞干细胞样特性的表达。利用高通量芯片和质谱分析技术筛选出lncRNA-hPVT1在原发性肝癌组织中表达上调,且lncRNA-hPVT1高表达与病人临床预后不良相关,NOP2作为lncRNA-hPVT1结合的RNA结合上游蛋白,LncRNA-hPVT1通过上调NOP2的表达,从而促进肿瘤增殖、肝细胞分化、肝再生,在肝转移中发挥了极其重要的作用[17]。在透明细胞型肾癌中,NOP2在透明细胞型肾癌中呈高表达,且与病人的不良预后相关,因此认为核仁蛋白NOP2可作为一种潜在的治疗靶点[18]。在前列腺癌中,长链非编码RNALINC00963在前列腺癌组织中增加,促进了PCa细胞的体外迁移和体内转移,LINC00963通过结合miR-542-3p调控上皮细胞间质转化,从而促进核仁蛋白NOP2的表达。与此同时,NOP2作为白细胞介素(IL)-6的特异性受体,IL-6和IGF-I在高表达的NOP2受体中具有高效的协同作用,进一步阐述了IL-6与NOP2在人类骨髓瘤细胞中受体交叉对话的信号机制[19]。本研究进一步探索了NOP2在肝癌肿瘤微环境中的免疫学作用,结果表明NOP2可对11种肿瘤微环境中的免疫细胞产生影响,其中6种免疫细胞与NOP2表达呈正相关,包括M0巨噬细胞、静止期NK细胞、激活期CD4+记忆T细胞、CD8+ T细胞、滤泡辅助性T细胞、Treg。5种免疫细胞与NOP2的表达水平呈负相关,包括记忆B细胞、嗜酸性粒细胞、M2巨噬细胞、单核细胞、休止期CD4+记忆T细胞。这些结果进一步证实了NOP2参与肝癌肿瘤微环境中的免疫反应性调节。
综上所述,采用ESTIMATE算法挖掘出与肝癌肿瘤微环境相关的基因,证实NOP2是肝癌病人的潜在预后基因。更重要的是证实了NOP2可参与调节肝癌肿瘤微环境中的免疫细胞的数量。但本研究仍然存在一定的局限性,NOP2发挥调节作用的分子机制仍需进一步探索,且进一步的实验验证也是非常有必要的。本研究证实了NOP2对于肝癌的预后价值,为肝癌的临床治疗提供新的思路,进而有助于改善肝癌病人的预后,提高其生存质量。
基于生物信息学NOP2在肝癌中的预后价值研究
Prognostic value of NOP2 in liver cancer based on bioinformatics
-
摘要:
目的基于生物信息学探究NOP2核仁蛋白(NOP2 nucleolar protein,NOP2)在肝癌预后中的价值。 方法采用CIBERSORT和ESTIMATE计算方法,计算497例(其中54例有癌旁组织)肝癌病人的肿瘤浸润免疫细胞(TICs)的两个主要评分。通过Cox回归分析寻找出差异表达基因(DEGs)。同时进一步收集蚌埠医学院第一附属医院行肝切除术的原发性肝癌病人10对癌组织及相邻癌旁组织进行qRT-PCR分析。 结果NOP2的表达水平与肝癌的病理特征(较晚的M分期)呈正相关,与病人的生存时间呈负相关。通过基因集富集分析(GSEA)发现NOP2高表达的基因主要富集于与免疫相关通路。进一步研究证实6种免疫细胞与NOP2表达呈正相关,包括M0巨噬细胞、静止期自然杀伤细胞、激活期CD4+记忆T细胞、CD8+T细胞、滤泡辅助性T细胞、调节性T细胞。5种免疫细胞与NOP2的表达水平呈负相关,包括记忆B细胞、嗜酸性粒细胞、M2巨噬细胞、单核细胞、休止期CD4+记忆T细胞。且qRT-PCR显示NOP2在肝癌中呈高表达,在癌旁呈低表达。 结论NOP2在肝癌中呈高表达,且与生存时间成负相关,其表达水平可有助于预测肝癌病人的预后,尤其是对于肿瘤微环境中免疫相关细胞的影响。 Abstract:ObjectiveTo explore the value of NOP2 in the prognosis of liver cancer based on bioinformatics. MethodsTwo main scores of tumor infiltrating immune cells (TICs) were calculated by CIBERSORT and ESTIMATE in 497 patients with liver cancer, 54 of whom had paracancerous tissue. The differentially expressed genes (DEGs) were found by Cox regression analysis. At the same time, qRT-PCR analysis was performed on 10 primary liver cancer patients undergoing hepatectomy in the First Affiliated Hospital of Bengbu Medical College. ResultsThe expression of NOP2 was positively correlated with the pathological features of liver cancer(late M stage) and negatively correlated with the survival time of patients. Through gene set enrichment analysis(GSEA), it was found that the genes with high NOP2 expression were mainly enriched in immune-related pathways. Further study confirmed that there was a positive correlation between the expression of NOP2 and six kinds of immune cells, which included M0 macrophages, resting natural killer cells, activated CD4+ memory T cells, CD8+ T cells, follicular helper T cells, and regulatory T cells. The expression of NOP2 was negatively correlated with the expression of five types of immune cells, including memory B cells, eosinophil granulocyte cells, M2 macrophages, monocytes, and resting CD4+ memory T cells. Moreover, qRT-PCR showed that NOP2 was highly expressed in liver cancer and low expression in adjacent tissues. ConclusionsNOP2 is highly expressed in liver cancer and negatively correlated with survival time. The expression of NOP2 may be helpful to predict the prognosis of liver cancer patients, especially to the influence of immune-related cells in tumor microenvironment. -
Key words:
- liver neoplasms /
- NOP2 /
- tumor microenvironment
-
[1] SIEGEL RL, MILLER KD, FUCHS HE, et al. Cancer Statistics[J]. CA Cancer J Clin, 2021, 71(1): 7. doi: 10.3322/caac.21654 [2] 刘文斌, 荚卫东. 《原发性肝癌诊疗规范(2019年版)》解读[J]. 肝胆外科杂志, 2020, 28(6): 468. [3] 郑中显, 潘明. 阿帕替尼联合替吉奥用于初始治疗失败后晚期肝癌的疗效及安全性分析[J]. 蚌埠医学院学报, 2020, 45(7): 917. doi: 10.13898/j.cnki.issn.1000-2200.07.020 [4] 杨楠, 陈天翔, 刘润坤, 等. 长链非编码RNA LINC00319在肝细胞癌中表达上调并促进肝癌细胞迁移和侵袭[J]. 蚌埠医学院学报, 2022, 47(2): 152. [5] CUI W, PIZZOLLO J, HAN Z, et al. Nop2 is required for mammalian preimplantation development[J]. Mol Reprod Dev, 2016, 83(2): 124. doi: 10.1002/mrd.22600 [6] FRYE M, BLANCO S. Post-transcriptional modifications in development and stem cells[J]. Development, 2016, 143(21): 3871. doi: 10.1242/dev.136556 [7] YANG X, YANG Y, SUN BF, et al. 5-methylcytosine promotes mRNA export - NSUN2 as the methyltransferase and ALYREF as an m5C reader[J]. Cell Res, 2017, 27(5): 606. doi: 10.1038/cr.2017.55 [8] MA P, PAN Y, LI W, et al. Extracellular vesicles-mediated noncoding RNAs transfer in cancer[J]. J Hematol Oncol, 2017, 10(1): 57. doi: 10.1186/s13045-017-0426-y [9] LU L, ZHU G, ZENG H, et al. High tRNATransferase NSUN2 gene expression is associated with poor prognosis in head and neck squamous carcinoma[J]. Cancer Invest, 2018, 36(4): 246. doi: 10.1080/07357907.2018.1466896 [10] OKAMOTO M, HIRATA S, SATO S, et al. Frequent increased gene copy number and high protein expression of tRNA (cytosine-5-)-methyltransferase (NSUN2) in human cancers[J]. DNA Cell Biol, 2012, 31(5): 660. doi: 10.1089/dna.2011.1446 [11] ZENG H, CHEN W, ZHENG R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555. doi: 10.1016/S2214-109X(18)30127-X [12] EL-SERAG HB, MARRERO JA, RUDOLPH L, et al. Diagnosis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2008, 134(6): 1752. doi: 10.1053/j.gastro.2008.02.090 [13] LIU CY, CHEN KF, CHEN PJ. Treatment of liver cancer[J]. Cold Spring Harb Perspect Med, 2015, 5(9): a021535. doi: 10.1101/cshperspect.a021535 [14] MA L, HERNANDEZ MO, ZHAO Y, et al. Tumor cell biodiversity drives microenvironmental reprogramming in liver cancer[J]. Cancer Cell, 2019, 36(4): 418. doi: 10.1016/j.ccell.2019.08.007 [15] OKAMOTO M, FUJIWARA M, HORI M, et al. tRNA modifying enzymes, NSUN2 and METTL1, determine sensitivity to 5-fluorouracil in HeLa cells[J]. PLoS Genet, 2014, 10(9): e1004639. doi: 10.1371/journal.pgen.1004639 [16] GAO Y, WANG Z, ZHU Y, et al. NOP2/Sun RNA methyltransferase 2 promotes tumor progression via its interacting partner RPL6 in gallbladder carcinoma[J]. Cancer Sci, 2019, 110(11): 3510. [17] WANG F, YUAN JH, WANG SB, et al. Oncofetal long noncoding RNA PVT1 promotes proliferation and stem cell-like property of hepatocellular carcinoma cells by stabilizing NOP2[J]. Hepatology, 2014, 60(4): 1278. doi: 10.1002/hep.27239 [18] WANG G, QU F, LIU S, et al. Nucleolar protein NOP2 could serve as a potential prognosticpredictor for clear cell renal cell carcinoma[J]. Bioengineered, 2021, 12(1): 4841. doi: 10.1080/21655979.2021.1960130 [19] ABROUN S, ISHIKAWA H, TSUYAMA N, et al. Receptor synergy of interleukin-6 (IL-6) and insulin-like growth factor-I in myeloma cells that highly express IL-6 receptor alpha[corrected][J]. Blood, 2004, 103(6): 229. -





 下载:
下载: