-
虽然近年来我国宫颈癌的死亡率大幅下降,但作为女性常见的恶性肿瘤,我国每年宫颈癌新发病例仍高达13.15万,每年约5.3万女性死于宫颈癌[1]。顺铂作为宫颈癌经典的化疗药物,在单药化疗、联合其他药物化疗或同步放化疗的应用中都显示出对宫颈癌病人的有益作用[2]。自噬广泛参与宫颈癌的发生、发展、药物耐受等[3],有学者[4]报道顺铂对HeLa人宫颈癌细胞自噬具有诱导作用,但顺铂对宫颈癌自噬的调节及其可能机制仍值得深入探索。本研究从顺铂对HeLa人宫颈癌细胞中Nrf2入核影响的角度,探讨顺铂通过增加Nrf2的核转位促进细胞自噬相关的细胞凋亡抑制HeLa细胞生长和迁移的可能机制。
-
顺铂(Sigma-Aldrich公司,货号: P4394);MEM培养基(美国Thermo Fisher Scientific公司,货号: 11095072);胎牛血清(美国Thermo Fisher Scientific公司,货号: 10099);细胞消化液(美国Thermo Fisher Scientific公司,货号: 12605010);青霉素-链霉素(美国Thermo Fisher Scientific公司,货号: 15070063);噻唑蓝(MTT)(上海碧云天生物技术有限公司,货号: ST316);结晶紫染色液(上海碧云天生物技术有限公司,货号: C0121);mCherry-GFP-LC3B融合蛋白腺病毒(上海碧云天生物技术有限公司,货号: C3011);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,货号: C1062M);DAPI染色液(上海碧云天生物技术有限公司,货号: C1006);细胞核蛋白与细胞质蛋白抽提试剂盒(上海碧云天生物技术有限公司,货号: P0027);GAPDH兔多克隆抗体(武汉三鹰生物技术有限公司,货号: 10494-1-AP);Nrf2兔多克隆抗体(武汉三鹰生物技术有限公司,货号: 16396-1-AP);LaminB1兔多克隆抗体(武汉三鹰生物技术有限公司,货号: 12987-1-AP);HRP-标记的山羊抗兔IgG(武汉三鹰生物技术有限公司,货号: SA00001-2);Fluorescein(FITC)-标记的山羊抗兔IgG(武汉三鹰生物技术有限公司,货号: SA00003-2);其他试剂为分析纯,购自国药集团化学试剂有限公司。
-
高速低温离心机(德国Sartorius公司,型号: Centrisart® D-16C);光学显微镜(日本Olympus公司,型号: IX83);荧光显微镜(德国Leica公司,型号: AF6000);酶标仪(美国Thermo Fisher Scientific公司,型号: Multiskan FC);流式细胞仪(美国BD公司,型号: Accuri® C6 Plus);电泳电源(美国Bio-Rad公司,型号: PowerPac Basic);垂直电泳/转膜槽(美国Bio-Rad公司,型号: Mini-PROTEAN Tetra);凝胶成像系统(美国Bio-Rad公司,型号: BIO-RAD Gel Doc XR+)。
-
HeLa人宫颈癌细胞株(产品目录号: TCHu187)购买于中国科学院典型培养物保藏委员会细胞库。使用MEM培养基(90%)和胎牛血清(10%)配制完全培养基,在95%空气和5%CO2的37 ℃培养箱中培养HeLa人宫颈癌细胞。细胞生长至80%亚融合状态时,胰酶消化,分瓶继续培养。所有实验使用细胞复苏后4~6代的HeLa人宫颈癌细胞。实验分组: 对照组、顺铂2.5 μmol/L组、顺铂5 μmol/L组及顺铂10 μmol/L组。
-
取HeLa细胞,计数后用MEM完全培养基稀释,使细胞密度为1×105个/毫升,将细胞接种于96孔板,每孔5 000个细胞,每组10个复孔,共4组,12 h细胞贴壁后弃去原培养液,各组加入含有对应浓度顺铂的完全培养基200 μL,对照组加入MEM完全培养基200 μL,培养24 h后,每孔加入20 μL MTT(5 mg/mL)试剂,培养4 h后,吸弃培养液,加入150 μL二甲基亚砜,摇床震荡10 min后,使用酶标仪在490 nm波长下测定吸光值(OD)。将对照组的细胞存活率定义为100%,细胞活性=给药组OD值/对照组OD值×l00%。
-
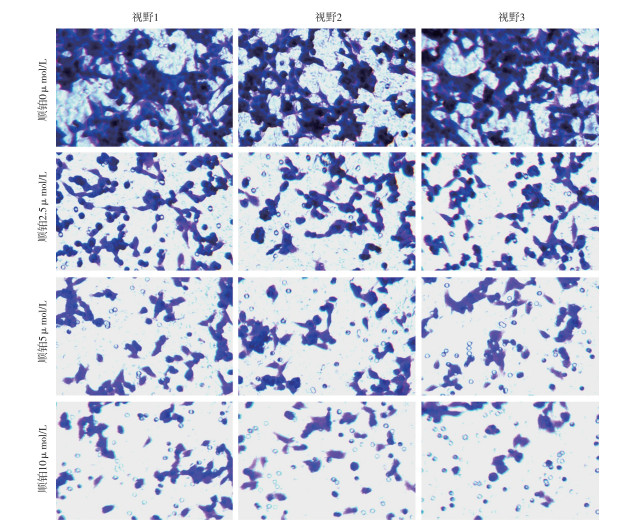
用含有不同浓度顺铂(0、2.5、5、10 μmol/L)的单培养基将HeLa细胞孵育24 h后,收集各组细胞并计数,混匀于MEM单培养基中。Transwell小室上室中加入各组细胞5 000个,每组6个重复,Transwell小室下室中加入含10%胎牛血清的MEM完全培养基,上室底部浸入下室完全培养基。培养24 h后,4%多聚甲醛浸泡Transwell上室固定细胞30 min,PBS缓冲液清洗2次,使用结晶紫染色液染色5 min,再次清洗2次,使用棉签擦去Transwell上室内侧细胞,将小室置于载玻片上,使用倒置光学显微镜,对Transwell上室外(下)侧的细胞进行拍照。
-
参考mCherry-GFP-LC3B融合蛋白腺病毒使用说明书,对HeLa细胞进行转染,6孔板中放入细胞爬片,并接种HeLa细胞,每组1块6孔板。细胞生长至50%融合时加入1.2 mL单培养液,并加入腺病毒,培养24 h。之后弃去所有培养液并更换为完全培养液后,继续培养24 h。各组加入含有对应浓度顺铂的完全培养基2 mL,对照组加入MEM完全培养基2 mL,培养24 h。4%多聚甲醛固定细胞30 min,PBS缓冲液清洗2次后,取出细胞爬片,覆盖在载玻片上后,使用荧光显微镜观察mCherry-GFP-LC3B的荧光强度并拍照。
-
用含有不同浓度顺铂(0、2.5、5、10 μmol/L)的单培养基将HeLa细胞孵育24 h后,收集各组细胞。参考Annexin V-FITC细胞凋亡检测试剂盒说明书检测HeLa细胞的凋亡率。将5~10万重悬细胞离心弃上清后,加入195 μL Annexin V-FITC结合液,再加入5 μL Annexin V-FITC,混匀后加入10 μL碘化丙啶(PI)染色液,孵育20 min,放入流式细胞仪样本架,设置仪器通道后检测并导出结果。
-
用含有不同浓度顺铂(0、2.5、5、10 μmol/L)的完全培养基将HeLa细胞孵育24 h后,收集各组细胞至新EP管内。使用细胞核蛋白与细胞浆蛋白提取试剂盒分别提取HeLa细胞的膜蛋白核核蛋白,BCA法测定蛋白浓度。蛋白变性后,取等质量总蛋白(30 μg)进行SDS-PAGE电泳。之后将凝胶上的蛋白转移至PVDF膜。PVDF膜使用封闭液封闭2 h。对于提取的细胞质内的蛋白,在封闭后孵育抗体GAPDH(1∶5 000)和Nrf2(1∶500),对于提取的细胞核内的蛋白,在封闭后孵育抗体LaminB1(1∶5 000)和Nrf2(1∶500),4 ℃过夜后洗膜3次。HRP标记的山羊抗兔IgG(1∶10 000)孵育2 h后,再次洗膜3次。使用凝胶成像系统化学发光成像并保存印迹图片。
-
6孔板放入细胞爬片,并接种HeLa细胞,每组1块6孔板。用含有不同浓度顺铂(0、2.5、5、10 μmol/L)的完全培养基孵育24 h后,4%多聚甲醛固定细胞30 min,PBS缓冲液清洗2次,加入Nrf2(1∶100)抗体4 ℃孵育过夜。PBS缓冲液清洗2次,加入FITC标记的山羊抗兔IgG(1∶500)孵育2 h后,再次使用PBS清洗2次,加入DPAI染细胞核5 min。使用PBS清洗细胞3次,取出细胞爬片,覆盖在载玻片上,使用荧光显微镜观察Nrf2的荧光强度并拍照。
-
采用方差分析和q检验。
-
与对照组相比,2.5、5、10 μmol/L的顺铂均可抑制HeLa细胞的活性及细胞迁移能力(P < 0.05),且随着药物浓度增高抑制作用增强(P < 0.05)(见图 1、表 1)。
分组 细胞存活率/%(ni=10) 迁移细胞数/个(ni=6) 对照组 100.0±5.6 213.0±14.5 顺铂2.5 μmol/L组 75.5±4.1* 107.0±9.9* 顺铂5.0 μmol/L组 63.0±4.3*# 83.7±6.1*#▲ 顺铂10.0 μmol/L组 40.6±4.6*#▲ 59.5±7.1*#▲ F 281.72 279.04 P < 0.01 < 0.01 MS组内 21.847 98.391 q检验: 与对照组比较*P < 0.05;与顺铂2.5 μmol/L组比较#P < 0.05;与顺铂5.0 μmol/L组比较▲P < 0.05 表 1 顺铂对HeLa人宫颈癌细胞的细胞活性及迁移能力的影响(x±s)
-
使用mCherry-GFP-LC3B融合蛋白腺病毒转染HeLa细胞,采用荧光显微镜观察自噬相关蛋白LC3B的表达情况,结果显示,与对照组相比,2.5、5、10 μmol/L的顺铂均可促进HeLa细胞中LC3B的表达(P < 0.05)(见图 2、表 2)。使用流式细胞术检测各组HeLa细胞的凋亡情况,结果显示,与对照组相比,2.5、5、10 μmol/L的顺铂均可促进HeLa细胞的凋亡(P < 0.05)(见图 2、表 2)。
分组 GFP-LC3B阳性面积/% mCherry-LC3B阳性面积/% 细胞凋亡率/% 对照组 5.4±1.5 3.2±1.8 7.3±0.2 顺铂2.5 μmol/L组 22.0±1.4* 20.4±1.5* 20.6±0.2* 顺铂5.0 μmol/L组 22.9±1.8* 22.1±1.6* 63.1±0.6*# 顺铂10.0 μmol/L组 29.5±3.6*#▲ 28.1±3.2*#▲ 68.4±0.3*#▲ F 126.62 150.25 44 835.04 P < 0.01 < 0.01 < 0.01 MS组内 5.004 4.552 0.124 q检验: 与对照组比较*P < 0.05;与顺铂2.5 μmol/L组比较#P < 0.05;与顺铂5.0 μmol/L组比较▲P < 0.05 表 2 顺铂对HeLa细胞自噬及凋亡的影响(ni=6;x±s)
-
免疫蛋白印迹结果显示,与对照组相比,2.5、5、10 μmol/L的顺铂均可降低HeLa细胞的细胞质中Nrf2的蛋白表达水平(P < 0.05),并升高细胞核中Nrf2的蛋白表达水平(P < 0.05)(见图 3A、表 3)。使用免疫荧光法观察各组细胞中Nrf2的入核情况,结果显示,与对照组相比,2.5、5、10 μmol/L的顺铂均可促进HeLa人宫颈癌细胞的中Nrf2的核转位(P < 0.05)(见图 3B、表 3)。
分组 细胞质Nrf2蛋白相对表达水平 细胞质Nrf2蛋白相对表达水平 细胞核内Nrf2荧光强度(总光密度) 对照组 3.7±0.3 1.1±0.1 411.0±30.3 顺铂2.5 μmol/L 2.2±0.1* 2.2±0.1* 1 438.7±69.0* 顺铂5.0 μmol/L 2.2±0.2* 3.9±0.2*# 1 730.5±37.5*# 顺铂10.0 μmol/L 1.1±0.1*#▲ 3.9±0.3*# 2 163.3±57.9*#▲ F 219.46 351.79 1 278.08 P < 0.01 < 0.01 < 0.01 MS组内 0.031 0.032 2 607.613 q检验: 与对照组比较*P < 0.05;与顺铂2.5 μmol/L组比较#P < 0.05;与顺铂5.0 μmol/L组比较▲P < 0.05 表 3 顺铂对HeLa细胞中Nrf2表达的影响(ni=6;x±s)
-
研究[5-6]表明,癌细胞中Nef2的激活可促进癌症的进展和转移,并且会导致化疗和放疗敏感性的降低[7-8]。Nrf2在肿瘤中具有刺激肿瘤细胞增殖、抑制肿瘤细胞凋亡、增强肿瘤细胞复制潜力和肿瘤血管生产、增强肿瘤细胞对组织的侵袭和转移、促进炎症和增加基因突变等作用[9]。Nrf2在癌症中广泛的作用表明靶向Nrf2可能是治疗肿瘤的有效方法,如Nrf2的抑制剂可用于癌症治疗[9]。未来Nrf2可能会成为癌症的预后指标和治疗靶点。
研究[10]显示Nrf2的高表达会增加肿瘤细胞的抗氧化能力,核内Nrf2高表达宫颈癌细胞具有增加的恶性潜能,Nrf2可能是宫颈癌病人预后不良的标志。有学者[11]报道,宫颈癌病变程度的升级增加Nrf2的核水平,并增强肿瘤细胞抗氧化反应中下游蛋白的表达。此外,有研究[12]证实辣椒素通过抑制宫颈癌细胞中Nrf2的表达抑制宫颈癌细胞的迁移与侵袭。本研究结果显示,顺铂作用于HeLa人宫颈癌细胞后,细胞核中的Nrf2蛋白水平升高,但降低了细胞质中的Nrf2水平。作为宫颈癌常用的化疗药物,顺铂对各类肿瘤的作用被广泛报道,包括其对宫颈癌细胞的抑制作用[13]。本研究结果还表明,顺铂对HeLa细胞的生长与迁移具有抑制作用,这些结果与前人的报道相一致。
关于顺铂通过抑制Nrf2调节HeLa人宫颈癌细胞生长与迁移的潜在机制,本研究主要关注了顺铂对HeLa人宫颈癌细胞自噬依赖性的细胞凋亡的影响。据报道[14],自噬在化疗药物发挥作用中有重要的作用。有证据[15-16]显示,宫颈癌细胞中自噬作用的增强促进了宫颈癌细胞的凋亡,但也有研究[17-18]证实阻断自噬增加了耐药宫颈癌细胞对顺铂的敏感性。本研究结果显示,顺铂促进HeLa细胞的自噬并增加细胞凋亡。
综上,顺铂通过增加HeLa人宫颈癌细胞中Nrf2入核促进细胞自噬和细胞凋亡,并抑制细胞的活性和迁移能力。
顺铂通过增加HeLa人宫颈癌细胞中Nrf2入核促进细胞自噬和凋亡
Cisplatin increases nuclear translocation of Nrf2 and promotes autophagy and apoptosis in HeLa human cervical cancer cells
-
摘要:
目的探讨顺铂对HeLa人宫颈癌细胞中Nrf2蛋白表达及核转位的影响,并观察细胞自噬和凋亡的变化。 方法使用不同浓度的顺铂(0、2.5、5、10 μmol/L)干预HeLa人宫颈癌细胞,MTT法检测细胞活性,Transwell实验观察细胞迁移能力,mCherry-GFP-LC3B融合蛋白腺病毒转染HeLa细胞观察自噬水平的变化,流式细胞术检测细胞凋亡水平,免疫蛋白印迹检测Nrf2在细胞质和细胞核内的表达情况,免疫荧光法观察Nrf2的核转位情况。 结果与对照组相比,2.5、5、10 μmol/L的顺铂均可抑制HeLa细胞的活性及细胞迁移能力(P < 0.05),且随着药物浓度增高抑制作用增强(P < 0.05)。与对照组相比,2.5、5、10 μmol/L的顺铂均可促进HeLa细胞中LC3B的表达、细胞凋亡及Nrf2的核转位(P < 0.05), 降低细胞质中Nrf2的蛋白表达水平(P < 0.05),并升高细胞核中Nrf2的蛋白表达水平(P < 0.05)。 结论顺铂通过增加HeLa人宫颈癌细胞中Nrf2入核促进细胞自噬和细胞凋亡,并抑制细胞的活性和迁移能力。 -
关键词:
- HeLa人宫颈癌细胞 /
- 顺铂 /
- Nrf2 /
- 自噬 /
- 细胞凋亡
Abstract:ObjectiveTo investigate the effect of cisplatin on the protein expression and nuclear translocation of Nrf2, and on the changes of autophagy and apoptosis in HeLa human cervical cancer cells. MethodsAfter the HeLa human cervical cancer cells were treated with different concentrations of cisplatin(0, 2.5, 5 and 10 μmol/L), MTT assay was used to detect the cell activity, Transwell assay was used to observe the cell migration ability, mCherry-GFP-LC3B fusion protein adenovirus transfected HeLa cells were applied to observe the autophagy changes, flow cytometry was employed to detect the apoptosis, Western blotting was used to detect the expression of Nrf2 in the cytoplasm and nucleus, and immunofluorescence staining was used to observe the nuclear translocation of Nrf2. ResultsCompared with the control group, 2.5, 5 and 10 μmol/L cisplatin could inhibit the activity and migration ability of HeLa cells(P < 0.05), and the inhibitory effect increased with the increase of drug concentration(P < 0.05).Compared with the control group, 2.5, 5 and 10 μmol/L cisplatin could promote the expression of LC3B, apoptosis and nuclear translocation of Nrf2 in HeLa cells(P < 0.05), reduce the protein expression level of Nrf2 in the cytoplasm(P < 0.05), and increase the protein expression level of Nrf2 in the nucleus(P < 0.05). ConclusionsCisplatin promotes autophagy and apoptosis by increasing nuclear translocation of Nrf2 in HeLa human cervical cancer cells, and inhibits cell viability and migration ability. -
Key words:
- HeLa human cervical cancer cells /
- cisplatin /
- Nrf2 /
- autophagy /
- apoptosis
-
表 1 顺铂对HeLa人宫颈癌细胞的细胞活性及迁移能力的影响(x±s)
分组 细胞存活率/%(ni=10) 迁移细胞数/个(ni=6) 对照组 100.0±5.6 213.0±14.5 顺铂2.5 μmol/L组 75.5±4.1* 107.0±9.9* 顺铂5.0 μmol/L组 63.0±4.3*# 83.7±6.1*#▲ 顺铂10.0 μmol/L组 40.6±4.6*#▲ 59.5±7.1*#▲ F 281.72 279.04 P < 0.01 < 0.01 MS组内 21.847 98.391 q检验: 与对照组比较*P < 0.05;与顺铂2.5 μmol/L组比较#P < 0.05;与顺铂5.0 μmol/L组比较▲P < 0.05 表 2 顺铂对HeLa细胞自噬及凋亡的影响(ni=6;x±s)
分组 GFP-LC3B阳性面积/% mCherry-LC3B阳性面积/% 细胞凋亡率/% 对照组 5.4±1.5 3.2±1.8 7.3±0.2 顺铂2.5 μmol/L组 22.0±1.4* 20.4±1.5* 20.6±0.2* 顺铂5.0 μmol/L组 22.9±1.8* 22.1±1.6* 63.1±0.6*# 顺铂10.0 μmol/L组 29.5±3.6*#▲ 28.1±3.2*#▲ 68.4±0.3*#▲ F 126.62 150.25 44 835.04 P < 0.01 < 0.01 < 0.01 MS组内 5.004 4.552 0.124 q检验: 与对照组比较*P < 0.05;与顺铂2.5 μmol/L组比较#P < 0.05;与顺铂5.0 μmol/L组比较▲P < 0.05 表 3 顺铂对HeLa细胞中Nrf2表达的影响(ni=6;x±s)
分组 细胞质Nrf2蛋白相对表达水平 细胞质Nrf2蛋白相对表达水平 细胞核内Nrf2荧光强度(总光密度) 对照组 3.7±0.3 1.1±0.1 411.0±30.3 顺铂2.5 μmol/L 2.2±0.1* 2.2±0.1* 1 438.7±69.0* 顺铂5.0 μmol/L 2.2±0.2* 3.9±0.2*# 1 730.5±37.5*# 顺铂10.0 μmol/L 1.1±0.1*#▲ 3.9±0.3*# 2 163.3±57.9*#▲ F 219.46 351.79 1 278.08 P < 0.01 < 0.01 < 0.01 MS组内 0.031 0.032 2 607.613 q检验: 与对照组比较*P < 0.05;与顺铂2.5 μmol/L组比较#P < 0.05;与顺铂5.0 μmol/L组比较▲P < 0.05 -
[1] 摇许驰, 何玉. 宫颈癌筛查方法的现状及进展[J]. 蚌埠医学院学报, 2018, 43(11): 1538. [2] 摇周莉, 陆安伟. 局部晚期宫颈癌治疗的争议与对策[J]. 中国实用妇科与产科杂志, 2019, 35(10): 1116. [3] 摇何白云, 王艳林, 黄利鸣. 细胞自噬与宫颈癌关系的研究进展[J]. 现代妇产科进展, 2018, 27(2): 149. [4] 摇邹霞, 郑建英, 赖开发, 等. RAC3激活Akt通路促进宫颈癌对顺铂耐药的实验研究[J]. 临床肿瘤学杂志, 2020, 25(6): 516. doi: 10.3969/j.issn.1009-0460.2020.06.007 [5] 摇TAO S, ROJO DE LA VEGA M, CHAPMAN E, et al. The effects of NRF2 modulation on the initiation and progression of chemically and genetically induced lung cancer[J]. Mol Carcinog, 2018, 57(2): 182. [6] 摇周燕妮, 章宏, 张玉媛. Nrf2在镉诱导的氧化损伤和致癌中保护作用的研究进展[J]. 蚌埠医学院学报, 2017, 42(8): 1149. [7] 摇PADMANABHAN B, TONG KI, OHTA T, et al. Structural basis for defects of Keap1 activity provoked by its point mutations in lung cancer[J]. Mol Cell, 2006, 21(5): 689. [8] 摇邰宵辉, 张玲芳, 张旭霞, 等. Nrf2/ ARE信号通路及其在肿瘤发生发展中作用的研究进展[J]. 现代肿瘤医学, 2021, 29(17): 3113. doi: 10.3969/j.issn.1672-4992.2021.17.035 [9] ROJO DE LA VEGA M, CHAPMAN E, ZHANG DD. NRF2 and the hallmarks of cancer[J]. Cancer Cell, 2018, 34(1): 21. doi: 10.1016/j.ccell.2018.03.022 [10] MA JQ, TUERSUN H, JIAO SJ, et al. Functional role of NRF2 in cervical carcinogenesis[J]. PLoS One, 2015, 10(8): e0133876. doi: 10.1371/journal.pone.0133876 [11] MA X, ZHANG J, LIU S, et al. Nrf2 knockdown by shRNA inhibits tumor growth and increases efficacy of chemotherapy in cervical cancer[J]. Cancer Chemother Pharmacol, 2012, 69(2): 485. doi: 10.1007/s00280-011-1722-9 [12] ZHANG Q, YANG D. Allicin suppresses the migration and invasion in cervical cancer cells mainly by inhibiting NRF2[J]. Exp Ther Med, 2019, 17(3): 1523. [13] 毛万丽, 李杰慧, 冉立. 宫颈癌顺铂耐药研究进展[J]. 现代肿瘤医学, 2021, 29(16): 2927. [14] CHUDE CI, AMARAVADI RK. Targeting autophagy in cancer: update on clinical trials and novel inhibitors[J]. Int J Mol Sci, 2017, 18(6): 1279. [15] DAVIS MA, DELANEY JR, PATEL CB, et al. Nelfinavir is effective against human cervical cancer cells in vivo: a potential treatment modality in resource-limited settings[J]. Drug Des Devel Ther, 2016, 10: 1837. [16] 阎臻, 付晓瑞, 李新敏, 等. HRAS基因表达对宫颈癌细胞自噬及凋亡作用及机制[J]. 青岛大学学报(医学版), 2021, 57(2): 240. [17] LI N, ZHANG W. Protein kinase C beta inhibits autophagy and sensitizes cervical cancer Hela cells to cisplatin[J]. Biosci Rep, 2017, 37(2): BSR20160445. [18] LIN WM, LI ZG. Blockage of cisplatin-induced autophagy sensitizes cervical cancer cells to cisplatin[J]. Genet Mol Res, 2015, 14(4): 16905. -





 下载:
下载: