-
尽管近年来肝癌的治疗出现了新的靶向治疗和免疫疗法[1],但肝癌仍是全世界最普遍的致命性恶性肿瘤,其治疗方法包括手术、经动脉化学栓塞、化学药物治疗、放射疗法以及肝移植等。病人确诊时多为晚期,常用细胞毒性抗肿瘤药物治疗如顺铂(cisplatin,DDP)。化学治疗已应用多年,但易出现耐药性仍是它的一个缺点,所以联合一些能提高化疗敏感性的小分子物质可能是一种有效的治疗方案。低分子质量肝素(low molecular weight heparin,LMWH)是相对分子质量3 000~8 000的一组肝素片段,也是临床上首选的抗凝药[2],LMWH在其他方面也有不错的作用: 可抑制肿瘤细胞的血管生成和转移[3]; 可通过影响wnt信号通路抑制A2780卵巢癌细胞对DDP耐药性的基因表达,逆转DDP的耐药性[4]。细胞自噬是一种进化保守并可降解多余的细胞内物质和细胞器的自杀方式。NASSOUR等[5]发现自噬通过促进细胞死亡可有效阻止癌症的发生。有研究[4]表明LMWH联合化疗药物可增加自噬水平而导致癌细胞的死亡。本实验旨在探讨LMWH与DDP联合作用对BEL-7404肝癌细胞自噬的影响及其分子机制,为肝癌的治疗提供参考。
-
人肝癌BEL-7404细胞株,由蚌埠医学院临床检验诊断学实验中心保存,在有10%胎牛血清和1%双抗的RPMI 1640培养基中、37 ℃、5%CO2温箱里培养,取对数生长期细胞用于后续实验。
-
RPMI 1640培养基、胎牛血清(Gibco,美国);CCK-8试剂盒(赛国公司);RIPR裂解液、BCA蛋白定量试剂盒(碧云天公司);SDS-PAGE凝胶配制试剂盒、三色预染蛋白marker(雅酶公司);MDC染色试剂盒(北京索莱宝公司);RT-PCR试剂盒(Takara,日本);cDNA第一条链合成试剂盒(Thermo,美国);引物(南京金斯瑞公司);LC3、p62、Beclin1、AMPK、p-AMPK、ULK1、P-ULK1单克隆抗体(Affinity Biosciences,美国);β-actin单克隆抗体(爱博泰克公司);HRP标记的二抗(sigma,美国);LMWH注射液(Alfa Wassermann,意大利);DDP(江苏豪森药业)。
-
将细胞以5×103/孔接种于96孔板,贴壁后分为对照组、空白组、LMWH组、DDP组及LMWH与DDP联合组(L+D组)。DDP组药物分别为0、1、2、4、8、16 μg/mL,LMWH组分别为50、100、200、400、800 IU/mL,L+D组为200 IU/mL LMWH与2 μg/mL DDP联合,加药48 h后以10微升/孔的量加入CCK-8溶液,3 h后测吸光度并计算细胞存活率。
-
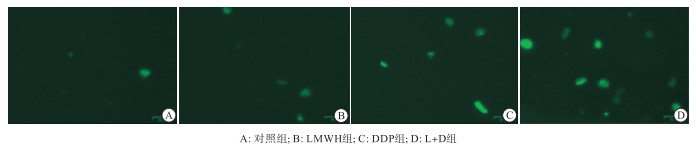
BEL-7404细胞制成悬液后加药处理并分为4组: 对照组、LMWH组(LMWH质量浓度为200 IU/mL)、DDP组(DDP质量浓度为2 μg/mL)以及LMWH(200 IU/mL)与DDP(2 μg/mL)联合的L+D组,培养48 h后吸去旧培养液,用1×Washing Buffer洗涤细胞2遍,然后每孔加入100 μL MDC工作液(以MDC stain: 1×Washing Buffer=1∶9比例配制),37 ℃孵育15 min,弃去MDC染色液,再用1×Washing Buffer洗涤细胞3遍,在ZOE细胞成像仪中、200倍的视野下观察并拍照,被染成绿色且有双层膜结构的是自噬小体,实验重复3次。
-
BEL-7404细胞制成悬液后按以上1.4中所述加药处理分为4组,消化、离心后用TRIzol法提取细胞总RNA、反转录成cDNA,再用RT-PCR扩增各组LC3和p62的基因及管家基因β-actin。引物序列见表 1。扩增程序: 95 ℃ 30 s预变性,95 ℃ 5 s、60 ℃ 30 s循环40次扩增。用2-△△CT法计算LC3和p62的相对表达量,并比较其差异。
引物名称 序列(5′~3′) β-actin F: 5′- CAAG CAG GAG TAT GAC GAG TC-3′ R: 5′- TGT CAA GAA AGG GTG TAA CGC-3′ LC3 F: 5′- AGC AGC ATC CAA CCA AAA TC-3′ R: 5′- CTG TGT CCG TTC ACC AAC AG-3′ p62 F: 5′- GAC TAC GAC TTG TGT AGC GTC-3′ R: 5′-AGT GTC CGT GTT TCA CCT TCC-3′ 表 1 引物序列表
-
将细胞接种于6孔板,按上述1.4的分组分为4组,药物处理后收集、离心、洗涤细胞,加入适量RIPR裂解液,离心后用BCA法测吸光度。以50 μg为上样质量计算出蛋白样本的上样体积,上样、电泳、转膜、封闭后将膜转入一抗中4 ℃孵育过夜(β-actin的一抗1∶5 000稀释,LC3、p62、Beclin1、AMPK、ULK1、p-AMPK和P-ULK1的一抗1∶1 000稀释),次日取出膜用TBS-T共洗涤3次,每次10 min,再放入二抗中(1∶5 000稀释)室温孵育2 h左右,再洗膜3次,在ECL发光试剂中反应1 min后放入BIO-RAD成像仪内曝光、采集图像,Image J软件计算目的蛋白的相对表达量,实验重复3次。
-
采用单因素方差分析、Dunnet-t检验、q检验。
-
CCK-8结果显示: 经DDP处理48 h后,随DDP药物浓度的增加对BEL-7404细胞的生存抑制作用越来越强, 即细胞存活率逐渐降低(P < 0.01)(见表 2),呈一定程度的浓度依赖性;而LMWH处理细胞48 h后,只有>200 IU/mL的LMWH才对肝癌细胞有抑制作用(P < 0.01)(见表 3);200 IU/mL LMWH与2 μg/mL DDP联合时肝癌细胞存活率比两药单独作用时更低(P < 0.01)(见表 4)。
分组 n 细胞存活率/% 对照组 3 100.00±5.12 1 μg/mL 3 80.08±2.83* 2 μg/mL 3 72.25±5.48* 4 μg/mL 3 57.45±4.70** 8 μg/mL 3 12.14±1.68** 16 μg/mL 3 6.36±0.69** F — 113.41 P — < 0.01 MS组内 — 454.362 Dunnet-t检验: 与对照组比较*P < 0.05,**P < 0.01 表 2 不同质量浓度的DDP处理48 h后对肝癌细胞存活率的影响(x±s)
分组 n 细胞存活率/% 对照组 3 100.00±5.12 50 IU/mL 3 101.70±2.63 100 IU/mL 3 98.20±2.40 200 IU/mL 3 90.47±2.53 400 IU/mL 3 85.66±3.23* 800 IU/mL 3 78.50±3.80* F — 8.88 P — < 0.01 MS组内 — 341.290 Dunnet-t检验: 与对照组比较*P < 0.05 表 3 不同质量浓度的LMWH处理48 h后对肝癌细胞存活率的影响(x±s)
分组 n 细胞存活率/% 对照组 3 100.00±5.12 LMWH组 3 90.47±2.53 DDP组 3 72.25±5.48* L+D组 3 38.33±3.65**△△## F — 47.58 P — < 0.01 MS组内 — 372.632 q检验: 与对照组比较*P < 0.05,**P < 0.01;与LMWH组比较△△P < 0.01;与DDP组比较##P < 0.01 表 4 LMWH与DDP单独及联合处理48 h后对肝癌细胞存活率的影响(x±s)
-
MDC是进入细胞后的一种可浓聚于自噬体的染色剂,常被用于标记自噬体。染色结果显示: 在对照组中,未做任何处理的BEL-7404肝癌细胞中也有少量的绿色点状荧光结构,说明在正常情况下肝癌细胞也会发生少量的自噬;在加入200 IU/mL的LMWH处理48 h后,绿色点状荧光结构无明显变化;而加入2 μg/mL的DDP处理48 h后,绿色点状荧光结构较对照组增多,表明DDP可以引起肝癌BEL-7404细胞发生自噬;当LMWH和DDP联合用药48 h后,绿色荧光标记的自噬小体与其他三组相比明显增多,且亮度也增加(见图 1)。
-
细胞分组处理后检测LC3和p62的mRNA表达,RT-PCR结果显示: LMWH组和DDP组LC3的mRNA表达较对照组升高(P < 0.01),p62较对照组降低(P < 0.05);与DDP组和LMWH组比较,L+D组LC3的mRNA表达升高(P < 0.01),p62的表达降低(P < 0.05);而L+D组与对照组相比LC3的mRNA表达升高和p62表达降低的变化更明显(P < 0.01)(见表 5)。
分组 n p62 mRNA表达/% LC3 mRNA表达/% 对照组 3 19.57±0.37 11.64±1.27 LMWH组 3 17.06±0.55* 23.54±1.64** DDP组 3 16.37±0.67* 30.34±1.40** L+D组 3 13.95±0.52**△# 81.67±2.73**△△## F — 18.49 279.37 P — < 0.01 < 0.01 MS组内 — 6.940 82.021 注: mRNA的表达是目的基因与管家基因β-actin相比得出的相对表达量。q检验: 与对照组比较*P < 0.05,**P < 0.01;与LMWH组比较△P < 0.05,△△P < 0.01;与DDP组比较#P < 0.05,##P < 0.01 表 5 LMWH与DDP单独及联合处理肝癌细胞48 h后自噬蛋白mRNA的表达情况(x±s)
-
加药处理48 h后肝癌细胞自噬相关蛋白的表达量显示: LMWH组和DDP组与对照组比较上调了LC3Ⅱ蛋白的表达(P < 0.05和P < 0.01),下调p62的表达(P < 0.01);L+D组的LC3Ⅱ的表达与DDP组、LMWH组相比明显升高(P < 0.01),p62明显降低(P < 0.01和P < 0.05),但与对照组相比,LC3Ⅱ的表达升高、p62降低的变化比单独用药更明显(P < 0.01)(见图 2、表 6)。
分组 n p62蛋白表达量/% LC3蛋白表达量/% 对照组 3 1.28±0.07 0.33±0.03 LMWH组 3 0.78±0.04** 0.43±0.03* DDP组 3 0.38±0.02** 0.65±0.05** L+D组 3 0.26±0.02**△△# 1.71±0.07**△△## F — 118.93 204.35 P — < 0.01 < 0.01 MS组内 — 0.043 0.048 q检验: 与对照组比较*P < 0.05,**P < 0.01;与LMWH组比较△△P < 0.01;与DDP组比较#P < 0.05,##P < 0.01 表 6 LMWH与DDP单独及联合处理48 h后自噬蛋白的表达情况(x±s)
-
经药物作用48 h后,肝癌细胞通路蛋白的表达显示: LMWH组与对照组中AMPK-ULK1-Beclin1通路中的AMPK和ULK1的表达差异均无统计学意义(P>0.05),但DDP组与L+D组的表达均高于对照组(P < 0.05~P < 0.01);Beclin1表达量方面,除LMWH组与DDP组差异无统计学意义外,其他组之间差异均有统计学意义(P < 0.05~P < 0.01),而L+D组的表达均高于其他3组(见图 3、表 7)。
分组 n P-AMPK/AMPK蛋白表达量/% Beclin1蛋白表达量/% P-ULK1/ULK1蛋白表达量/% 对照组 3 0.50±0.03 0.48±0.02 0.47±0.02 LMWH组 3 0.54±0.04 0.75±0.07* 0.54±0.05 DDP组 3 0.73±0.02** 0.84±0.04** 0.87±0.04* L+D组 3 0.98±0.09**△△# 1.13±0.09**△# 1.09±0.06**△△# F — 19.71 19.38 38.19 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.060 0.087 0.052 q检验: 与对照组比较* P < 0.05,** P < 0.01;与LMWH组比较△P < 0.05,△△P < 0.01;与DDP组比较#P < 0.05 表 7 LMWH和DDP单独及联合处理48 h后通路蛋白的表达情况(x±s)
-
虽然有研究[6]表明: 高尔基蛋白73、铁蛋白及甲胎蛋白三种肿瘤标志物联合检测比单独检测增加了肝癌的诊断敏感性。但肝癌仍有早期难发现、进展快、转移范围广且预后差、易复发等特点,目前在全球范围内死亡病例数排名第二,且发病率逐年增加[7],所以急需找到新的治疗思路。DDP是第一个单用或与化疗药物联合使用的一线化疗药物,被用于多种实体肿瘤的化疗如卵巢癌[8]、胃癌[9]、肺癌[10]、肝癌[11]等。DDP的作用主要是破坏DNA结构,在损伤无法修复的地方引发细胞凋亡,它的作用与剂量有关,但大剂量又会出现严重的不良作用及耐药性,后者也是病人长期化疗中不可避免的现象。LMWH通过影响癌细胞黏附、增殖、转移和血管生成[12]直接影响肿瘤的生物学作用已被广泛接受,而这些特性为其与抗肿瘤疗法的联合提供了基础,常见的联合方法有: 联合其他抗肿瘤血管生成药物通过多种途径改变肿瘤微环境,以及联合化疗药物增强对肿瘤的杀伤作用,如LMWH联合DDP可以拮抗卵巢癌的化疗耐药性[4],达肝素钠对体外培养的人A549肺癌细胞和其异种移植模型均有生长抑制作用,与DDP合用可增强其抑制作用[13]等。因为肝素链上有硫酸盐和羧基,所以带正电荷的药物如吲哚美辛、水顺铂[14],可以与这些带负电荷的基团相互作用,TONG等[14]研究表明: 普朗尼克与肝素在合适温度下偶联形成纳米复合物,它显著增强了其载药能力。综上,LMWH联合DDP可能成为一种增强DDP作用的联合治疗癌症的方法。本实验通过CCK-8法检测到200 IU/mL的LMWH和2 μg/mL的DDP单独用药及联合用药48 h后BEL-7404细胞的存活率分别为(90.47±2.53)%、(72.25±5.84)%、(38.33±3.65)%,结果显示,相比于单独用药来说,联合用药降低细胞存活率的作用更明显,表明LMWH可以提高DDP对肝癌细胞的抗肿瘤活性。
自噬是一种进化保守并可降解多余的细胞内物质和细胞器的自杀方式。自噬在肿瘤中有双重性作用: 既可通过剥夺细胞的营养阻止肿瘤的发生,也可通过赋予代谢优势[15]促进肿瘤的进展。Beclin1与液泡分选蛋白34(vacuole separation of proteins 34,VPS34)共同组成Beclin1-VPS34复合物,参与自噬体的成核。而自噬体扩张需要LC3Ⅰ先脂化成LC3Ⅱ被招募到自噬小体膜中,然后结合到p62上再与溶酶体融合后一起被降解[16]。因此,本研究通过检测LC3Ⅱ和p62蛋白的相对表达量来评估自噬的发生程度。为了探讨LMWH联合DDP能否诱发自噬提高肝癌细胞对DDP的敏感性,用MDC染色法表明联合用药可诱导肝癌细胞明显发生自噬,比单药作用效果更明显;Western blotting结果显示: DDP作用后明显提高了LC3Ⅱ蛋白的表达、降低了p62的表达,表明单独使用DDP时对肝癌细胞生长有抑制作用,但此时自噬可能在慢慢增强,肝癌细胞逐渐产生耐药,而联合LMWH使用时蛋白LC3Ⅱ的相对表达量较DDP组显著升高、p62的表达显著降低;RT-PCR检测它们mRNA的表达结果与Western blotting和MDC染色结果一致,均提示LMWH与DDP联合作用有效增强了肝癌细胞的自噬。
众所周知,AMPK-ULK1-Beclin1信号通路是目前调控自噬的重要途径之一,其中AMPK与自噬密切相关,高分解代谢或应激条件下可能导致氨基酸不足和AMP/ATP比例失调,最终激活AMPK[17],激活的AMPK为P-AMPK可能有助于线粒体自噬系统的激活[18]: 它通过直接磷酸化ULK1调节自噬的启动,Beclin1是UlK1在氨基酸脱羧条件下的另一个靶点,所以P-AMPK可以激活Beclin1进而激活自噬前VPS34复合物最终启动自噬[19]。多项实验[20-22]表明AMPK-ULK1依赖性自噬参与多种疾病的调控和转化,但鲜见作用在肝癌中的报道。为了探索LMWH联合DDP激活自噬的途径是否通过AMPK-ULK1-Beclin1通路,我们检测到通路蛋白AMPK和ULK1的表达几乎无变化,却促进了AMPK和ULK1磷酸化,L+D组的P-AMPK/AMPK、P-ULK1/ULK1及Beclin1的蛋白表达较其他3组明显升高,即联合用药激活了AMPK-ULK1-Beclin1信号通路。基于这些数据,我们可以认为LMWH联合DDP诱导肝癌细胞增强自噬可能是通过激活AMPK-ULK1-Beclin1信号通路实现的。
我们之前的研究表明: 高浓度的LMWH可抑制肝癌细胞的增殖[23]、LMWH联合DDP可诱导肝癌细胞凋亡[24]。而在本研究中,我们进一步阐明了LMWH联合DDP降低了肝癌BEL-7404细胞存活率、明显增强肝癌细胞自噬,可能是通过激活AMPK-ULK1-Beclin1信号通路实现的,证明了LMWH联合DDP可增强DDP的抗肿瘤活性。因此,我们认为LMWH与DDP联合用药可为肝癌的治疗提供新思路。
低分子质量肝素联合顺铂对肝癌细胞自噬的影响
Effect of the low molecular weight heparin combined with cisplatin on the autophagy of liver cancer cells
-
摘要:
目的探讨低分子质量肝素(low molecular weight heparin, LMWH)联合顺铂(cisplatin, DDP)对BEL-7404人肝癌细胞自噬的影响和机制。 方法用不同质量浓度的LMWH、DDP单独或联合处理肝癌BEL-7404细胞48 h, 并分为4组: 对照组、LMWH组、DDP组及L+D组。CCK-8法测其对细胞增殖能力的影响; 单丹磺酰尸胺荧光染色法观察自噬水平; RT-PCR检测自噬蛋白mRNA的表达; Western blotting检测自噬蛋白及通路蛋白的表达。 结果L+D组的细胞增殖能力较其他组明显下降(P < 0.01), 绿色荧光自噬体显著增多、自噬相关蛋白LC3Ⅱ的mRNA和蛋白表达均明显增高(P < 0.01), p62明显降低(P < 0.01), P-AMPK/AMPK、P-ULK1/ULK1以及Beclin1的蛋白表达明显升高(P < 0.05~P < 0.01)。 结论LMWH与DDP联合作用显著提高了BEL-7404细胞自噬, 可能是通过激活AMPK-ULK1-Beclin1信号通路而实现。 -
关键词:
- 肝肿瘤 /
- 低分子质量肝素 /
- 顺铂 /
- 自噬 /
- AMPK-ULK1-Beclin1
Abstract:ObjectiveTo investigate the effects and mechanism of low molecular weight heparin(LMWH) combined with cisplatin(DDP) on the autophagy of human hepatocellular carcinoma(HCC) BEL-7404 cells. MethodsThe BEL-7404 liver cancer cells were treated with different concentrations of LMWH and DDP alone or in combination for 48 h, and divided into the control group, LMWH group, DDP group and L+D group.CCK-8 method was used to measure the effects on cell proliferation ability.Dansylcadaverine fluorescence staining was used to observe the autophagy levels.The expression of autophagy-related protein mRNA was detected by RT-PCR.Western blotting was used to detect the expression of autophagy-related proteins and pathway proteins. ResultsCompared with other groups, the cell proliferation ability significantly decreased(P < 0.05), the green fluorescence autophagy body significantly increased, the mRNA and protein expression levels of autophagy-related protein LC3Ⅱ significantly increased(P < 0.01), the p62 significantly decreased(P < 0.01), and the protein expressions of P-AMPK/AMPK, P-ULK1/ULK1 and Beclin1 significantly increased in the L+D group(P < 0.05 to P < 0.01). ConclusionsThe LMWH combined with DDP can significantly increase the autophagy of BEL-7404 cells, which may be realized through activating AMPK-ULK1-Beclin1 signaling pathway. -
Key words:
- liver neoplasms /
- low molecular weight heparin /
- cisplatin /
- autophagy /
- AMPK-ULK1-Beclin1
-
表 1 引物序列表
引物名称 序列(5′~3′) β-actin F: 5′- CAAG CAG GAG TAT GAC GAG TC-3′ R: 5′- TGT CAA GAA AGG GTG TAA CGC-3′ LC3 F: 5′- AGC AGC ATC CAA CCA AAA TC-3′ R: 5′- CTG TGT CCG TTC ACC AAC AG-3′ p62 F: 5′- GAC TAC GAC TTG TGT AGC GTC-3′ R: 5′-AGT GTC CGT GTT TCA CCT TCC-3′ 表 2 不同质量浓度的DDP处理48 h后对肝癌细胞存活率的影响(x±s)
分组 n 细胞存活率/% 对照组 3 100.00±5.12 1 μg/mL 3 80.08±2.83* 2 μg/mL 3 72.25±5.48* 4 μg/mL 3 57.45±4.70** 8 μg/mL 3 12.14±1.68** 16 μg/mL 3 6.36±0.69** F — 113.41 P — < 0.01 MS组内 — 454.362 Dunnet-t检验: 与对照组比较*P < 0.05,**P < 0.01 表 3 不同质量浓度的LMWH处理48 h后对肝癌细胞存活率的影响(x±s)
分组 n 细胞存活率/% 对照组 3 100.00±5.12 50 IU/mL 3 101.70±2.63 100 IU/mL 3 98.20±2.40 200 IU/mL 3 90.47±2.53 400 IU/mL 3 85.66±3.23* 800 IU/mL 3 78.50±3.80* F — 8.88 P — < 0.01 MS组内 — 341.290 Dunnet-t检验: 与对照组比较*P < 0.05 表 4 LMWH与DDP单独及联合处理48 h后对肝癌细胞存活率的影响(x±s)
分组 n 细胞存活率/% 对照组 3 100.00±5.12 LMWH组 3 90.47±2.53 DDP组 3 72.25±5.48* L+D组 3 38.33±3.65**△△## F — 47.58 P — < 0.01 MS组内 — 372.632 q检验: 与对照组比较*P < 0.05,**P < 0.01;与LMWH组比较△△P < 0.01;与DDP组比较##P < 0.01 表 5 LMWH与DDP单独及联合处理肝癌细胞48 h后自噬蛋白mRNA的表达情况(x±s)
分组 n p62 mRNA表达/% LC3 mRNA表达/% 对照组 3 19.57±0.37 11.64±1.27 LMWH组 3 17.06±0.55* 23.54±1.64** DDP组 3 16.37±0.67* 30.34±1.40** L+D组 3 13.95±0.52**△# 81.67±2.73**△△## F — 18.49 279.37 P — < 0.01 < 0.01 MS组内 — 6.940 82.021 注: mRNA的表达是目的基因与管家基因β-actin相比得出的相对表达量。q检验: 与对照组比较*P < 0.05,**P < 0.01;与LMWH组比较△P < 0.05,△△P < 0.01;与DDP组比较#P < 0.05,##P < 0.01 表 6 LMWH与DDP单独及联合处理48 h后自噬蛋白的表达情况(x±s)
分组 n p62蛋白表达量/% LC3蛋白表达量/% 对照组 3 1.28±0.07 0.33±0.03 LMWH组 3 0.78±0.04** 0.43±0.03* DDP组 3 0.38±0.02** 0.65±0.05** L+D组 3 0.26±0.02**△△# 1.71±0.07**△△## F — 118.93 204.35 P — < 0.01 < 0.01 MS组内 — 0.043 0.048 q检验: 与对照组比较*P < 0.05,**P < 0.01;与LMWH组比较△△P < 0.01;与DDP组比较#P < 0.05,##P < 0.01 表 7 LMWH和DDP单独及联合处理48 h后通路蛋白的表达情况(x±s)
分组 n P-AMPK/AMPK蛋白表达量/% Beclin1蛋白表达量/% P-ULK1/ULK1蛋白表达量/% 对照组 3 0.50±0.03 0.48±0.02 0.47±0.02 LMWH组 3 0.54±0.04 0.75±0.07* 0.54±0.05 DDP组 3 0.73±0.02** 0.84±0.04** 0.87±0.04* L+D组 3 0.98±0.09**△△# 1.13±0.09**△# 1.09±0.06**△△# F — 19.71 19.38 38.19 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.060 0.087 0.052 q检验: 与对照组比较* P < 0.05,** P < 0.01;与LMWH组比较△P < 0.05,△△P < 0.01;与DDP组比较#P < 0.05 -
[1] TELLA SH, KOMMALAPATI A, MAHIPAL A. Systemic therapy for advanced hepatocellular carcinoma: targeted therapies[J]. Chin Clin Oncol, 2021, 10(1): 10. doi: 10.21037/cco-20-117 [2] ZHU L, LI M, LIU Y. Intravenous administration of low-molecular-weight heparin[J]. Am J Ther, 2019, 26(3): e426. doi: 10.1097/MJT.0000000000000841 [3] PFANKUCHEN DB, STÖLTING DP, SCHLESINGER M, et al. Low molecular weight heparin tinzaparin antagonizes cisplatin resistance of ovarian cancer cells[J]. Biochem Pharmacol, 2015, 97(2): 147. doi: 10.1016/j.bcp.2015.07.013 [4] PETRICCA S, FLATI V, CELENZA G, et al. Tebuconazole and econazole act synergistically in mediating mitochondrial stress, energy imbalance, and sequential activation of autophagy and apoptosis in mouse sertoli TM4 Cells: possible role of AMPK/ULK1 axis[J]. Toxicol Sci, 2019, 169(1): 209. doi: 10.1093/toxsci/kfz031 [5] NASSOUR J, RADFORD R, CORREIA A, et al. Autophagic cell death restricts chromosomal instability during replicative crisis[J]. Nature, 2019, 565(7741): 659. doi: 10.1038/s41586-019-0885-0 [6] 赵惠柳, 舒宏, 欧超, 等. 原发性肝癌病人血清高尔基蛋白73、铁蛋白、甲胎蛋白联合检测的早期诊断价值分析[J]. 蚌埠医学院学报, 2020, 45(2): 246. doi: 10.13898/j.cnki.issn.1000-2200.2020.02.030 [7] ZHEN SH, CHENG M, TAO YB, et al. Deep learning for accurate diagnosis of liver tumor based on magnetic resonance imaging and clinical data[J]. Front Oncol, 2020, 10: 680. doi: 10.3389/fonc.2020.00680 [8] VAN ZYL B, TANG D, BOWDEN NA. Biomarkers of platinum resistance in ovarian cancer: what can we use to improve treatment[J]. Endocr Relat Cancer, 2018, 25(5): R303. doi: 10.1530/ERC-17-0336 [9] QIAN K, QIAN H, CAI J, et al. Evaluation of cisplatin-hydrogel for improving localized antitumor efficacy in gastric cancer[J]. Pathol Res Pract, 2019, 215(4): 755. doi: 10.1016/j.prp.2019.01.005 [10] SONG L, CUI Z, GUO X. Comprehensive analysis of circular RNA expression profiles in cisplatin-resistant non-small cell lung cancer cell lines[J]. Acta Biochim Biophys Sin (Shanghai), 2020, 52(9): 944. doi: 10.1093/abbs/gmaa085 [11] ZHANG B, CAO K, LIU Z, et al. Receptor interacting protein kinase 3 promotes cisplatin-induced necroptosis in apoptosis-resistant HepG2/DDP cells[J]. Neoplasma, 2019, 66(5): 694. doi: 10.4149/neo_2018_180710N466 [12] MOUSA SA, PETERSEN LJ. Anti-cancer properties of low-molecular-weight heparin: preclinical evidence[J]. Thromb Haemost, 2009, 102(2): 258. [13] RUI Y, WANG D, HU D, et al. Role of dalteparin sodium on the growth of cancer cells and tumor-associated angiogenesis in A549 human lung cancer cell line and grafted mouse model[J]. J Cancer Res Ther, 2018, 14(Supplement): S985. [14] TONG NA, NGUYEN TP, CUU KHOA N, et al. Aquated cisplatin and heparin-pluronic nanocomplexes exhibiting sustainable release of active platinum compound and NCI-H460 lung cancer cell antiproliferation[J]. J Biomater Sci Polym Ed, 2016, 27(8): 709. doi: 10.1080/09205063.2016.1154239 [15] CHEN HT, LIU H, MAO MJ. Crosstalk between autophagy and epithelial-mesenchymal transition and its application in cancer therapy[J]. Mol Cancer, 2019, 18(1): 101. doi: 10.1186/s12943-019-1030-2 [16] KLIONSKY DJ, ABDELMOHSEN K, ABE A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy, 2016, 12(1): 1. doi: 10.1080/15548627.2015.1100356 [17] LI Y, CHEN Y. AMPK and Autophagy[J]. Adv Exp Med Biol, 2019, 1206: 85. [18] DONG YZ, LI L, ESPE M, et al. Hydroxytyrosol attenuates hepatic fat accumulation via activating mitochondrial biogenesis and autophagy through the AMPK pathway[J]. J Agric Food Chem, 2020, 68(35): 9377. doi: 10.1021/acs.jafc.0c03310 [19] HONG-BROWN LQ, BROWN CR, NAVARATNARAJAH M, et al. FoxO1-AMPK-ULK1 regulates ethanol-induced autophagy in muscle by enhanced ATG14 association with the BECN1-PIK3C3 complex[J]. Alcohol Clin Exp Res, 2017, 41(5): 895. doi: 10.1111/acer.13377 [20] PETRICCA S, FLATI V, CELENZA G, et al. Tebuconazole and econazole act synergistically in mediating mitochondrial stress, energy imbalance, and sequential activation of autophagy and apoptosis in mouse sertoli TM4 cells: possible role of AMPK/ULK1 axis[J]. Toxicol Sci, 2019, 169(1): 209. doi: 10.1093/toxsci/kfz031 [21] XIE X, LIN W, ZHENG W, et al. Downregulation of G2/mitotic-specific cyclinB1 triggers autophagy via AMPK-ULK1-dependent signal pathway in nasopharyngeal carcinoma cells[J]. Cell Death Dis, 2019, 10(2): 94. doi: 10.1038/s41419-019-1369-8 [22] ZHOU GZ, WANG QQ, WANG PB, et al. One novel curcumin derivative ZYX01 induces autophagy of human non-small lung cancer cells A549 through AMPK/ULK1/Beclin-1 signaling pathway[J]. Cell Mol Biol (Noisy-le-grand), 2019, 65(2): 1. doi: 10.14715/cmb/2019.65.2.1 [23] 于北凯, 程龙, 翟玮玮, 等. 低相对分子质量肝素对人肝癌细胞生长的影响及机制[J]. 上海交通大学学报(医学版), 2014, 34(2): 149. [24] 武文娟, 于北凯, 耿英华. 低相对分子质量肝素增强顺铂诱导肝癌细胞的凋亡作用[J]. 中南大学学报(医学版), 2015, 40(12): 1298. doi: 10.11817/j.issn.1672-7347.2015.12.003 -





 下载:
下载: