-
感染性休克是ICU常见的重症综合征,病情重,进展迅速,为机体对感染反应失调所致的危及生命的多器官功能障碍综合征[1]。尽管现代医学治疗手段已有明显进步,感染性休克病人死亡率仍然很高,在ICU病房中死亡率超过40%[2],准确评估病情对救治及改善病人预后具有重要意义。感染性休克发病及病情进展机制复杂,目前认为其中免疫状态、炎症机制在疾病的发生发展过程中起了至关重要的作用[3-4]。所以病人免疫、炎症反应及器官功能状态是反映病人病情严重程度以及指导治疗的重要指标。本研究通过检测CD4+与CD8+比值(CD4+/CD8+)、N末端脑钠肽前体(NT-proBNP)及白细胞介素6(IL-6),分别从免疫状态、炎症反应、心功能等方面综合阐述其与感染性休克病人疾病严重程度及预后的关系。现作报道。
-
选择2019年1月至2020年5月在我院重症医学科收治的感染性休克病人77例。入选病人均符合脓毒症与感染性休克治疗国际指南(2016)[5]的诊断标准。排除非感染因素所致的休克、年龄 < 18岁、入住重症监护室(ICU)时间 < 24 h、恶性肿瘤发化疗术后、确诊自身免疫性疾病、HIV病人以及放弃治疗病人。
-
随访77例病人28 d生存情况,将其分为生存组(53例)和死亡组(24例)。记录病人性别、年龄、体质量指数;基础病情况如冠心病、慢性心力衰竭、脑血管疾病、高血压、糖尿病、慢性肾病、慢性肝病、慢性阻塞性肺疾病(COPD)、重症肌无力,一种或几种合并情况;检测病人确诊24 h内的最低氧合指数、最高乳酸(Lac)值、血白细胞计数、血清降钙素原(PCT)、IL-6、NT-proBNP、CD4+/CD8+。
-
采用t检验、χ2检验、logistic回归分析、ROC曲线。
-
2组病人性别构成、体质量指数比较差异均无统计学意义(P>0.05);2组病人年龄、合并基础病情况、血白细胞计数、PCT、IL-6、NT-proBNP、CD4+/CD8+差异均有统计学意义(P < 0.05~P < 0.01)(见表 1)。
分组 n 男 年龄/岁 体质量指数/(kg/m2) 合并基础病 血白细胞计数/(×109) APACHEⅡ评分/分 PCT/(ng/mL) IL-6/(pg/mL) CD4+/CD8+ Lac/(mmol/L) NT-proBNP/(pg/mL) 生存组 53 34 58.3±8.6 23.6±2.48 25 12.83±3.52 20.3±3.2 3.22±0.91 312±89 1.172±0.248 2.6±0.7 1 746±573 死亡组 24 16 67.5±10.9 24.8±2.83 15 15.21±4.74 24.8±3.8 6.19±1.30 437±102 0.799±0.211 3.5±0.9 2 241±659 t — 0.05* 2.48 0.80 4.30* 2.03 3.71 4.22 7.19 6.26 5.25 12.16 P — >0.05 < 0.01 >0.05 < 0.05 < 0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 *示χ2值 表 1 2组病人临床资料比较
-
对存活组和死亡组病人的年龄、合并基础病、第1天最高Lac值、血白细胞计数、PCT、IL-6、NT-proBNP、CD4+/CD8+进行logistic回归分析,结果显示年龄、合并基础疾病,Lac、PCT、IL-6、NT-proBNP均为感染性休克病人死亡独立危险因素,CD4+/CD8+为感染性休克病人死亡保护因素(P < 0.05)(见表 2)。
指标 B SE Waldχ2 P OR(95%CI) 年龄 0.17 0.024 0.47 < 0.05 1.180(1.036~1.211) 基础疾病 0.43 0.147 8.69 < 0.05 1.541(1.276~1.693) 血白细胞数 0.10 0.029 6.48 >0.05 1.107(0.910~1.288) PCT 0.15 0.043 10.54 >0.05 1.162(0.877~1.331) IL-6 0.19 0.058 9.29 < 0.05 1.211(1.080~1.370) Lac 0.27 0.047 11.68 < 0.05 1.307(1.078~1.536) NT-proBNP 0.31 0.102 9.19 < 0.05 1.360(1.182~1.493) CD4+/CD8+ -0.15 0.041 11.47 < 0.05 0.863(1.182~1.493) APACHEⅡ 0.63 0.264 8.66 < 0.05 1.882(1.420~2.071) 表 2 感染性休克病人死亡危险因素logistic回归分析
-
IL-6、NT-proBNP与APACHE Ⅱ呈现显著正相关关系(r=0.753, 0.776,P < 0.01),CD4+/CD8+与APACHE Ⅱ无显相关关系(r=-0.120,P>0.05)。
-
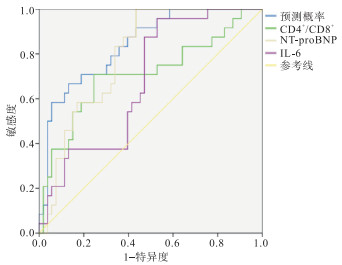
IL-6、NT-proBNP对感染性休克病人死亡的预测的ROC曲线下面积(AUC)分别为0.678、0.793(P < 0.05),最佳截断值分别为419 pg/mL和2 371 pg/mL;CD4+/CD8+对感染性休克病人为保护性因素,所以取其倒数绘制ROC曲线评估其对感染性休克病人死亡的预测效能,ROC AUC为0.708;三项指标综合预测效能ROC AUC为0.840(P < 0.05)(见图 1、表 3)。
变量 AUC 95%CI 灵敏度/% 特异度/% 约登指数 综合预测 0.840 0.749~0.932 89.2 84.7 0.739 CD4+/CD8+ 0.708 0.573~0.844 68.5 64.1 0.326 NT-proBNP 0.793 0.695~0.891 83.9 79.5 0.634 IL-6 0.678 0.556~0.799 74.2 78.6 0.528 表 3 IL-6、NT-proBNP和CD4+/CD8+对感染性休克病人死亡的预测效能
-
感染性休克是重症监护室病人死亡的主要原因之一,虽然现代医学取得长足进步,但感染性休克病人死亡率仍较高[6],感染性休克发病机制、预后因素及诊疗措施仍须全面研究。免疫系统状态及炎症反应程度是脓毒症病理生理机制及疾病发展过程中的关键角色,近年来免疫功能障碍及炎症反应已成为研究的热点[7]。机体发生感染性休克时炎症因子水平显著升高,引起一系列免疫应答及炎症反应,造成宿主细胞抗原结构改变,进而引起机体免疫功能紊乱。其中T细胞为机体抵抗感染最主要防御细胞之一,CD4+T细胞多为辅助性T细胞,CD8+T细胞多为抑制性T细胞,CD4+/CD8+能够很好地反映机体的免疫状态。病人免疫紊乱同时常伴有炎症反应失衡,更甚者会出现严重炎症风暴。IL-6是一种主要由单核-巨噬细胞分泌的具有多种功能的促炎因子, 在炎症反应处于中心地位,能诱导C反应蛋白、PCT等多种炎症因子的生成,是反映全身炎症反应的重要指标之一[7-9]。本研究显示感染性休克死亡组病人IL-6明显高于存活组,而CD4+/CD8+明显低于存活组。且应用直线相关回归分析显示IL-6与APACHE Ⅱ评分具有良好的相关性,提示此指标能良好地反映病人疾病严重程度。虽然CD4+/CD8+与APACHE Ⅱ评分的相关系数很低,但趋势为负相关,这提示病人免疫状态受疾病严重程度的影响,与以往研究[10-11]结果相符合,提示感染性休克病人存在长期免疫抑制及过度炎症反应。
感染性休克必然伴随器官功能障碍,心脏为其最常受累的主要器官之一,脓毒症性心肌病即为其常见情况。NT-proBNP为评价心力衰竭心功能状态极具价值的指标,能很好地反映心机损伤及心功能状态[12-13]。本研究结果显示死亡组病人NT-proBNP水平明显高于存活组,且其与APACHE Ⅱ显著相关,提示NT-proBNP水平与疾病严重程度正相关,影响感染性休克病人预后。本研究通过logistic回归模型分析显示年龄、合并基础疾病、Lac、PCT、IL-6、NT-proBNP均为病人不良预后的独立危险因素;CD4+/CD8+为其保护因素。通过ROC曲线分析CD4+/CD8+、NT-proBNP、IL-6对感染性休克病人预后具有良好的预测价值,其AUC分别为0.678、0.793、0.708,三项指标综合预测感染性休克病人死亡风险ROC AUC为0.84,说明三项指标均对病人预后有一定预测价值,三项联合更能准确地预测预后,具有重要的临床价值。
淋巴细胞CD4+与CD8+比值、N末端脑钠肽前体及白细胞介素6对感染性休克病人预后评估的价值
Value of the lymphocyte CD4+/CD8+ ratio, NT-proBNP and IL-6 in evaluating the prognosis of patients with septic shock
-
摘要:
目的探讨淋巴细胞CD4+与CD8+比值(CD4+/CD8+)、N末端脑钠肽前体(NT-proBNP)及白细胞介素6(IL-6)对感染性休克病人预后评估的价值。 方法选取收治的感染性休克病人77例进行前瞻性研究, 检测病人诊断感染性休克第一个24 h内的CD4+/CD8+、NT-proBNP及IL-6、最高乳酸(Lac)水平, 并记录病人性别、年龄、急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分、是否合并基础病等资料。采用logistic回归分析感染性休克病人发生死亡的相关独立危险因素, 将CD4+/CD8+、NT-proBNP及IL-6分别与APACHE Ⅱ评分进行直线相关回归分析; 绘制受试者工作特(ROC)曲线分析CD4+/CD8+、NT-proBNP及IL-6对感染性休克病人预后评估的价值。 结果感染性休克死亡组NT-proBNP及IL-6水平明显高于存活组(P < 0.05), CD4+/CD8+明显低于存活组; logistic回归分析显示年龄、APACHE Ⅱ评分、基础病、Lac、NT-proBNP及IL-6均为感染性休克病人死亡的独立危险因素, CD4+/CD8+是病人的保护因素; IL-6、NT-proBNP、与APACHE Ⅱ具有良好的相关性(P < 0.01), CD4+/CD8+与APACHEⅡ未见明显相关性(P>0.05);ROC曲线显示第1天血清NT-proBNP、IL-6、血液CD4+/CD8+对感染性休克病人死亡的预测效能ROC曲线下面积分别为0.793、0.678、0.708(P < 0.05);三项指标联合预测效能ROC曲线下面积为0.840(P < 0.05)。 结论CD4+/CD8+、NT-proBNP及IL-6与感染性休克病人严重程度及预后明显相关, 三项综合对脓毒症病人的预后具有较好的预测价值。 -
关键词:
- 感染性休克 /
- CD4+/CD8+比值 /
- N末端脑钠肽前体 /
- 白细胞介素-6
Abstract:ObjectiveTo investigate the value of the lymphocyte CD4+/CD8+ ratio, N-terminal brain natriuretic peptide precursor(NT-probNP) and interleukin 6(IL-6) in evaluating the prognosis of patients with septic shock. MethodsSeventy-seven patients with septic shock were selected for prospective study, and the CD4+/CD8+ ratio, NT-probNP, IL-6 and Maximun lactate (Lac) levels in all cases were detected in the first 24 h after septic shock.The gender, age, acute physiology and chronic health status scoring system Ⅱ(APACHE Ⅱ) score, combined with underlying diseases and other data were recorded.The independent risk factors of death in septic shock patients were analyzed by logistic regression analysis, and the CD4+/CD8+ ratio, NT-probNP and IL-6 were analyzed by linear correlation regression with APACHE Ⅱ score.The receiver operating characteristic(ROC) curve was drawn to analyze the value of CD4+/CD8+ ratio, NT-probNP and IL-6 in the evaluation of prognosis of patients with septic shock. ResultsThe levels of NT-probNP and IL-6 in septic shock death group were significantly higher than those in survival group(P < 0.05), and the CD4+/CD8+ ratio in septic shock death group was significantly lower than that in survival group.The results of logistic regression analysis showed that the age, APACHE Ⅱ score, underlying disease, Lac, NT-probNP and IL-6 were the independent risk factors of death in patients with septic shock, and the CD4+/CD8+ ratio was a protective factor.The IL-6 and NT-probNP had a good correlation with APACHE Ⅱ(P < 0.01), while the CD4+/CD8+ ratio had not significant correlation with APACHE Ⅱ(P>0.05).The ROC curve showed that the predictive efficacy of serum NT-probNP, IL-6 and blood CD4+/CD8+ ratio on the death of septic shock patients on day 1 were 0.793, 0.678 and 0.708, respectively(P < 0.05).The area under ROC curve was 0.840(P < 0.05). ConclusionsThe CD4+/CD8+ ratio, NT-proBNP and IL-6 are significantly correlated with the severity and prognosis of septic shock patients.The combination of these three factors has excellent predictive value for the prognosis of septic shock patients. -
表 1 2组病人临床资料比较
分组 n 男 年龄/岁 体质量指数/(kg/m2) 合并基础病 血白细胞计数/(×109) APACHEⅡ评分/分 PCT/(ng/mL) IL-6/(pg/mL) CD4+/CD8+ Lac/(mmol/L) NT-proBNP/(pg/mL) 生存组 53 34 58.3±8.6 23.6±2.48 25 12.83±3.52 20.3±3.2 3.22±0.91 312±89 1.172±0.248 2.6±0.7 1 746±573 死亡组 24 16 67.5±10.9 24.8±2.83 15 15.21±4.74 24.8±3.8 6.19±1.30 437±102 0.799±0.211 3.5±0.9 2 241±659 t — 0.05* 2.48 0.80 4.30* 2.03 3.71 4.22 7.19 6.26 5.25 12.16 P — >0.05 < 0.01 >0.05 < 0.05 < 0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 *示χ2值 表 2 感染性休克病人死亡危险因素logistic回归分析
指标 B SE Waldχ2 P OR(95%CI) 年龄 0.17 0.024 0.47 < 0.05 1.180(1.036~1.211) 基础疾病 0.43 0.147 8.69 < 0.05 1.541(1.276~1.693) 血白细胞数 0.10 0.029 6.48 >0.05 1.107(0.910~1.288) PCT 0.15 0.043 10.54 >0.05 1.162(0.877~1.331) IL-6 0.19 0.058 9.29 < 0.05 1.211(1.080~1.370) Lac 0.27 0.047 11.68 < 0.05 1.307(1.078~1.536) NT-proBNP 0.31 0.102 9.19 < 0.05 1.360(1.182~1.493) CD4+/CD8+ -0.15 0.041 11.47 < 0.05 0.863(1.182~1.493) APACHEⅡ 0.63 0.264 8.66 < 0.05 1.882(1.420~2.071) 表 3 IL-6、NT-proBNP和CD4+/CD8+对感染性休克病人死亡的预测效能
变量 AUC 95%CI 灵敏度/% 特异度/% 约登指数 综合预测 0.840 0.749~0.932 89.2 84.7 0.739 CD4+/CD8+ 0.708 0.573~0.844 68.5 64.1 0.326 NT-proBNP 0.793 0.695~0.891 83.9 79.5 0.634 IL-6 0.678 0.556~0.799 74.2 78.6 0.528 -
[1] FERNANDO SM, ROCHWERG B, SEELY AJE. Clinical implications of the third international consensus definitions for sepsis and septic shock(Sepsis-3)[J]. CMAJ, 2018, 190(36): E1058. doi: 10.1503/cmaj.170149 [2] 叶龙强, 董绉绉, 石林惠, 等. 重症监护病房老年感染性休克患者的预后危险因素分析[J]. 中华临床感染病杂志, 2019, 12(3): 192. doi: 10.3760/cma.j.issn.1674-2397.2019.03.006 [3] WARD PA. Immunosuppression in sepsis[J]. JAMA, 2011, 306(23): 2618. doi: 10.1001/jama.2011.1831 [4] 张亮. 早期乳酸清除率对严重脓毒症和感染性休克预后的影响[J]. 蚌埠医学院学报, 2016, 41(4): 3. [5] DEUTSCHMAN CS. Imprecise medicine: The limitations of sepsis-3[J]. Crit Care Med, 2016, 44(5): 857. doi: 10.1097/CCM.0000000000001834 [6] RUDD KE, KISSOON N, LIMMATHUROTSAKUL D, et al. The global burden of sepsis: barriers and potential solutions[J]. Critical Care, 2018, 22(1): 232. doi: 10.1186/s13054-018-2157-z [7] CECCONI M, EVANS L, LEVY M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75. doi: 10.1016/S0140-6736(18)30696-2 [8] HOLUB M, DŽUPOVÁ O, RǓKOVÁ M, et al. Selected biomarkers correlate with the origin and severity of sepsis[J]. Mediators Inflamm, 2018, 2018: 7028267. [9] MICKIEWICZ B, TAM P, JENNE CN, et al. Integration of metabolic and inflammatory mediator profiles as a potential prognostic approach for septic shock in the intensive care unit[J]. Crit Care, 2015, 19(1): 11. doi: 10.1186/s13054-014-0729-0 [10] CLERE-JEHL R, HELMS J, KASSEM M, et al. Septic shock alters mitochondrial respiration of lymphoid cell-lines and human peripheral blood mononuclear cells: the role of plasma[J]. Shock, 2018, 51(1): 1. [11] RICHÉ F, CHOUSTERMAN BG, VALLEUR P, et al. Protracted immune disorders at one year after ICU discharge in patients with septic shock[J]. Crit Care, 2018, 22(1): 42. doi: 10.1186/s13054-017-1934-4 [12] AIMO A, JANUZZI JL JR, MUELLER C, et al. Admission high-sensitivity troponin T and NT-proBNP for outcome prediction in acute heart failure[J]. Int J Cardiol, 2019, 293: 137. doi: 10.1016/j.ijcard.2019.06.005 [13] SALAH K, STIENEN S, PINTO YM, et al. Prognosis and NT-proBNP in heart failure patients with preserved versus reduced ejection fraction[J]. Heart, 2019, 105(15): 1. -





 下载:
下载: