-
维持性血液透析(maintenance hemodialysis, MHD)是目前尿毒症病人肾脏替代治疗(renal replacement therapy, RRT)最常用的治疗方式[1]。血液透析技术的发展,明显延长了血液透析病人的生命周期,但其无法完全替代肾脏功能,常导致各种并发症[2],衰弱就是其中之一。衰弱是一组由于机体储备能力下降、多系统平衡失调,导致病人易脆性增加、抗应激能力下降的临床综合征,常与抑郁、跌倒、住院率与死亡率升高、日常生活能力与生活质量下降等有关[3-7]。有研究[8]表明,血液透析本身可能就是衰弱发生的重要原因之一,这无疑增加了MHD病人衰弱的发生率与研究必要性。一项最新的MHD病人衰弱的Meta分析[9]显示,MHD病人衰弱患病率高达50%。因此,积极地对MHD病人进行衰弱筛查,早期制定干预措施,将有助于减少临床不良结局的产生。本研究通过横断面调查,探索MHD病人衰弱的影响因素,建立个体化预测衰弱发生的列线图模型,为医护人员筛选高风险人群及早期制定干预措施提供依据。
-
采取便利抽样法,选择2021年2-10月在六安市人民医院血液净化中心进行MHD治疗的病人222例为研究对象。纳入标准: (1)透析时间≥3个月;(2)年龄≥18岁;(3)意识清楚,沟通正常;(4)知情同意,自愿参加。排除标准: (1)研究前3个月接受住院治疗;(2)合并精神类疾病或严重心血管疾病、严重感染、严重心脑血管疾病、恶性肿瘤、大出血等。所有病人均签署知情同意书。
-
(1) 收集病人的一般资料(性别、年龄、居住方式、居住地、工作性质、财务压力、锻炼、目前吸烟状况、目前饮酒状况、干体质量、睡眠质量、夜间睡眠时间)、临床资料(原发病、除肾脏病以外疾病、透析并发症数、透析频率、最近一年住院、残余肾功能、糖尿病、高血压、慢性阻塞性肺疾病、冠心病、贫血)及血液检查资料(钠、钙、无机磷、钾、总蛋白、白蛋白、尿素、肌酐、尿酸、膀抑素C、血红蛋白、红细胞、白细胞等)。(2)采用Frail量表进行衰弱筛查。此量表是国际老年营养学会在2012年提出[10],共5个项目,包括: 大部分时间或所有时间感到疲倦、独立上下10级台阶或1层楼能力受限、独立行走100 m能力受限、所患疾病>5种、1年内体质量下降>(5~10斤),各项“是”计1分,“否”计0分,总分0~5分,0分无衰弱、1~2分代表衰弱前期, ≥3分表示衰弱。CHAO等[11]研究发现,相对于其他5种衰弱测量工具,Frail量表简单便捷,在血液透析病人衰弱的筛查中具有更强的实用性。
-
采用t检验、χ2检验、Fisher确切概率法、非参数秩和检验、多因素logistic回归分析、受试者工作曲线(ROC)曲线与Homster-Lemeshow(H-L)拟合度检验。
-
本研究共纳入符合标准的病人222例,其中男134例,女88例,年龄(59.25±13.82)岁;发生衰弱85例,未发生衰弱137例,MHD病人衰弱发生率38.3%。衰弱组和非衰弱组病人在年龄、居住方式、体育锻炼、除肾脏病以外疾病个数、透析并发症个数、糖尿病、慢性阻塞性肺疾病、残余肾功能、冠心病、C反应蛋白(CRP)、睡眠质量、夜间睡眠时间、白蛋白水平、肌酐值、白细胞水平方面差异均有统计学意义(P < 0.05~P < 0.01),其他研究变量2组间差异均无统计学意义(P>0.05)(见表 1~2)。
项目 衰弱组
(n=85)非衰弱组
(n=137)χ2 P 性别 男 48(56.5) 86(62.8) 0.87 >0.05 女 37(43.5) 51(37.2) 年龄/岁 < 60 25(29.4) 91(66.4) 28.80 < 0.01 < ≥60 60(70.6) 46(33.6) 居住方式 独居 6(7.1) 20(14.6) 15.36 < 0.01 与配偶 55(64.7) 54(39.4) 与子女 9(10.6) 14(10.2) 与配偶和子女 15(17.6) 49(35.8) 居住地 城市 43(50.5) 80(58.4) 3.38 >0.05 城镇 23(27.1) 23(16.8) 农村 19(22.4) 34(24.8) 工作性质 脑力劳动 19(22.4) 28(20.4) 0.18 >0.05 脑力/体力劳动 23(27.1) 40(29.2) 体力劳动 43(50.5) 69(50.4) 财务压力 一点也不 5(5.9) 10(7.3) 5.60 >0.05 较小 16(18.8) 22(16.1) 一般 33(38.8) 63(46.0) 较大 29(34.1) 32(23.3) 非常大 2(2.4) 10(7.3) 原发病 糖尿病肾病 20(23.5) 36(26.3) 0.21 >0.05 非糖尿病肾病 65(76.5) 101(73.7) 体育锻炼 不锻炼 57(67.1) 62(45.2) 18.65 < 0.01 一周1次 9(10.6) 7(5.1) 一周2次 8(9.4) 16(11.7) 一周≥3次 11(12.9) 52(38.0) 除肾脏病以外的疾病数 0 18(21.2) 26(19.0) 24.28 < 0.01 1 9(10.6) 49(35.7) 2 24(28.2) 36(26.3) 3 24(28.2) 22(16.1) 4 8(9.4) 3(2.2) ≥5 2(2.4) 1(0.7) 透析并发症数 0 24(28.2) 54(39.4) 11.31 < 0.05 1 20(23.5) 44(32.1) 2 25(29.4) 30(21.9) 3 11(12.9) 7(5.1) 4 5(5.9) 2(1.5) 透析频率 每周2次 29(34.1) 34(24.8) 3.77 >0.05 2周5次 15(17.6) 34(24.8) 每周3次 40(47.1) 64(46.8) 其他 1(1.2) 5(3.6) 目前饮酒状况 从不 66(77.6) 101(73.7) 0.98 >0.05 戒酒 13(15.3) 28(20.5) 饮酒 6(7.1) 8(5.8) 目前吸烟状况 从不 63(74.1) 91(66.4) 1.46 >0.05 戒烟 10(11.8) 12(15.3) 吸烟 12(14.1) 22(18.3) 最近一年住院 没有 41(48.2) 84(61.3) 3.65 >0.05 住过 44(51.8) 53(38.7) 残余肾功能 有 14(16.5) 41(29.9) 5.10 < 0.05 无 71(83.5) 96(70.1) 糖尿病 有 44(51.8) 43(31.4) 9, 14 < 0.01 无 41(48.2) 94(68.6) 高血压 有 68(80.0) 112(81.8) 0.11 >0.05 无 17(20.0) 25(18.2) 慢性阻塞性肺疾病 有 6(7.1) 0(0.0) 11.79 < 0.01 无 79(92.9) 137(100.0) 贫血 有 52(61.2) 77(56.2) 0.53 >0.05 无 33(38.8) 60(43.8) 冠心病 有 31(36.5) 19(13.9) 15.36 < 0.01 无 54(63.5) 118(86.1) CRP/(mg/L) 0~8 53(62.4 108(79.4) 7.70 < 0.01 >8 32(37.6) 28(20.6) 睡眠质量 非常差 9(10.6) 4(2.9) 16.41 < 0.01 差 17(20.0) 15(10.9) 一般 47(55.3) 71(51.8) 好 12(14.1) 47(34.4) 夜间睡眠时间/h < 6 63(74.1) 50(36.5) 30.53 < 0.01 6~8 18(21.2) 61(44.5) >8 4(4.7) 26(19.0) 表 1 MHD病人衰弱单因素分析[n; 百分率(%)]
项目 衰弱组
(n=85)非衰弱组
(n=137)Z P 干体质量(x±s)/kg 61.63±11.24 61.40±9.93 0.16* >0.05 尿素(x±s)/(mmol/L) 26.51±6.98 26.63±7.29 0.13* >0.05 总蛋白/(g/L) 67.69(64.75, 71.3) 67.69(64.75, 71.5) 0.03 >0.05 白蛋白/(g/L) 39.4(36.35, 40.7) 41.2(38.2, 43.85) 3.97 < 0.01 尿酸/(μmol/L) 455.5(402.85, 521.45) 455.5(399.5, 536.35) 0.25 >0.05 膀抑素C/(mg/L) 5.84(5.495, 6.24) 5.95(5.54, 6.455) 1.64 >0.05 肌酐/(μmol/L) 937(779.95, 1065.5) 1050.6(890.35, 1229) 3.61 < 0.01 血红蛋白/(g/L) 107(95, 117) 109(101, 120) 1.71 >0.05 红细胞/(1012/L) 3.65(3.095, 4.163) 3.76(3.37, 4.157) 1.11 >0.05 白细胞/(109/L) 6.359(5.765, 8.185) 5.86(4.75, 6.845) 3.27 < 0.01 钠/(mmol/L) 138(135.25, 139.75) 138.67(136.6, 140.5) 1.74 >0.05 钙/ (mmol/L) 2.14(2.03, 2.245) 2.14(2.01, 2.26) 0.05 >0.05 无机磷/(mmol/L) 1.78(1.45, 2.26) 1.87(1.475, 2.225) 0.60 >0.05 钾/ (mmol/L) 4.56(4.15, 5.15) 4.63(4.02, 5.025) 0.61 >0.05 *示t值 表 2 MHD病人衰弱单因素分析[M(P25, P75)]
-
以单因素分析有统计学意义的因素(年龄、居住方式、锻炼、除肾脏病以外疾病个数、透析并发症个数、糖尿病、慢性阻塞性肺疾病、冠心病、残余肾功能、CRP、睡眠质量、夜间睡眠时间、白蛋白水平、白细胞水平、肌酐值纳)为自变量,MHD病人衰弱为因变量进行多因素logistic回归分析,各变量赋值见表 3。结果显示,年龄≥60岁、透析并发症增多、锻炼频率减少、夜间睡眠时间少和白蛋白水平低为MHD病人衰弱发生的危险因素(P < 0.05~P < 0.01)(见表 4)。
变量 代码 赋值 衰弱 Y 0=未衰弱, 1=衰弱 年龄 X1 1=年龄 < 60岁, 2=年龄≥60岁 透析并发症个数 X2 1=0个, 2=1个, 3=2个, 4=3个, 5=4个 锻炼 X3 1=0次/周, 2=1次/周, 3=2次/周, 4=≥3次/周 夜间睡眠时间 X4 1= < 6 h, 2=6~8 h, 3=>8 h 表 3 MHD病人衰弱发生多因素logistic回归分析赋值情况
影响因素 B SE Waldχ2 P OR 95%CI 年龄 1.241 0.341 13.28 < 0.01 3.460 1.775~6.747 透析并发症个数 0.497 0.164 9.19 < 0.05 1.644 1.192~2.268 锻炼 -0.567 0.141 16.08 < 0.01 0.567 0.430~0.748 夜间睡眠时间 -0.718 0.207 12.06 < 0.01 0.488 0.325~0.731 白蛋白水平 -0.101 0.039 6.62 < 0.05 0.904 0.838~0.976 常数项 3.450 1.810 3.63 >0.05 — — 表 4 MHD病人衰弱发生多因素logistic回归分析结果(n=222)
-
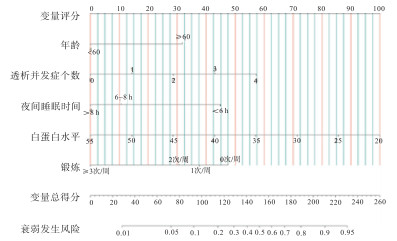
利用R软件将多因素logistic回归分析结果中独立危险因素: 年龄、白蛋白水平、透析并发症个数、锻炼、夜间睡眠时间绘制成列线图预测模型。首先对各独立因素进行评分,分别为31.5分(年龄≥60岁)、71分(白蛋白水平=30 g/L)、45分(夜间睡眠时间 < 6 h)、40分(锻炼=1次/周)、0分(透析并发症个数=0)。接着,将各项评分相加得总分,总分所对应的MHD衰弱发生风险的值即为模型预测该病人衰弱发生的概率值(见图 1)。
-
利用Bootstrap重抽样法重复抽样1 000次对列线图模型进行内部验证,计算一致性指数值为0.812,绘制的校准曲线图发现实际发生概率与预测发生概率一致性良好(见图 2)。H-L值定量分析得出列线图模型拟合度较好(χ2=8.99,P>0.05)。列线图预测模型的ROC曲线下面积为0.829,95%CI: 0.777~0.882,具有较好的区分度(见图 3)。进一步绘制临床决策曲线图发现,预测模型阈值概率在0.03~0.83时,模型具有较好的临床实用性(见图 4)。
-
列线图模型又叫Nomogramms模型,现已被广泛应用于医学各领域预测分析中, 通过可视化与图形化的方式展示了logistic分析的结果,更利于医护人员快速解读与准确判断预测,进而迅速做出临床决策[12]。本研究根据以往衰弱研究结果及临床经验,初步纳入36个影响因素,通过单因素分析、多因素logistic分析及临床经验判断,最终得到5项影响MHD病人衰弱发生的独立危险因素。基于此危险因素建立列线图预测模型,采用Bootstrap重抽样法进行内部验证,通过绘制ROC曲线、校准曲线和H-L值、DCA曲线发现该模型具有较高的区分度、精确度与临床实用性。由此说明本研究的列线图模型可以帮助临床医护人员对MHD衰弱高风险人群病人进行筛选,早期制定个性化干预方案,延缓并减少衰弱的发生。
本研究中MHD病人衰弱发生处于较高水平(38.2%),与LI等[13]研究结果相近(34.7%)。本研究发现,MHD病人衰弱组年龄≥60岁占70.6%,非衰弱组年龄 < 60岁占比66.4%,多因素logistic回归分析显示,高龄是MHD病人衰弱发生的独立危险因素,与李梦婷等[14-15]研究结果一致。年龄≥60岁MHD病人发生衰弱是年龄 < 60岁的3.460倍,列线图显示约增加31.5的影响权重。分析原因可能是,年龄的增长会引起机体新陈代谢和各器官功能下降,应激适应能力减弱,增加了衰弱的可能。另外随着年龄的增长体内性激素水平变化也可能与衰弱发生有关,一项纵向研究[16]证明,男性睾酮水平降低与肌肉质量减少、衰弱发生率增加密切相关。绝经后女性体内激素水平波动较大也被认为是衰弱发生原因之一[17]。提示护士在日常透析治疗前后要多关注高龄病人衰弱情况。
多因素logistic分析结果显示,血清白蛋白水平是MHD病人衰弱的独立危险因素,与既往陈琰等[18]研究结果一致。本研究列线图显示,白蛋白含量每减少5 mg/L列线图增加约13.8分的影响权重。血清白蛋白水平常被作为重要营养指标之一,蛋白质能量摄入减少、慢性炎症高消耗状态、透析治疗等因素导致MHD病人蛋白质能量浪费,出现血清低白蛋白状况。有研究[19]发现,透析病人血清白蛋白 < 32 g/L发生衰弱的风险是白蛋白≥39 g/L的1.89倍。血清白蛋白每增加1g/dL,血液透析病人虚弱评分降低0.4分[20]。另外,营养不良还会导致肌肉分解增加肌肉质量减少,而肌肉减少是衰弱的病理核心基础,肌少症的严重程度也与衰弱程度相关[21-22]。提示医护人员在透析治疗中要定期评估病人营养状况包括血清白蛋白检查,及时合理补充蛋白质,加强营养指导,延缓衰弱的发生。
血液透析病人由于各种疾病因素常表现为乏力、抑郁[23],不愿意进行规律的体育活动锻炼。研究报道[24]称,体育锻炼频率是老年人衰弱的独立危险因素。本研究显示,每周体育锻炼频率越高,发生衰弱的风险权重越低。体育锻炼是MHD病人衰弱发生的独立危险因素。体育锻炼活动可以增加氧峰值消耗和强度,可改善肌肉力量与身体素质,缓解血液透析病人的衰弱症状,提高生活质量[25-26]。KEHLER等[27]研究认为,中等强度体力活动和久坐时间与与衰弱具有相关性,久坐与女性衰弱相关性更强。因此,医护人员应根据病人实际情况指导病人进行一系列运动训练,包括抗阻力运动、呼吸肌训练、有氧运动等。
目前MHD病人衰弱与睡眠的相关研究相对较少。本研究显示,夜间睡眠时间是MHD病人发生的独立危险因素。睡眠是维持生命体活动必不可少的生理需要,睡眠时间的不足会导致机体注意力不能集中、焦虑抑郁,严重影响病人的健康。朴金龙[28]研究发现,平均睡眠时间 < 6 h是衰弱发生的独立危险因素。也有研究[29]认为,睡眠障碍会导致生长激素、胰岛素样生长因子-1和睾酮的分泌,进而增加肌肉蛋白减少,导致肌少症和衰弱。提示日常透析治疗中,要加强与病人沟通及时了解病人睡眠情况,对于睡眠时间不足者积极进行心理疏导或药物辅助治疗。
透析并发症个数是MHD病人衰弱发生的独立因素。分析原因可能是,透析并发症可能常会使病人不能按规定时间完成透析治疗,导致透析不充分,增加衰弱的发生风险。陈凌云等[30]研究结果也证实了上述观点。提示护士在透析过程中需密切测量病人生命体征并主动询问病情,预防透析并发症发生。
综上所述,MHD病人较易发生衰弱,本研究基于年龄、白蛋白水平、体育锻炼、透析并发症个数和夜间睡眠时间这5个独立危险因素构建的列线图预测模型,具有较好的区分度、精确度与临床实用性,可对MHD病人衰弱风险进行个体化预测,筛选高风险人群,制定个体化干预措施。
维持性血液透析病人衰弱发生风险列线图模型的构建
Establishment of nomogram model for the risk of frailty in maintenance hemodialysis patients
-
摘要:
目的分析维持性血液透析病人衰弱发生的影响因素, 并建立衰弱发生风险的列线图模型。 方法采用便利抽样法选取维持性血液透析病人222例, 根据是否发生衰弱分为衰弱组(n=85)和非衰弱组(n=137)。采用单因素与多因素logistic回归模型筛选影响维持性血液透析病人衰弱的危险因素。采用Bootstrap进行模型内部验证。使用受试者工作曲线、Homster-Lemeshow拟合度检验合并校准曲线图、临床决策曲线图分别对模型进行性能评价。 结果222例维持性血液透析病人中发生衰弱共85例, 衰弱发生率为38.3%。logistic回归分析表明, 年龄≥ 60岁(OR=3.460, 95%CI: 1.775~6.747)、透析并发症个数(OR=1.644, 95%CI: 1.192~2.268)、白蛋白水平(OR=0.904, 95%CI: 0.838~0.976)、锻炼(OR=0.567, 95%CI: 0.430~0.748)、夜间睡眠时间(OR=0.488, 95%CI: 0.325~0.731)均是维持性血液透析病人衰弱发生的独立危险因素(P < 0.05~P < 0.01)。基于5项独立危险因素建立MHD病人衰弱发生的列线图预测模型。受试者工作曲线曲线下面积为0.829(95%CI: 0.777~0.882), Bootstrap重抽样法进行内部验证后, 模型的一致性指数为0.812。列线图模型拟合度较好(P>0.05);校准曲线图显示, 预测概率与实际概率发生率的相关性良好。临床决策曲线图表明模型阈值概率在0.03~0.83时, 此模型具有较好的临床实用性。 结论基于影响维持性血液透析病人衰弱的危险因素建立的预测模型具有良好的区分度、一致性与临床实用性, 可为预防维持性血液透析病人衰弱的发生提供指导。 Abstract:ObjectiveTo analyze the influencing factors of frailty in maintenance hemodialysis (MHD) patients and establish a nomogram model for frailty risk. MethodsA total of 222 patients with MHD were selected by convenient sampling method.According to whether the patients had frailty, they were divided into frailty group (n=85) and non-frailty group (n=137).Univariate and multivariate logistic regression model were used to screen the risk factors of frailty in patients with MHD.Bootstrap was used for internal verification of the model.The receiver operating characteristic (ROC) curve, Homster-Lemeshow goodness-of-fit test combined with calibration curve, and clinical decision curve analysis (DCA) were used to evaluate the performance of the model. ResultsThere were 85 cases of frailty in 222 patients with MHD, and the incidence of frailty was 38.3%.Logistic regression analysis showed that age ≥60 years old (OR=3.454, 95%CI: 1.775-6.719), the number of dialysis complications (OR=1.609, 95%CI: 1.173-2.207), albumin level (OR=0.901, 95%CI: 0.835-0.971), physical exercise (OR=0.684, 95%CI: 0.564-0.829) and night sleep time (OR=0.476, 95%CI: 0.316-0.716) were independent risk factors of frailty in patients with MHD (P < 0.05 to P < 0.01).Based on five independent risk factors, the nomogram prediction model of frailty in MHD patients was established.The area under ROC curve was 0.829 (95%CI: 0.777-0.882).After internal verification by Bootstrap resampling method, the consistency index of the model was 0.812.The fitting degree of nomograph model was good (P>0.05).The calibration curve showed that the correlation between the predicted probability and the actual probability incidence was good.The DCA showed that the model had good clinical practicability when the threshold probability was 0.03-0.83. ConclusionsThe prediction model based on the risk factors affecting the frailty of MHD patients has good differentiation, consistency and clinical practicability, and can provide guidance for the prevention of the frailty of MHD patients. -
Key words:
- maintenance hemodialysis /
- frailty /
- nomogram
-
表 1 MHD病人衰弱单因素分析[n; 百分率(%)]
项目 衰弱组
(n=85)非衰弱组
(n=137)χ2 P 性别 男 48(56.5) 86(62.8) 0.87 >0.05 女 37(43.5) 51(37.2) 年龄/岁 < 60 25(29.4) 91(66.4) 28.80 < 0.01 < ≥60 60(70.6) 46(33.6) 居住方式 独居 6(7.1) 20(14.6) 15.36 < 0.01 与配偶 55(64.7) 54(39.4) 与子女 9(10.6) 14(10.2) 与配偶和子女 15(17.6) 49(35.8) 居住地 城市 43(50.5) 80(58.4) 3.38 >0.05 城镇 23(27.1) 23(16.8) 农村 19(22.4) 34(24.8) 工作性质 脑力劳动 19(22.4) 28(20.4) 0.18 >0.05 脑力/体力劳动 23(27.1) 40(29.2) 体力劳动 43(50.5) 69(50.4) 财务压力 一点也不 5(5.9) 10(7.3) 5.60 >0.05 较小 16(18.8) 22(16.1) 一般 33(38.8) 63(46.0) 较大 29(34.1) 32(23.3) 非常大 2(2.4) 10(7.3) 原发病 糖尿病肾病 20(23.5) 36(26.3) 0.21 >0.05 非糖尿病肾病 65(76.5) 101(73.7) 体育锻炼 不锻炼 57(67.1) 62(45.2) 18.65 < 0.01 一周1次 9(10.6) 7(5.1) 一周2次 8(9.4) 16(11.7) 一周≥3次 11(12.9) 52(38.0) 除肾脏病以外的疾病数 0 18(21.2) 26(19.0) 24.28 < 0.01 1 9(10.6) 49(35.7) 2 24(28.2) 36(26.3) 3 24(28.2) 22(16.1) 4 8(9.4) 3(2.2) ≥5 2(2.4) 1(0.7) 透析并发症数 0 24(28.2) 54(39.4) 11.31 < 0.05 1 20(23.5) 44(32.1) 2 25(29.4) 30(21.9) 3 11(12.9) 7(5.1) 4 5(5.9) 2(1.5) 透析频率 每周2次 29(34.1) 34(24.8) 3.77 >0.05 2周5次 15(17.6) 34(24.8) 每周3次 40(47.1) 64(46.8) 其他 1(1.2) 5(3.6) 目前饮酒状况 从不 66(77.6) 101(73.7) 0.98 >0.05 戒酒 13(15.3) 28(20.5) 饮酒 6(7.1) 8(5.8) 目前吸烟状况 从不 63(74.1) 91(66.4) 1.46 >0.05 戒烟 10(11.8) 12(15.3) 吸烟 12(14.1) 22(18.3) 最近一年住院 没有 41(48.2) 84(61.3) 3.65 >0.05 住过 44(51.8) 53(38.7) 残余肾功能 有 14(16.5) 41(29.9) 5.10 < 0.05 无 71(83.5) 96(70.1) 糖尿病 有 44(51.8) 43(31.4) 9, 14 < 0.01 无 41(48.2) 94(68.6) 高血压 有 68(80.0) 112(81.8) 0.11 >0.05 无 17(20.0) 25(18.2) 慢性阻塞性肺疾病 有 6(7.1) 0(0.0) 11.79 < 0.01 无 79(92.9) 137(100.0) 贫血 有 52(61.2) 77(56.2) 0.53 >0.05 无 33(38.8) 60(43.8) 冠心病 有 31(36.5) 19(13.9) 15.36 < 0.01 无 54(63.5) 118(86.1) CRP/(mg/L) 0~8 53(62.4 108(79.4) 7.70 < 0.01 >8 32(37.6) 28(20.6) 睡眠质量 非常差 9(10.6) 4(2.9) 16.41 < 0.01 差 17(20.0) 15(10.9) 一般 47(55.3) 71(51.8) 好 12(14.1) 47(34.4) 夜间睡眠时间/h < 6 63(74.1) 50(36.5) 30.53 < 0.01 6~8 18(21.2) 61(44.5) >8 4(4.7) 26(19.0) 表 2 MHD病人衰弱单因素分析[M(P25, P75)]
项目 衰弱组
(n=85)非衰弱组
(n=137)Z P 干体质量(x±s)/kg 61.63±11.24 61.40±9.93 0.16* >0.05 尿素(x±s)/(mmol/L) 26.51±6.98 26.63±7.29 0.13* >0.05 总蛋白/(g/L) 67.69(64.75, 71.3) 67.69(64.75, 71.5) 0.03 >0.05 白蛋白/(g/L) 39.4(36.35, 40.7) 41.2(38.2, 43.85) 3.97 < 0.01 尿酸/(μmol/L) 455.5(402.85, 521.45) 455.5(399.5, 536.35) 0.25 >0.05 膀抑素C/(mg/L) 5.84(5.495, 6.24) 5.95(5.54, 6.455) 1.64 >0.05 肌酐/(μmol/L) 937(779.95, 1065.5) 1050.6(890.35, 1229) 3.61 < 0.01 血红蛋白/(g/L) 107(95, 117) 109(101, 120) 1.71 >0.05 红细胞/(1012/L) 3.65(3.095, 4.163) 3.76(3.37, 4.157) 1.11 >0.05 白细胞/(109/L) 6.359(5.765, 8.185) 5.86(4.75, 6.845) 3.27 < 0.01 钠/(mmol/L) 138(135.25, 139.75) 138.67(136.6, 140.5) 1.74 >0.05 钙/ (mmol/L) 2.14(2.03, 2.245) 2.14(2.01, 2.26) 0.05 >0.05 无机磷/(mmol/L) 1.78(1.45, 2.26) 1.87(1.475, 2.225) 0.60 >0.05 钾/ (mmol/L) 4.56(4.15, 5.15) 4.63(4.02, 5.025) 0.61 >0.05 *示t值 表 3 MHD病人衰弱发生多因素logistic回归分析赋值情况
变量 代码 赋值 衰弱 Y 0=未衰弱, 1=衰弱 年龄 X1 1=年龄 < 60岁, 2=年龄≥60岁 透析并发症个数 X2 1=0个, 2=1个, 3=2个, 4=3个, 5=4个 锻炼 X3 1=0次/周, 2=1次/周, 3=2次/周, 4=≥3次/周 夜间睡眠时间 X4 1= < 6 h, 2=6~8 h, 3=>8 h 表 4 MHD病人衰弱发生多因素logistic回归分析结果(n=222)
影响因素 B SE Waldχ2 P OR 95%CI 年龄 1.241 0.341 13.28 < 0.01 3.460 1.775~6.747 透析并发症个数 0.497 0.164 9.19 < 0.05 1.644 1.192~2.268 锻炼 -0.567 0.141 16.08 < 0.01 0.567 0.430~0.748 夜间睡眠时间 -0.718 0.207 12.06 < 0.01 0.488 0.325~0.731 白蛋白水平 -0.101 0.039 6.62 < 0.05 0.904 0.838~0.976 常数项 3.450 1.810 3.63 >0.05 — — -
[1] LIEW A. Perspectives in renal replacement therapy: Haemodialysis[J]. Nephrology (Carlton), 2018, 23 Suppl 4: 95. [2] 乔志, 刘蕊. 基于跨理论模型的延续护理对急性肾衰竭血液透析患者生理功能和主观幸福感的影响[J]. 徐州医科大学学报, 2021, 41(2): 153. doi: 10.3969/j.issn.2096-3882.2021.02.016 [3] 竹琳, 万正红, 温怡, 等. 维持性血液透析患者衰弱的发生情况及其对跌倒的影响[J]. 现代临床护理, 2017, 16(11): 9. doi: 10.3969/j.issn.1671-8283.2017.11.003 [4] SY J, MCCULLOCH CE, JOHANSEN KL. Depressive symptoms, frailty, and mortality among dialysis patients[J]. Hemodial Int, 2019, 23(2): 239. doi: 10.1111/hdi.12747 [5] DENT E, MARTIN FC, BERGMAN H, et al. Management of frailty: opportunities, challenges, and future directions[J]. Lancet, 2019, 394(10206): 1376. doi: 10.1016/S0140-6736(19)31785-4 [6] NOORI N, SHARMA PARPIA A, LAKHANI R, et al. Frailty and the quality of life in hemodialysis patients: the importance of waist circumference[J]. J Ren Nutr, 2018, 28(2): 101. doi: 10.1053/j.jrn.2017.07.007 [7] 宋莹莹, 林紫薇, 丁苗苗, 等. 住院老年心房颤动病人衰弱状态及影响因素分析[J]. 蚌埠医学院学报, 2021, 46(10): 1365. [8] SALTER ML, GUPTA N, MASSIE AB, et al. Perceived frailty and measured frailty among adults undergoing hemodialysis: a cross-sectional analysis[J]. BMC Geriatr, 2015, 15: 52. doi: 10.1186/s12877-015-0051-y [9] 吴淑琳, 宋洁, 肖萍, 等. 维持性血液透析患者衰弱发生率及影响因素的系统评价[J]. 中华护理教育, 2021, 18(4): 352. doi: 10.3761/j.issn.1672-9234.2021.04.013 [10] MORLEY JE, MALMSTROM TK, MILLER DK. A simple frailty questionnaire (FRAIL) predicts outcomes in middle aged African Americans[J]. J Nutr Health Aging, 2012, 16(7): 601. doi: 10.1007/s12603-012-0084-2 [11] CHAO CT, HSU YH, CHANG PY, et al. Simple self-report FRAIL scale might be more closely associated with dialysis complications than other frailty screening instruments in rural chronic dialysis patients[J]. Nephrology (Carlton), 2015, 20(5): 321. doi: 10.1111/nep.12401 [12] WEI L, CHAMPMAN S, LI X, et al. Beliefs about medicines and non-adherence in patients with stroke, diabetes mellitus and rheumatoid arthritis: a cross-sectional study in China[J]. BMJ Open, 2017, 7(10): e017293. doi: 10.1136/bmjopen-2017-017293 [13] LI Y, ZHANG D, MA Q, et al. The impact of frailty on prognosis in elderly hemodialysis patients: a prospective cohort study[J]. Clin Interv Aging, 2021, 16: 1659. doi: 10.2147/CIA.S329665 [14] 李梦婷, 李国宏, 张留平. 维持性血液透析患者衰弱现状及影响因素[J]. 齐鲁护理杂志, 2019, 25(7): 28. doi: 10.3969/j.issn.1006-7256.2019.07.009 [15] GESUAIDO GD, DUARTE JG, ZAZZETTA MS, et al. Frailty and associated risk factors in patients with chronic kidney disease on dialysis[J]. Cien Saude Colet, 2020, 25(11): 4631. doi: 10.1590/1413-812320202511.03482019 [16] CHIANG JM, KAYSEN GA, SEGAL M, et al. Low testosterone is associated with frailty, muscle wasting and physical dysfunction among men receiving hemodialysis: a longitudinal analysis[J]. Nephrol Dial Transplant, 2019, 34(5): 802. doi: 10.1093/ndt/gfy252 [17] 田鹏, 杨宁, 郝秋奎, 等. 中国老年衰弱患病率的系统评价[J]. 中国循证医学杂志, 2019, 19(6): 656. [18] 陈琰, 郑淑蓓, 郑育, 等. 维持性血液透析患者的衰弱情况及其影响因素[J]. 中华肾脏病杂志, 2017, 33(10): 763. [19] JOHANSEN KL, CHERTOW GM, JIN C, et al. Significance of frailty among dialysis patients[J]. J Am Soc Nephrol, 2007, 18(11): 2960. doi: 10.1681/ASN.2007020221 [20] JOHANSEN KL, DALRYMPLE LS, DELGADO C, et al. Factors associated with frailty and its trajectory among patients on hemodialysis[J]. Clin J Am Soc Nephrol, 2017, 12(7): 1100. doi: 10.2215/CJN.12131116 [21] 武力, 郑燕蓉, 柴源. 老年住院患者衰弱程度与肌肉减少症严重程度的相关性分析[J]. 现代医学, 2020, 48(5): 647. [22] 陶晓春, 胡安梅, 鲁新萍, 等. 社区老人衰弱综合征与肌少症的相关性[J]. 中国老年学杂志, 2017, 37(23): 5966. [23] 王亚楠, 姜亚芳. 维持性血液透析病人抑郁发生现状及影响因素分析[J]. 蚌埠医学院学报, 2020, 45(7): 977. [24] 杨振, 张会君. 社区老年慢性病患者认知衰弱风险预测模型的构建及验证[J]. 护理学杂志, 2021, 36(12): 86. [25] BARCELLOS FC, SANTOS IS, UMPIERRE D, et al. Effects of exercise in the whole spectrum of chronic kidney disease: a systematic review[J]. Clin Kidney J, 2015, 8(6): 753. [26] KANG SH, DO JY, JEONG HY, et al. The clinical significance of physical activity in maintenance dialysis patients[J]. Kidney Blood Press Res, 2017, 42(3): 575. [27] KEHLER DS, CLARA I, HIEBERT B, et al. Sex-differences in relation to the association between patterns of physical activity and sedentary behavior with frailty[J]. Arch Gerontol Geriatr, 2020, 87: 103972. [28] 朴金龙. 2型糖尿病患者并衰弱的危险因素Logistic回归分析及疗养建议[J]. 中国疗养医学, 2021, 30(1): 25. [29] YUAN H, ZHANG Y, XUE G, et al. Exploring psychosocial factors associated with frailty incidence among patients undergoing maintenance hemodialysis[J]. J Clin Nurs, 2020, 29(9/10): 1695. [30] 陈凌云, 倪松, 施凌云, 等. 尿毒症患者维持性血液透析疲乏与衰弱发生率及其影响因素研究[J]. 中国中西医结合肾病杂志, 2021, 22(2): 116. -





 下载:
下载: