-
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种头颈部常见恶性肿瘤,国际癌症研究机构数据显示,2018年全球新增NPC病例约有12.9万例,约占全年诊断出的所有癌症的0.7%,早期NPC病人的主要治疗方法是放射治疗[1-3]。晚期病人国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南建议放化疗和辅助化疗或诱导化疗联合治疗[4]。研究[5]表明,晚期病人10年总生存率低于50%,经联合治疗的Ⅲ~ⅣA~B期病人30%以上发生远处转移,这也是鼻咽癌NPC病人致死的主要原因。电压门控钠离子通道β4亚基(SCN4B/β4)是钠离子通道的阻遏蛋白,也是一种细胞黏附分子,对细胞聚集、浸润、迁移等有作用[6]。BON等[7]发现在乳腺癌组织中SCN4B/β4对肿瘤细胞侵袭发挥作用。目前对SCN4B/β4在NPC组织中的表达与预后的关系尚未见相关报道,本研究检测SCN4B/β4在NPC组织中的表达, 分析其与临床因素和预后的相关性,为寻找NPC预后生物标志物提供依据。
HTML
-
2012年6月至2014年7月收集90例在蚌埠医学院第一附属医院治疗的NPC病人,其中男51例,女39例,年龄27~75岁,病人均经病理检查确诊为鳞状上皮细胞癌,临床分期Ⅰ期18例,Ⅱ期15例,Ⅲ期27例,Ⅳ期30例,行病理检查判定TMN分期、有无淋巴结转移及有无远处转移等。所有病人临床资料完整,并自愿提供NPC组织标本,活检前均未接受过放疗或化疗,收集病人5年随访资料。此外,20份存档的石蜡包埋正常鼻咽黏膜组织(主要为鼻咽黏膜慢性炎)标本作为对照组。
-
SCN4B/β4蛋白多克隆抗体(Affinity Biosciences, USA)及ElivisionTM Plus免疫组织化学试剂盒(福州迈新)购自公司,SCN4B/β4蛋白为兔抗人原液,工作浓度1∶ 200。
-
采用ElivisionTM Plus免疫组织化学法检测SCN4B/β4蛋白表达情况,根据说明书操作: 在10%甲醛溶液中固定NPC和非肿瘤性鼻咽组织标本,石蜡包埋后将其切成连续切片,厚度为3 μm。脱蜡和水化,经微波修复法在枸橼酸盐缓冲液中进行组织切片抗原修复。组织切片滴加第一抗体,室温下孵育1 h或4 ℃过夜,PBS冲洗,浸入反应增强液,室温下孵育20 min,PBS冲洗,滴加酶标抗兔IgG聚合物,室温下孵育半小时,PBS冲洗,DAB显色试剂显色,DAB显色试剂现配现用。终止显色,苏木精(福州迈新生物技术开发有限公司)重新染色(如有必要可用1%盐酸乙醇分化),PBS返蓝,标本浸入梯度乙醇脱水,二甲苯清洗,中性树胶封片(福州迈新生物技术开发有限公司)。用PBS代替空白对照组一抗、二抗,其余步骤同上。
-
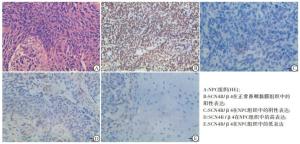
显微镜下观察NPC组织,SCN4B/β4主要在细胞膜、细胞质中出现黄色或棕黄色颗粒为阳性表达。评分标准如下:细胞膜无着色,为阴性(-);任何比例细胞为微弱、不完整着色,为弱阳性(+);>10%的细胞为完整但不均匀着色,呈弱至中等强度棕黄色,为阳性(2+);>30%的细胞为完整着色,呈强棕褐色,为强阳性(3+);其中,“-~+”定义为蛋白低表达,“2+~3+”定义为蛋白高表达[8]。
-
按国际抗癌联盟UICC分期第8版NPC分期标准对入组的NPC病人进行TNM分期[9]。
-
采用χ2检验、Spearman相关分析及Kaplan-Meier分析。
1.1. 一般资料
1.2. 主要试剂和方法
1.2.1. 试剂
1.2.2. 方法
1.2.3. 结果判断
1.2.4. 分期方法
1.3. 统计学方法
-
免疫组织化学结果显示,与对照组相比,SCN4B/β4蛋白在癌组织中的表达明显下调(见图 1);SCN4B/β4蛋白在对照组中高表达率为85.0%(17/20),在NPC组织中高表达率为30.0%(27/90),差异有统计学意义(χ2=19.31,P < 0.01)。
-
SCN4B/β4蛋白在不同性别、年龄NPC中的表达差异无统计学意义(P>0.05)。SCN4B/β4蛋白表达在不同T分期、N分期、M分期、临床分期差异有统计学意义(P < 0.05~P < 0.01),T1~T2期、M0期、Ⅰ~Ⅱ期SCN4B/β4蛋白高表达率高于T3~T4分期、M1分期和Ⅲ~Ⅳ期,随N分期增加,SCN4B/β4蛋白高表达率下降(见表 2)。SCN4B/β4蛋白表达与局部浸润、淋巴结转移、远处转移和临床分期有相关性(P < 0.05)(见表 3)。
临床特征 n SCN4B/β4蛋白 χ2 P 高表达 低表达 年龄/岁 ≤50
>5048
4212(25.0)
15(35.7)36(75.0)
27(64.3)1.22 >0.05 性别 男
女51
3913(25.5)
14(35.9)38(74.5)
25(64.1)1.14 >0.05 T分期 T1~T2
T3~T444
4618(40.9)
9(19.6)26(59.1)
37(80.4)4.88 < 0.05 N分期 N0 30 13(43.3) 17(56.7) N1
N218
247(38.9)
6(25.0)11(61.1)
18(75.0)2.80* < 0.01 N3 18 1(5.6) 17(94.4) M分期 M0
M171
1925(35.2)
2(10.5)46(64.8)
17(89.5)4.35 < 0.05 临床分期 Ⅰ~Ⅱ期
Ⅲ~Ⅳ期33
5717(51.5)
10(17.5)16(48.5)
47(82.5)11.47 < 0.01 *示Zc值 项目 SCN4B/β4蛋白 r P T分期(局部浸润) 0.233 < 0.05 N分期(淋巴结转移) 0.296 < 0.01 M分期(远处转移) 0.220 < 0.05 临床分期 0.357 < 0.01 -
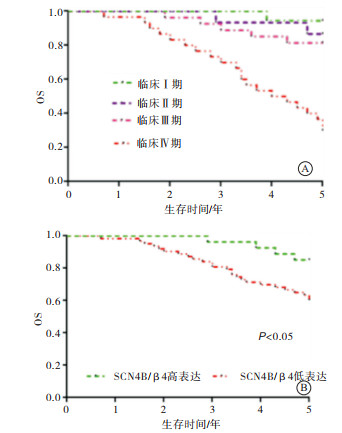
2017年6月至2019年7月进行电话随访,分析病人5年生存率。5年的总生存(OS)率为67.8%,临床Ⅰ期为94.4%,Ⅱ期为93.3%,Ⅲ期为81.5%,Ⅳ期为30.0%(见图 2A)。SCN4B/β4高表达生存率为85.2%,SCN4B/β4低表达5年生存率为60.3%,高表达SCN4B/β4病人的5年OS率高于低表达SCN4B/β4病人(χ2=5.35,P < 0.05)(见图 2B)。
2.1. SCN4B/β4蛋白表达与NPC临床病理特征的关系
2.2. SCN4B/β4蛋白表达与临床因素之间的相关性
2.3. SCN4B/β4蛋白表达水平与NPC病人预后分析
-
NPC是一种具高度侵袭性的上皮组织的恶性肿瘤,在特定地区如东南亚地区流行,尤其中国南方人群的NPC发病率和死亡率明显偏高。SCN4B/β4基因定位于染色体11q23.33,含有5个外显子,编码228个氨基酸残基构成的蛋白,β4氨基酸序列包括一个N端切除信号序列、一个细胞外5型免疫球蛋白样(Ig)折叠、一个跨膜α螺旋和一个短胞内C端[10]。电压门控钠离子通道是在可兴奋细胞中产生动作电位所需的跨膜蛋白,由一个α亚基和一个或几个β亚基组成,其中β亚基(β1-β4)是调节细胞过程的重要多功能信号分子,如细胞黏附和细胞迁移[11],与乳腺癌、前列腺癌及一些其他类型癌症的侵袭和转移行为有关。
侵袭性癌细胞具有重要的可塑性,使其能够使用不同的侵袭模式,促进肿瘤生长和转移的发展[12]。癌细胞的转移能力取决于侵入细胞外基质(ECM)的能力,ECM是一种非细胞成分,由多种分子组成,包括蛋白质、糖蛋白和蛋白多糖,在许多类型的肿瘤微环境中受到异常调节,具有不同的物理和化学特性,可提供刚度、孔隙度和空间结构,可作为细胞迁移的载体,锚定或运动轨迹[13]。研究[14]证明,在未见成纤维细胞的脑肿瘤中,间充质干细胞样细胞似乎参与ECM的重塑,并在脑肿瘤中提供侵袭性基质条件。SCN4B基因是可兴奋组织中电压门控钠离子通道的辅助亚基,编码β4蛋白并在正常上皮组织中表达,经乳腺癌组织活检,原发性和转移性肿瘤中的β4蛋白表达水平不同,敲低SCN4B基因的表达可促使RhoA通路活性增强,同时ECM降解活性保持不变,过表达细胞中β4蛋白的C端可阻止RhoA通路过度活化,从而降低癌细胞的转移性[7]。本研究中,SCN4B/β4的高表达与TNM分期、淋巴结转移、远处转移有一定的负相关关系,这也与上述SCN4B/β4抑制癌细胞转移机制相符合。
研究[15]表明,检测正常甲状腺组织和甲状腺乳头状癌(papillary thyroid cancer,PTC)组织中的SCN4B/β4蛋白表达水平,正常甲状腺组织中SCN4B/β4蛋白阳性表达一般为中度,在所检测的4例PTC组织中,SCN4B/β4蛋白低表达的仅2例,而剩下的2例中SCN4B/β4蛋白完全不表达,由此表明,在PTC组织中SCN4B/β4蛋白表达水平下调。在乳腺癌中,与正常组织相比,SCN4B基因在肿瘤和侵袭性癌细胞中的表达显著降低,随着侵袭性的增加(从Ⅰ级到Ⅱ级),SCN4B基因的表达逐渐降低,在高级别肿瘤和转移癌中几乎完全不表达,过表达SCN4B基因,肿瘤的生长和发展及癌细胞的侵袭性明显下调[7]。本研究中,NPC组SCN4B /β4表达水平明显低于对照组,且NPC组SCN4B/β4蛋白高表达率低于对照组,这与上述结论一致。
研究[15]已证实,SCN4B/β4表达与PTC中的淋巴结侵袭和转移有关,SCN4B/β4的表达在淋巴结转移病例中显著下调,生存数据分析显示SCN4B/β4表达也与病人的预后情况有关,在典型的PTC亚型中复发概率最高,SCN4B基因在复发病例中表达明显下调,SCN4B表达与复发率和淋巴结侵袭率呈负相关关系,无残留肿瘤、低TNM分期和高SCN4B表达(作为分类变量)或增加的SCN4B表达(作为连续变量)与有利的无复发生存率相关。本研究也发现,TNM分期越高、有淋巴结转移、有远处转移,NPC组织中SCN4B/β4表达越低。这与上述结论一致。本研究预后分析也显示,SCN4B/β4低表达组5年生存率明显低于SCN4B/β4高表达组,这说明SCN4B/β4高表达能明显有利于NPC病人预后。
综上所述,SCN4B/β4在NPC组织中表达下调,且其表达与TNM分期及预后相关,这些结果表明,SCN4B/β4可能在NPC的转移中起重要作用,可能成为NPC预后的生物标志物。







 DownLoad:
DownLoad: