-
三阴性乳腺癌(triple negative breast cancer, TNBC)是指雌激素受体(estrogen receptors, ER)、孕激素受体(progesterone receptors, PR)和人类表皮生长因子受体2(human epidermal growth factor receptor 2, Her-2)均为阴性的乳腺癌。TNBC恶性程度高、侵袭性强、易远处转移、预后差、对内分泌及靶向治疗反应不敏感,目前尚缺乏有效的治疗方案。因此,寻找有效的靶向治疗分子,对TNBC的早期诊断及治疗至关重要。p53是与肿瘤高度相关的抑癌基因,在乳腺癌的发生发展过程中起着重要的作用。转录共激活因子PDZ结合基序(transcriptional co-activator with PDZ binding motif, TAZ)是Hippo信号通路下游主要的效应分子之一,具有调控细胞增殖、分化、侵袭转移的作用。TAZ作为重要的致癌基因在多种人类肿瘤中存在高表达。本文以此为出发点,通过免疫组织化学方法检测p53和TAZ在TNBC组织中的表达,探讨p53、TAZ与TNBC病人的临床病理特征的关系,为TNBC的靶向治疗提供依据。现作报道。
HTML
-
收集2013年11月至2014年12月我科收治的TNBC病人30例,取同期非三阴性乳腺癌(non-triplenegative breast cancer, non-TNBC)病人30例作对照组。所有病人均为女性,年龄28~72岁;肿瘤大小≤2 cm 30例,>2~5 cm 26例,>5 cm 4例;无淋巴结转移28例,有淋巴结转移32例;TNM分期:Ⅰ期15例,Ⅱ期29例,Ⅲ期16例;组织学分级:Ⅰ~Ⅱ级38例,Ⅲ级22例。所有病人术前均未接受过放疗、化疗、靶向及内分泌治疗,入院后经我院病理科确诊为浸润性乳腺癌后行乳腺癌改良根治术。TNBC组和non-TNBC组比较,年龄、TNM分期和组织学分级差异无统计学意义(P>0.05),TNBC组肿瘤大小>2 cm、淋巴结转移率均大于non-TNBC组(P<0.05和P<0.01)(见表 1)。
分组 n 年龄/岁 肿瘤大小/cm TNM分期 淋巴结转移 组织学分级 ≤45 >45 ≤2 >2 Ⅰ Ⅱ Ⅲ 无 有 Ⅰ~Ⅱ Ⅲ TNBC组 30 15 15 11 19 10 13 7 20 10 17 13 non-TNBC组 30 11 19 19 11 5 16 9 8 22 21 9 χ2 — 1.09 4.27 2.23 9.64 1.15 P — >0.05 < 0.05 >0.05 < 0.01 >0.05 -
p53抗体购自福州迈新生物技术开发有限公司,兔抗人TAZ抗体购自美国Abcam公司(ab110239)。所有标本均经10%甲醛溶液固定,采用免疫组织化学标记(S-P法)进行检测。石蜡标本常规切片后脱蜡、水化,蒸馏水冲洗,用PBS(pH=7.4)冲洗3次,每次3 min。高温高压对组织抗原进行修复,冷却至室温,PBS缓冲液浸泡5 min,重复3次。3%过氧化氢室温下孵育10 min,阻断内源性过氧化物酶,PBS冲洗3次,每次3 min。甩去PBS,滴加第一抗体(p53抗体/TAZ抗体),4 ℃过夜。PBS冲洗3次,每次3 min,甩去PBS,滴加二抗(根据福州迈新生物技术开发有限公司和Abcam公司二抗试剂盒说明书进行操作),PBS冲洗3次,每次3 min。甩去PBS,滴加DAB显色液,蒸馏水冲洗,进行复染,脱水,透明,自然干燥后封片。
-
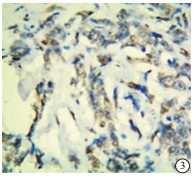
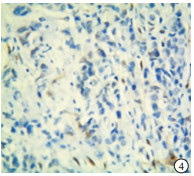
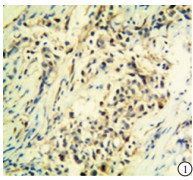
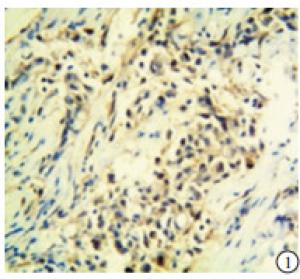
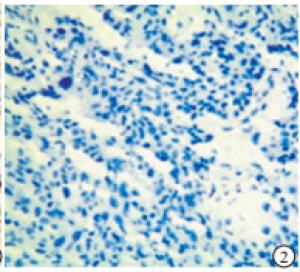
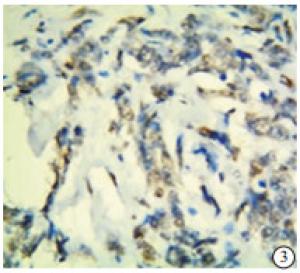
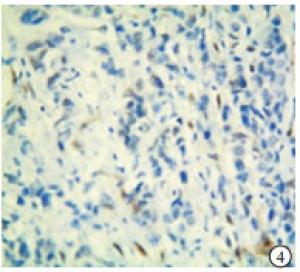
本实验中的病理检测结果的判断由我院病理科2名高年资副主任医师担任。p53的阳性染色结果为细胞核中出现棕黄色颗粒;TAZ蛋白表达在细胞核和/或细胞质中,并呈棕黄色颗粒为阳性。随机选取5个高倍镜(200倍)视野,根据细胞着色比例和染色强度进行评价。细胞着色比例: < 10%记为0分,10%~25%记为1分,>25%~50%记为2分,>50%~75%记为3分,>75%记为4分;染色强度:无着色记为0分,淡黄色记为1分,黄色记为2分,棕黄色记为3分。上述两项结果相乘,得分 < 3为阴性,≥3为阳性。
-
采用χ2检验和Spearman秩相关分析。
1.1. 临床资料
1.2. p53和TAZ检测方法
1.3. 结果判断标准
1.4. 统计学方法
-
p53在TNBC和non-TNBC组织中均有表达(见图 1~4)。2组阳性率差异无统计学意义(P>0.05)(见表 2)。
分组 p53 χ2 P 阳性 阴性 TNBC组
non-TNBC组20
2210
80.32 >0.05 -
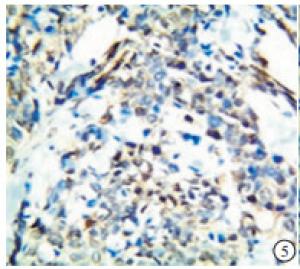
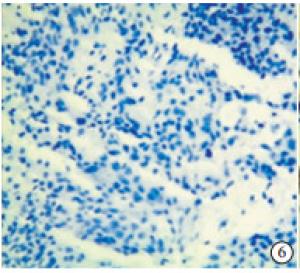
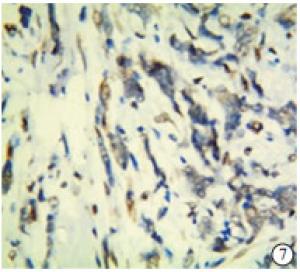
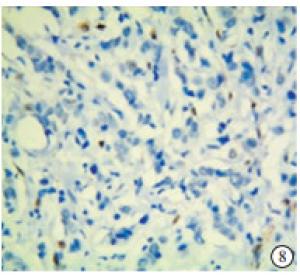
TAZ蛋白在TNBC和non-TNBC组织中均有表达(见图 5~8)。TNBC组织中TAZ阳性率高于non-TNBC(P<0.01)(见表 3)。
分组 TAZ χ2 P 阳性 阴性 TNBC组
non-TNBC组17
513
2510.34 < 0.01 -
p53的阳性表达与年龄和肿瘤大小有关,年龄≤45岁、肿瘤>2 cm的p53的阳性表达率较高(P<0.05),而与临床病理分期、组织学分级、淋巴及转移情况无关(P>0.05)。TAZ的阳性表达与肿瘤大小和组织学分级有关,肿瘤>2 cm、组织学分级Ⅰ~Ⅱ的阳性表达率较高(P<0.01和P<0.05),而与发病年龄、临床病理分期、淋巴及转移情况无关(P>0.05)(见表 4)。
临床病理参数 n p53 TAZ 阳性 阴性 阳性 阴性 年龄/岁 ≤45 15 13 2 9 6 >45 15 7 8 8 7 χ2 — 5.40 0.14 P — < 0.05 >0.05 肿瘤大小/cm ≤2 11 4 7 2 9 >2 19 16 3 15 4 χ2 — 5.19 8.17 P — < 0.05 < 0.01 TNM分期 Ⅰ~Ⅱ 23 15 8 15 8 Ⅲ 7 5 2 2 5 χ2 — 0.00 1.63 P — >0.05 >0.05 淋巴结转移 无 20 15 5 12 8 有 10 5 5 5 5 χ2 — 0.92 0.02 P — >0.05 >0.05 组织学分级 Ⅰ~Ⅱ 17 11 6 13 4 Ⅲ 13 9 4 4 9 χ2 — 0.00 6.27 P — >0.05 < 0.05 -
在TNBC中,p53和TAZ共同阳性表达的有14例,共同阴性表达的有7例。根据Spearman相关分析结果显示,p53和TAZ蛋白在TNBC中的表达呈正相关(rs=0.381, P<0.05)。
2.1. p53在TNBC组织和non-TNBC组织中的表达
2.2. TAZ在TNBC组织和non-TNBC组织中的表达
2.3. p53和TAZ在TNBC组织中的表达与临床病理因素之间的关系
2.4. p53和TAZ在TNBC组织中表达的相关性
-
乳腺癌是一种高度异质性的恶性肿瘤,根据癌组织基因表达谱的差异将乳腺癌分为5个亚型[1-2],分别是:管腔A型、管腔B型、正常乳腺样型、HER-2过表达型和Basal-like型,而后两个亚型的恶性程度更高、预后更差[3]。临床工作中,由于基因检测技术较复杂、成本较高很少开展,而常应用免疫组织化学染色方法,结合ER、PR及Her-2的状态进行乳腺癌的分型。TNBC是应用免疫组织化学方法鉴定出来的一个亚型。但研究[4]发现,85%的TNBC是Basal-like型乳腺癌。TNBC占所有乳腺癌的15%~20%[5]。与其他乳腺癌亚型相比,TNBC的发病年龄较轻、肿瘤直径大、组织学分级高、腋窝淋巴结常阴性、易复发和远处转移、生存时间短等[6-7]。本组资料显示,发病年龄最轻(28岁)的发生在TNBC组,且年龄≤45岁的病人多于non-TNBC组;肿瘤直径常>2 cm、淋巴结转移率不高(P<0.05),与以上报道基本一致。
Hippo信号通路是近年来首先在果蝇中发现的一条高度保守的抑制性信号通路,通过抑制细胞增殖和促进细胞凋亡来调节器官的发育[8]。越来越多的研究[9-13]表明,该信号通路的异常与多种肿瘤的发生有关。TAZ是Hippo信号通路的核心下游转录调控因子之一,在多种肿瘤中存在过表达现象[9-10, 14]。本文研究结果显示:TAZ在TNBC组织中的阳性表达率为56.7%,高于non-TNBC组织(16.7%);TAZ在肿瘤直径>2 cm的TNBC组织中表达较高;TNBC组的组织学分级以Ⅱ、Ⅲ级为主(29/30),TAZ在分化较差的组织中阳性表达率高。肿瘤大小、组织学分级是公认的乳腺癌预后因素,TAZ的表达与其相关,提示TAZ可能与TNBC的恶性程度高、预后差的特征有一定的相关性。
p53基因是位于人17号染色体短臂上的肿瘤相关基因,分为野生型和突变型。野生型p53属于抑癌基因,可抑制肿瘤的发生;而突变型p53丧失了抑制肿瘤发生发展的功能,具有促进肿瘤形成的作用。p53基因与50%以上的人类肿瘤有关[15],而在TNBC中p53的突变率高达80%[16],且p53的表达与乳腺癌的预后相关。本研究显示,p53在TNBC和non-TNBC组织中的表达无明显差异;但p53的阳性表达与TNBC肿瘤大小相关,与TNBC病人的年龄、淋巴结转移、TNM分期及组织学分级无相关性。可能是由于样本量太少,研究结论尚需进一步大样本研究验证。
综上所述,TAZ高表达于TNBC组织中,且与TNBC病人的肿瘤大小、组织学分级相关;虽然p53在TNBC和nonTNBC组织中的表达无明显差异,但是p53与TNBC病人肿瘤大小相关,且在TNBC中p53与TAZ的表达呈正相关。因此,TAZ与TNBC的发生发展有关,可能成为TNBC新的治疗靶点,p53与TNBC的关系尚需要大样本进行统计验证。





 DownLoad:
DownLoad: