-
目前,CRISPR/Cas9技术是最强大的基因组编辑工具,由CRISPR RNA(crRNA)和Cas9核酸酶组成,DNA由Cas9引导并切割,导致靶位点双链断裂。在细胞DNA修复过程中,靶位点处发生目的基因片段插入、替换或删除[1]。CRISPR/Cas9有效地应用于基因敲除、内源性基因表达调控、活细胞标记染色体位点、编辑单链RNA和高通量基因筛选。CRISPR/Cas9技术的应用扩大了研究基因功能研究的样本种类,可以应用于发育机制、基因表达调控和动物行为等方面。同时,CRISPR/Cas9技术的应用有助于研究人员阐明靶基因功能,使研究特定基因功能成为可能[2-3]。因此,本研究应用CRISPR/Cas9技术高效构建Trib3基因敲除大鼠模型。
Trib3基因位于人类染色体20p13-p12.2,包括4个外显子和3个内含子,TRIB3含有358个氨基酸残基[4]。Trib3基因是哺乳动物Tribbles家族的成员,Tribbles家族由Trib1、Trib2和Trib3三种基因组成[5]。目前有研究[6-8]表明Trib3在肝脏中被诱导表达,TRIB3通过直接与Akt结合,从而促进了Ⅱ型糖尿病易感性个体的胰岛素抵抗。另一项研究[9]表明TRIB3与细胞周期调节因子CtIP(Ctbp-interactions protein)相互作用,不仅破坏正常的细胞周期导致细胞癌变,还在癌细胞中过表达。TRIB3在结肠细胞中与β-catenin和TCF4相互作用,增加肿瘤干细胞相关基因的表达,敲除Trib3基因后可有效减少小鼠结肠肿瘤细胞数量[10]。TRIB3在肺癌组织中的表达显著增加,并与肺癌病人的生存时间呈反比。同时,TRIB3亦在其他类型的肿瘤中诱导表达[11]。有研究[12]显示TRIB3的表达与HIF-1α的表达相关,HIF-1α作为一种重要的转录因子,参与调控血管生成、携氧蛋白和葡萄糖代谢酶等多种相关基因的表达,是肾细胞癌发生发展的关键因素。TRIB3通过抑制AKT信号通路从而抑制细胞的增殖、迁移和侵袭,诱导子宫内膜癌细胞凋亡[13]。Trib3基因除了与癌症有关,该基因也可以促进成骨发育[14]。但是,Trib3基因在精子发生中的作用鲜有报道,刘陶迪[15]通过高通量基因芯片技术检测,结果发现Trib3基因在精子发生过程中的表达差异性有20.3倍之多。因此,建立Trib3基因敲除大鼠模型来研究该基因在精子发生中功能具有重要意义。本研究中对基因敲除大鼠的基因型鉴定是Trib3基因功能研究的前期工作和重要环节,可为后续研究提供实验依据。
HTML
-
基因敲除大鼠由北京维通达生物技术有限公司提供,品系为Wistar大鼠[许可证号: SCXK(京)2019-0002]。通过CRISPR/Cas9技术敲除大鼠Trib3基因。Trib3基因敲除大鼠饲养在内蒙古医科大学实验动物中心SPF级鼠房饲养和繁殖。
-
血液组织DNA提取试剂盒(TIANamp Genomic DNA Kit, 天根生化有限公司);PGK1.1 linear vector(南京大学南京生物医药研究院提供);2×San Taq PCRMix(Dye)(上海生工生物工程股份有限公司);invitrogen琼脂糖(美国Thermo Fisher Scientific);6×Loading buffer(武汉Biosharp生物技术有限公司);GoldView Ⅰ型核酸染色剂(北京Solarbio科技有限公司);D2000 DNA Marker[天根生化(北京)有限公司];超微量紫外分光光度仪(Thermo ND 2000L);PCR扩增仪(威泰克公司);水平电泳仪(北京柏奥易杰科技有限公司);凝胶成像系统(美国美国UVP公司)。
-
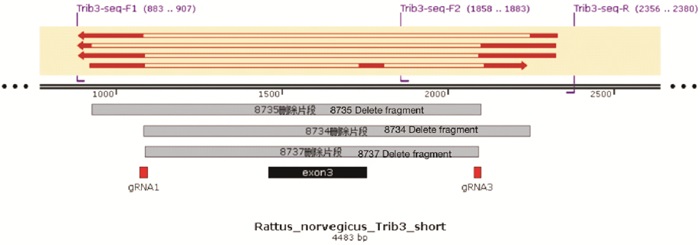
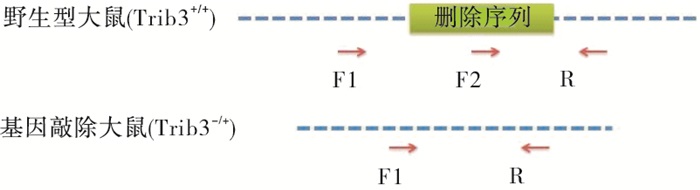
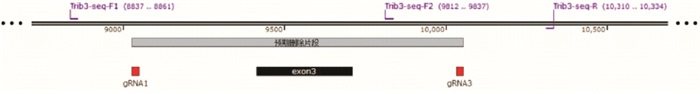
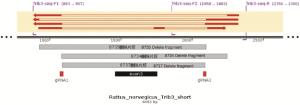
Trib3基因位于大鼠第3号染色体,Trib3基因编码蛋白的主要有1种剪接体:Trib3-201,编码349个氨基酸残基的蛋白,Trib3基因的3号外显子长度293 bp,非3的整数倍,删除后将造成后续编码区移码突变,导致Trib3基因功能丧失。因此本实验将Trib3基因的3号外显子删除。用大鼠Trib3基因特异sgRNA(single-guide RNA)介导Cas9核酸酶切割DNA出现特定的DSBs(Double-Stranded Breaks),在剪接体Trib3-201的3号外显子的上游及下游切口,通过NHEJ(Non-homologous end Joining)修复途径,将2个切口直接连接,同时删除两个切口之间的序列(即3号外显子)。用CRISPR Design设计筛选得到2个gRNA,分别是Trib3-gRNA1为5′-TGA GTC TAG TCA GCG GAG CAG GG-3′;Trib3-gRNA3为5′-ACT AAA GGA ATA GCT GCG GGT GG-3′。将纯化好的sgRNA、Cas9-mRNA共同注射到Wistar大鼠胚胎中,注射后将胚胎移植到代孕受体大鼠的输卵管内,胚胎移植后3~4周大鼠出生,出生2周左右完成基因型鉴定。
-
对出生后8~10 d的大鼠进行剪脚趾标记编号。剪取8~10日龄大鼠脚趾,装入0.2 mL PCR管。加入200 μL缓冲液GA,用眼科剪剪碎,注射器抽打10次。加入20 μL Proteinase K溶液,混匀。56 ℃水浴过夜,直至组织溶解后。动物组织DNA提取参考总DNA试剂盒(TIANGEN, DP304)说明书进行操作,以ddH2O作为阴性对照品,使用超微量紫外分光光度仪(Thermo ND 2000L)测定DNA浓度(Conc)及DNA纯度,A260/A280比值在1.8左右为DNA纯度合格,浓度结果在100~300 ng/μL。
-
引物由北京维通达生物技术有限公司设计、合成,引物序列见表 1。PCR反应条件为94 ℃ 4 min,94 ℃ 20 s,62 ℃ 25 s,72 ℃ 40 s,38个循环,72 ℃ 2 min结束。
引物 序列(5′~3′) Trib3-seq-F1 GCT CCC TTC TAA AAT AAC AAC CCA C Trib3-seq-F2 GTA TAC CTG TGC TTA GCA TGT GGA AG Trib3-seq-R TTT GTC AGA TAC CTT GGA CTT GGA G -
电泳条件:PCR扩增产物15 μL,6×Loading buffer 1.0 μL,1.3%琼脂糖凝胶,100 V恒压50 min,使用凝胶成像系统(美国美国UVP公司)拍照。
1.1. 实验动物
1.2. 主要试剂及仪器
1.3. 实验方法
1.3.1. CRISPR/Cas9敲除Trib3基因
1.3.2. 提取DNA
1.3.3. PCR扩增反应
1.3.4. 琼脂糖凝胶电泳
-
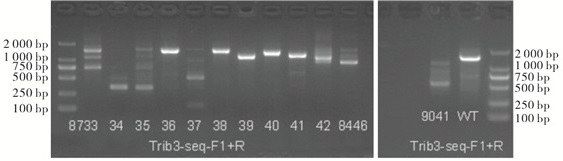
应用CRISPR/Cas9敲除大鼠Trib3基因,Trib3基因的3号外显子长度293 bp,非3的整数倍,删除后将造成后续编码区移码突变,从而导致Trib3基因功能丧失(见图 1)。获得F0代大鼠(见表 2),对F0代founder大鼠敲除及鉴定见图 1~3。大鼠编号分别为8734♀、8735♀、8737♂、9041♂,4只F0代founder大鼠为基因敲除大鼠,其中9041♂founder大鼠死亡,最终获得1雄2雌共3只F0代founder大鼠,分别为8734♀、8735♀、8737♂。
编号 性别 出生日期 Trib3敲除情况 是否淘汰 8733 ♀ 2019/4/12 未敲除 是 8734 ♀ 2019/4/12 已敲除 否 8735 ♀ 2019/4/12 已敲除 否 8736 ♂ 2019/4/12 未敲除 是 8737 ♂ 2019/4/12 已敲除 否 8738 ♀ 2019/4/12 未敲除 是 8739 ♂ 2019/4/12 未敲除 是 8740 ♀ 2019/4/12 未敲除 是 8741 ♂ 2019/4/12 未敲除 是 8742 ♀ 2019/4/12 未敲除 是 8446 ♀ 2019/4/16 未敲除 是 9041 ♂ 2019/4/26 已敲除 否 -
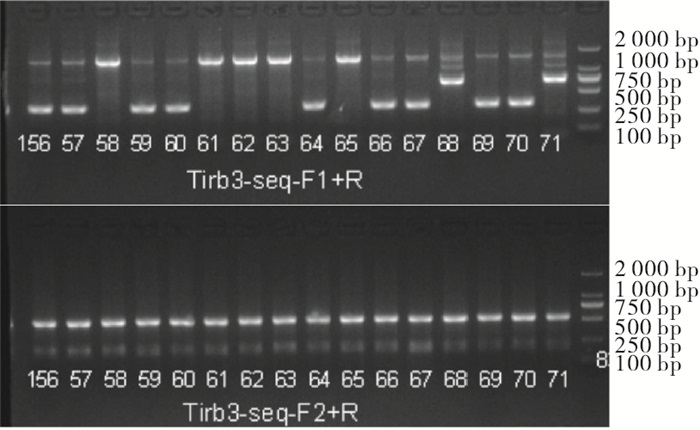
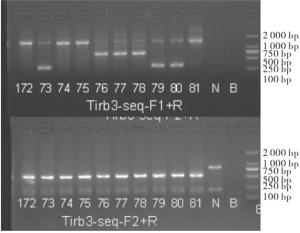
大鼠的性成熟期约为8周,母鼠妊娠期约为21 d,采用8734♀×8737♂、8735♀×wistar♂进行繁殖,获得F1代大鼠(见表 3),对出生的F1代大鼠进行鉴定(见图 4~6)。F1代大鼠10156~10166是8734♀×8737♂所生;F1代大鼠10167~10181是8734♀×8737♂所生,对F1代样品进行测序,将删除序列相同的大鼠归为一组(line),分为3个line,lineA:10156、10157、10159、10160、10164、10166来源于8734♀×8737♂,经测序,删除序列与founder鼠8734完全相同;lineB:10167、10169、10170、10179、10180来源于8735♀×wistar♂,经测序,删除序列与founder鼠8735完全相同;lineC:10168、10171、10177、10178来源于8735♀×wistar♂,经测序,删除序列与founder鼠不同。
编号 性别 出生日期 基因型 亲代 是否淘汰 10156 ♀ 2019/6/17 杂合 8734♀×8737♂ 否 10157 ♀ 2019/6/17 杂合 8734♀×8737♂ 否 10158 ♀ 2019/6/17 野生 8734♀×8737♂ 是 10159 ♀ 2019/6/17 杂合 8734♀×8737♂ 否 10160 ♀ 2019/6/17 杂合 8734♀×8737♂ 否 10161 ♂ 2019/6/17 野生 8734♀×8737♂ 是 10162 ♂ 2019/6/17 野生 8734♀×8737♂ 是 10163 ♂ 2019/6/17 野生 8734♀×8737♂ 是 10164 ♂ 2019/6/17 杂合 8734♀×8737♂ 否 10165 ♂ 2019/6/17 野生 8734♀×8737♂ 是 10166 ♂ 2019/6/17 杂合 8734♀×8737♂ 否 10167 ♀ 2019/6/19 杂合 8735♀×wistar♂ 否 10168 ♀ 2019/6/19 杂合 8735♀×wistar♂ 否 10169 ♀ 2019/6/19 杂合 8735♀×wistar♂ 否 10170 ♀ 2019/6/19 杂合 8735♀×wistar♂ 否 10171 ♀ 2019/6/19 杂合 8735♀×wistar♂ 否 10172 ♂ 2019/6/19 野生 8735♀×wistar♂ 是 10173 ♂ 2019/6/19 杂合 8735♀×wistar♂ 否 10174 ♂ 2019/6/19 野生 8735♀×wistar♂ 是 10175 ♂ 2019/6/19 野生 8735♀×wistar♂ 是 10176 ♂ 2019/6/19 杂合 8735♀×wistar♂ 否 10177 ♂ 2019/6/19 杂合 8735♀×wistar♂ 否 10178 ♂ 2019/6/19 杂合 8735♀×wistar♂ 否 10179 ♂ 2019/6/19 杂合 8735♀×wistar♂ 否 10180 ♂ 2019/6/19 杂合 8735♀×wistar♂ 否 10181 ♂ 2019/6/19 野生 8735♀×wistar♂ 是 1370 ♀ 2019/8/3 纯合 8734♀×8737♂ 否 1371 ♀ 2019/8/3 纯合 8734♀×8737♂ 否 1372 ♀ 2019/8/3 纯合 8734♀×8737♂ 否 1373 ♀ 2019/8/3 纯合 8734♀×8737♂ 否 1374 ♀ 2019/8/3 纯合 8734♀×8737♂ 否 1375 ♂ 2019/8/3 纯合 8734♀×8737♂ 否 1376 ♂ 2019/8/3 纯合 8734♀×8737♂ 否 1377 ♂ 2019/8/3 纯合 8734♀×8737♂ 否 1378 ♂ 2019/8/3 纯合 8734♀×8737♂ 否 1379 ♂ 2019/8/3 纯合 8734♀×8737♂ 否 1380 ♂ 2019/8/3 纯合 8734♀×8737♂ 否 -
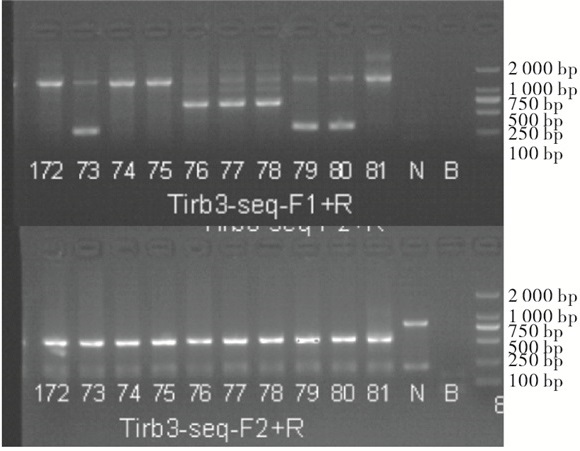
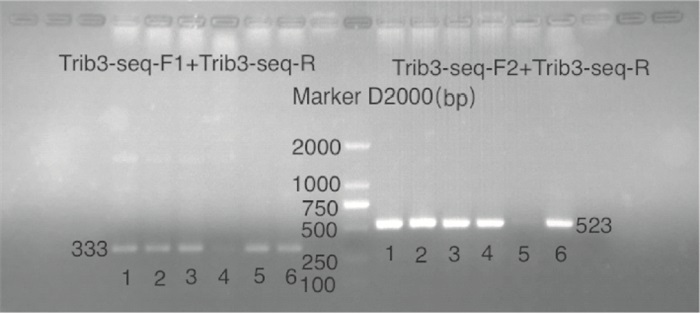
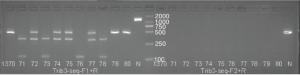
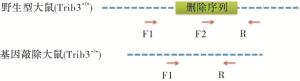
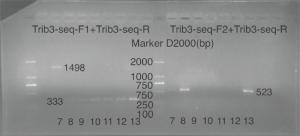
经CRISPR/Cas9敲除Trib3基因相应位点后导致其突变,基因型判断标准(见表 4):KO引物Trib3-seq-F1的PCR产物长度为333 bp,WT引物Trib3-seq-F2的PCR产物将消失的为纯合子大鼠(Trib3-/-);KO引物Trib3-seq-F1扩增产物长度为1 498 bp,WT引物Trib3-seq-F2的PCR产物长度为523为野生型大鼠(Trib3+/+);KO引物Trib3-seq-F1扩增产物长度为333 bp,并且WT引物Trib3-seq-F2的PCR产物长度为523为杂合型大鼠(Trib3-/+)。F2代大鼠1~6是10166♂× 10159♀所生;F2代大鼠7~13是10179♂×10167♀所生(见表 5)。鉴定结果结果:F2代中5号、9号、10号、11号、12号大鼠为纯合型大鼠(见图 7~9)。
Trib3-seq-F1+Trib3-seq-R Trib3-seq-F2+Trib3-seq-R Trib3+/+ 1 498 bp 523 bp Trib3-/+ 333 bp 523 bp Trib3-/- 333 bp no product 编号 性别 出生日期 基因型 是否淘汰 1 ♀ 2019/9/25 杂合 否 2 ♀ 2019/9/25 杂合 否 3 ♀ 2019/9/25 杂合 否 4 ♂ 2019/9/25 野生 是 5 ♀ 2019/9/25 纯合 否 6 ♀ 2019/9/25 杂合 否 7 ♂ 2019/10/13 野生 是 8 ♀ 2019/10/13 杂合 否 9 ♀ 2019/10/13 纯合 否 10 ♂ 2019/10/13 纯合 否 11 ♀ 2019/10/13 纯合 否 12 ♂ 2019/10/13 纯合 否 13 ♂ 2019/10/13 杂合 否
2.1. F0代founder大鼠基因型鉴定
2.2. F1代大鼠基因型鉴定
2.3. F2代大鼠基因型鉴定
-
Trib3基因可能与很多疾病相关,例如该基因过表达可促进神经元死亡,沉默TRIB3可抑制神经元PC12细胞的死亡[16]。TRIB3沉默促进缺氧缺血后的海马神经元增殖、抑制细胞凋亡[17],TRIB3介导的抑制AKT促进大鼠海马神经元凋亡,从而诱发癫痫发作[18]。此外,沉默TRIB3可能为减轻动脉粥样硬化疾病提供一种新的治疗方向[19]。TRIB3在卵巢癌组织中过表达和卵巢癌预后不良有关,TRIB3可能通过激活MEK/ERK信号通路促进卵巢癌的恶性行为[20]。Trib3表达上调可能会促进BMP2诱导骨形成,因此Trib3在成骨形成过程中起重要作用。
传统的动物模型受到物种、环境、时间等诸多因素的影响,基因敲除动物模型的建立为研究人类基因提供崭新的方法。目前,CRISPR/Cas9技术已经相对成熟, 能够精确修饰基因组。人们可以对一些结构极其复杂的细胞基因组进行定点、定量的改变,从而达到研究目的,简言之,就是定向地改变实验对象的遗传结构和特征。被改造过的基因是可以随染色体DNA复制而稳定遗传,而且所表达出来的性状是可以稳定遗传的。基因敲除模型的建立在基因功能的研究与临床医疗的应用中具有重要意义。目前,Trib3基因与生殖相关方面的内容以及Trib3基因敲除大鼠模型的建立鲜有报道,因此,Trib3基因敲除大鼠模型有利于探究Trib3在生殖过程中的作用,对其他致病机制的研究及治疗药物的筛选具有重要意义。
本研究利用CRISPR/Cas9技术定向敲除wistar大鼠Trib3基因第3外显子,大鼠Trib3基因特异sgRNA(single-guide RNA)介导Cas9核酸酶切割DNA出现特定的DSBs(Double-Stranded Breaks),在剪接体Trib3-201的3号外显子的上游及下游切口,通过NHEJ(Non-homologous end Joining)修复途径将2个切口直接连接,同时删除两个切口之间的序列(即3号外显子)。Trib3基因的3号外显子长度293 bp,非3的整数倍,删除后将造成后续编码区移码突变,导致Trib3基因功能丧失。本研究首次建立纯合型Trib3-/-大鼠模型。观察发现Trib3基因敲除大鼠不具有胚胎致死性,敲除Trib3基因大鼠仍具有生育能力。该研究成功建立稳定遗传的Trib3基因敲除大鼠模型并为探究Trib3基因功能提供理想的动物模型。接下来的工作我们将检测精子发生中的标记性基因表达水平,探究Trib3基因对雄性大鼠生殖表型的影响,同时监测激素水平的变化,建立体外大鼠睾丸组织细胞共培养体系,寻找该基因与精子发生相关的上下游信号通路,构建完善的基因研究框架,进一步阐明该基因在精子发生中的作用,为探究该基因与男性不育的相关关系奠定基础。因此获得稳定遗传的Trib3基因敲除大鼠是后续实验的前提条件,基因敲除大鼠的基因型鉴定是后续工作的首要环节和关键步骤,同时,是保证实验数据可靠性的必要条件。









 DownLoad:
DownLoad: