-
免疫球蛋白A肾病(IgAN)是世界上最常见的肾小球肾炎形式之一,也是终末期肾病的主要原因[1]。25%~30%的IgAN病人需要在20~25年内进行肾脏替代治疗,另外20%~40%的病人在发病后20年内会发生终末期肾病[2-3]。其以血尿和蛋白尿为主要临床表现,病理特征包括肾小球系膜细胞增生并伴有以IgA为主的免疫复合物的沉积[4]。肾移植和透析的成本已成为病人和社会的巨大财务负担[5]。因此,开发用于治疗IgAN的有效药物是十分重要的。雷公藤甲素(triptolide, TR)是中药雷公藤的主要活性成分之一,具有抗炎、抗凋亡及免疫调节等作用[6],对大鼠肾缺血再灌注损伤、糖尿病肾损伤及慢性肾衰均具有保护作用[7-9]。并且其对于IgAN及系统性红斑狼疮等自身免疫性疾病的治疗效果也较为突出,但是其具体治疗机制目前尚不明确。NLRP3是近几年发现的重要的炎症复合体之一,其能触发Caspase-1、白细胞介素(IL)-1β和IL-18的成熟以执行炎症反应[10-11]。并且有研究[12-13]已经证实,IL-1β和IL-18是NLRP3炎症小体激活的两个关键标志物,在IgAN病人血清和尿液中表达升高,提示NLRP3炎症小体可能通过调节炎症在IgAN中发挥重要作用。本研究通过建立IgAN大鼠模型,观察雷公藤甲素对IgAN大鼠的治疗作用,并且从NLRP3炎症小体方面探讨其可能的作用机制。
-
SPF级雄性SD大鼠40只,体质量(200±10)g,购于辽宁长生生物有限公司[SCXK(辽):2012-0001],动物分笼饲养,室温维持在20~25 ℃,每日光照12 h。大鼠被随机分为4组:对照组、模型组、雷公藤甲素低剂量组(100 μg/kg)及雷公藤甲素高剂量组(200 μg/kg),每组10只大鼠。
-
雷公藤甲素标准品购自成都普菲德生物技术有限公司,肿瘤坏死因子α(TNF-α)、IL-17A、γ干扰素(IFN-γ)和IL-4 ELISA试剂盒购自上海朗顿生物技术公司,鼠抗β-actin、兔抗IL-1β、Caspase-1、IL-18、NLRP3、IgA及β-actin抗体购自Abcam公司,辣根过氧化物酶(HRP)标记兔抗鼠、HRP标记羊抗兔二抗购自北京博奥森有限公司,Cy3标记羊抗兔二抗购自Jackson公司,全蛋白提取试剂盒购自南京凯基生物有限公司,BCA蛋白定量试剂盒购自碧云天生物有限公司,其他试剂均为国产分析纯试剂。
-
石蜡切片机(德国徕卡公司),AV5800型全自动生化分析仪(Beckman Coulter公司),紫外可见分光光度计(上海元析公司),Nikon荧光倒置显微镜(日本尼康公司),酶标仪(深圳迈瑞公司),水平核酸电泳仪、半干式蛋白转膜仪(Bio-Rad)。
-
按文献[14-15]报道的方法建立IgAN大鼠模型,通过连续8周口服0.1%牛γ-球蛋白(BGG)溶液及连续3 d尾静脉注射1 mg BGG的方法制备IgAN模型。对照组大鼠给予等体积0.9%氯化钠溶液。随后将模型制备成功的大鼠随机分为模型组、雷公藤甲素低剂量(100 μg/kg)及高剂量(200 μg/kg)组,每组10只。各组大鼠连续灌胃给药8周,每天1次,对照组及模型组给予等体积的0.9%氯化钠溶液[16-17]。
-
将大鼠置于代谢笼内收集24 h尿液,5 000 r/min离心10 min,取上清液检测24 h UTP。末次给药1 h后各组大鼠腹腔注射10%水合氯醛进行麻醉,经腹主动脉采血,10 000 r/min离心10 min分离血清,利用自动生化分析仪检测鼠血清中肌酐(Scr)、尿素氮(BUN)、总蛋白(TP)、丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)含量和尿液中24 h尿蛋白(24h UTP)水平。
-
ELISA法检测血清中TNF-α、IL-17A、IFN-γ及IL-4水平,按照试剂盒说明书进行操作。加入样品、生物素标记的抗体、链霉亲和素-HRP,37 ℃孵育30 min。加入显色液,37 ℃避光显色30 min,终止显色;以酶标仪在450 nm波长下检测吸光度值,根据不同浓度标准品的OD值绘制标准曲线,得到回归方程,根据回归方程计算样品中TNF-α、IL-17A、IFN-γ及IL-4水平。
-
石蜡切片经过二甲苯脱蜡、梯度乙醇脱水,经过高温抗原修复后,1% Triton X-100透化30 min,PBS洗涤;滴加适量5% BSA溶液封闭60 min;滴加兔抗IgA抗体稀释液(1:500),4℃孵育过夜,PBS洗涤;滴加Cy3标记的羊抗兔二抗稀释液(1:500)室温避光孵育1 h,PBS洗涤,倒置荧光显微镜下观察并拍照。
-
提取各组大鼠肾组织总蛋白,12 000 r/min离心10 min,使用考马斯亮蓝蛋白定量试剂盒对蛋白进行定量分析,100 ℃加热10 min对蛋白进行变性,随后进行SDS-聚丙烯酸胺凝胶电泳,使用PVDF膜转膜,5%脱脂奶粉封闭液封闭,TBST洗膜,分别加入β-actin、兔抗IL-1β、Caspase-1、IL-18、NLRP3及β-actin一抗(1:1 000),4 ℃孵育过夜,TBST洗膜,加入相应HRP标记二抗稀释浓度为1:1 000,室温避光孵育1 h。TBST洗膜,ECL发光试剂盒发光,凝胶成像系统成像,Image J软件计算灰度值,统计分析目的条带与内参蛋白条带光密度的比值。
-
采用单因素方差分析和q检验。
-
与对照组相比,模型组血清中Scr、BUN及尿液中24 h TUP含量明显升高(P < 0.05~P < 0.01);经不同剂量雷公藤甲素治疗后,血清中Scr、BUN及尿液中24 h TUP含量均明显降低(P < 0.05~P < 0.01);但各组大鼠血清中TP、ALT及AST水平无明显变化(P>0.05)(见表 1)。
指标 对照组 模型组 低剂量组 高剂量组 F P MS组内 BUN/(mmol/L) 3.91±0.53 19.87±2.99** 12.37±2.65△ 11.52±2.01△△ 20.21 < 0.01 0.003 Scr/(μmol/L) 41.02±3.58 66.83±11.02* 45.76±5.68△ 41.59±10.03△ 6.48 < 0.05 3.622 TP/(g/L) 59.03±8.22 60.52±10.57 59.63±7.86 63.19±10.28 0.12 >0.05 0.004 ALT/(U/L) 39.98±6.35 43.17±4.97 45.91±6.04 42.81±3.72 0.61 >0.05 0.005 AST/(U/L) 88.04±10.85 91.48±10.35 87.59±9.28 85.64±7.96 0.19 >0.05 0.008 24 h UTP/(mg/24 h) 1.98±0.14 46.92±9.95** 29.91±5.69△△ 24.68±3.73△△ 28.40 < 0.01 8.368 与对照组比较* P < 0.05,**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01 表 1 生化指标及24 h UTP含量变化的比较(x±s;ni=10)
-
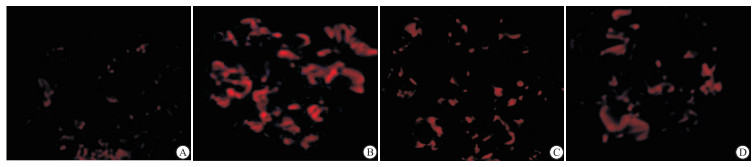
与对照组相比,模型组IgAN大鼠血清中炎症因子TNF-α、IL-17A、IFN-γ和IL-4水平明显升高(P < 0.05~P < 0.01);雷公藤甲素低、高剂量组均能不同程度的降低大鼠血清中TNF-α、IL-17A、IFN-γ和IL-4水平(P < 0.05~P < 0.01)(见表 2)。对照组少见IgA免疫球蛋白的沉积,而模型组肾小球IgA免疫球蛋白沉积明显(P < 0.01),雷公藤甲素治疗组IgA免疫球蛋白的沉积情况明显减轻(P < 0.01)(见图 1)。
指标 对照组 模型组 低剂量组 高剂量组 F P MS组内 TNF-α/(ng/mL) 101.76±20.01 291.33±49.60** 199.62±25.54△ 168.68±21.05△△ 19.05 < 0.01 2.523 IL-17A/(ng/mL) 7.58±1.45 28.04±4.50* 16.12±4.58△ 13.16±3.25△ 14.58 < 0.05 0.062 IFN-γ/(ng/mL) 8.43±3.00 19.26±12.98** 12.51±3.20△ 11.77±4.65△ 4.75 < 0.05 4.732 IL-4/(ng/mL) 3.63±0.61 11.20±1.31** 6.33±0.64△△ 5.83±1.12△△ 32.74 < 0.01 5.019 IgA相对荧光强度 100±21.54 280.73±42.39** 171.69±41.02△△ 165.07±32.52△△ 13.64 < 0.01 0.000 与对照组比较* P < 0.05,**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01 表 2 肾组织中炎症因子水平的比较(x±s;ni=10)
-
与对照组相比,模型组肾组织中IL-1β、Caspase-1、IL-8及NLRP3蛋白的表达明显升高(P < 0.05~P < 0.01);雷公藤甲素治疗后,肾组织中IL-1β、Caspase-1、IL-18及NLRP3蛋白的表达明显降低(P < 0.05~P < 0.01)(见图 2、表 3)。
蛋白指标 对照组 模型组 低剂量组 高剂量组 F P MS组内 IL-1β 1.00±0.36 1.97±0.50* 1.32±0.21△ 1.36±0.15△△ 4.47 < 0.05 0.003 Caspase-1 1.00±0.19 2.91±0.33** 1.99±0.38△△ 1.83±1.23△△ 22.35 < 0.01 0.008 IL-18 1.00±0.17 2.32±0.12** 1.71±0.13△△ 1.76±1.13△△ 41.95 < 0.01 0.187 NLRP3 1.00±0.21 2.53±0.55** 1.90±0.29△△ 1.76±0.28△△ 9.24 < 0.01 1.732 与对照组比较*P < 0.05,**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01 表 3 肾组织中IL-1β、Caspase-1、IL-18及NLRP3蛋白的相对表达(x±s;ni=10)
-
IgAN是全球公认的引起肾小球肾炎的最常见的免疫复合物,IgAN的唯一诊断特征是在肾活检中发现肾小球系膜内主要含有聚合IgA的免疫沉积物[18]。IgAN的发病机制目前还不十分明确,大量的临床数据及基础研究均表明,IgAN主要以IgA为主的免疫复合物在肾小球系膜细胞及基质沉积后,通过激活多种细胞因子及信号通路,引发免疫反应过程,导致肾小球硬化、肾小管间质纤维化等,最终造成肾功能衰竭[19]。因此,如何抑制IgA的沉积是缓解IgAN进展、改善预后的关键靶点。
近几年,中医中药在IgAN中的作用逐渐被重视,王骞等[20]利用滋阴凉血汤治疗IgAN大鼠模型,滋阴凉血汤能减少IgA肾病大鼠尿液中红细胞数量、尿蛋白,改善肾小球内系膜基质、细胞增生和肾小管萎缩及炎症反应等病理改变。活血通络清热利湿方能够抑制IgA肾病大鼠肾组织IL-13、IL-4 mRNA的表达及血清循环免疫复合物的分泌,延缓疾病发展,保护肾功能[21]。潘立军等[22]发现补肾调肝化瘀法联合西医基础治疗气阴两虚型IgAN,与单独西医基础治疗相比可更有效减轻中医症候,改善病人临床症状。YANG等[23]发现中药蝉蜕能够通过抑制炎症和细胞凋亡来改善IgAN大鼠的肾脏炎症和纤维化。
中药雷公藤为卫矛科雷公藤属木质藤本植物,主要功效为祛风除湿、活血通络、清热解毒等。雷公藤甲素为其主要药理成分,具有广泛的药理作用,已经证实其具有抗炎、免疫调节、抗肿瘤等作用。研究[24]表明雷公藤甲素能够抑制α平滑肌肌动蛋白、TGF-β1的表达来抑制肾纤维化的进展。雷公藤甲素能有效降低IgAN病人外周血单个核细胞中TNF-α、IL-6、一氧化氮的含量并促进其凋亡,发挥改善作用[25]。但是对于雷公藤甲素改善IgAN的具体作用机制,还未见报道。本研究利用BGG溶液及给予BGG的方法制备IgAN模型,观察雷公藤甲素对IgAN大鼠的保护作用并对其作用机制进行了探讨。
Scr是人体肌肉终产物,BUN是体内的一种含氮化合物,在正常生理状态下,Scr和BUN由肾小球滤过而排出体外,体内Scr和BUN含量处于低水平状态,而在IgAN病人或其他肾功能不全疾病状态下,肾小球滤功能障碍,因此血清中Scr和BUN含量将明显升高[26]。当肾小球功能及泌尿功能受损后,将造成大量蛋白质漏出,导致尿中出现大量蛋白质,因此检测24 h UTP也可反映出肾小球功能是否正常[27]。本研究发现雷公藤甲素治疗后,大鼠血清中Scr、BUN及尿液中24 h UTP水平明显降低,而对TP、ALT及AST水平无影响,说明雷公藤甲素能够改善IgAN大鼠肾小球滤过功能。
近年来,普遍认为IgAN的发生发展与辅助性T淋巴细胞1与辅助性T淋巴细胞2的比例(Th1/Th2)失衡有关。Th1细胞主要分泌IFN-γ、TNF-α等细胞因子,促进B细胞分泌产生可强烈激活补体的IgG亚型,Th2细胞主要分泌IL-4、IL-17等细胞因子,可激活嗜酸性粒细胞,促进B细胞分泌不激活补体的IgG亚型[28]。NAGAKI等[29]发现在自发性产生IgA的小鼠中,幼鼠主要以Th1为主,而随着IgA产生沉积增加,Th2则呈现出优势地位,因此认为IgA的产生可能与Th1/Th2平衡向Th2偏靠有关。有研究[30]证实IFN- γ、TNF-α及IL-4等细胞因子在IgA肾病模型中表达增多,且中晚期IgAN病人的炎症因子表达水平较早期病人高,提示Th1/Th2分泌的细胞因子参与了IgAN特异的炎症反应和免疫损伤过程,并且炎症因子的水平可以直观反映IgAN的病情。本研究利用ELISA检测各组大鼠血清中TNF-α、IL-17A、IFN-γ和IL-4的表达,结果显示,雷公藤甲素能够显著降低大鼠血清中TNF-α、IL-17A、IFN-γ和IL-4水平;同时免疫荧光染色结果发现,雷公藤甲素能够降低大鼠肾组织中IgA的荧光强度,减少IgA的沉积,以上结果说明雷公藤甲素能够通过调节Th1/Th2平衡来抑制肾组织中IgA的沉积,改善肾功能。
NLRP3炎症小体是炎症反应的核心复合物之一,IgA作为NLRP3炎症小体激动剂,可通过线粒体损伤释放活性氧进而激活NLRP3引起炎症级联反应[31],在动脉粥样硬化、阿尔茨海默病及糖尿病肾病等自身免疫性疾病中发挥重要作用。NLRP3炎症小体主要通过溶酶体破裂方式、半通道方式及活性氧方式激活。活化后的NLRP3炎症小体可招募ASC、Caspase-1形成NLRP3炎症复合体,进而活化Caspase-1,活化后的Caspase-1可以使无活性的IL-1β、IL-18前体加工成为有活性的细胞因子,并分泌到细胞外,参与一系列的炎症反应[31]。有研究[32-34]表明,淫羊藿苷可通过抑制NF-κB介导的NLRP3炎症小体激活来改善IgAN大鼠的肾损伤;白藜芦醇还可以通过保持线粒体完整性和增强自噬来抑制NLRP3炎性体激活,从而改善IgAN大鼠的肾功能。为了探讨雷公藤甲素改善IgAN大鼠的肾功能的机制,我们利用Western blotting检测了肾组织中IL-1β、Caspase-1、IL-18及NLRP3蛋白的表达,结果发现,雷公藤甲素能够显著降低IL-1β、Caspase-1、IL-18及NLRP3蛋白的表达,说明雷公藤甲素改善IgAN大鼠的肾功能可能与抑制NLRP3炎症小体的活化有关。
综上所述,雷公藤甲素改善IgAN大鼠的肾功能、抑制IgA沉积,可能与抑制NLRP3炎症小体的活化有关,为雷公藤甲素用于IgAN临床治疗提供了理论和实验依据。本研究虽初步探讨了雷公藤甲素治疗IgAN大鼠的可能机制,但并未深入利用基因敲除或者抑制剂等手段加以证明,本课题组将在后续的实验中对雷公藤甲素的治疗机制进行深入探讨。
雷公藤甲素对IgA肾病大鼠的肾保护作用及对NLRP3炎症小体的影响
Effect of Triptolide on renal protection and NLRP3 inflammatome in IgA nephropathy rats
-
摘要:
目的探讨雷公藤甲素对IgA肾病(IgAN)大鼠的肾保护作用及其与NLRP3炎症小体的关系。 方法40只SPF级SD雄性大鼠随机分为对照组、模型组和雷公藤甲素低、高剂量组。采用口服牛γ-球蛋白(BGG)8周及尾静脉注射BGG方法建立IgAN大鼠模型。于造模完成后灌胃给予低、高剂量雷公藤甲素治疗8周。观察大鼠血清中肌酐(Scr)、尿素氮(BUN)、总蛋白(TP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)及24 h尿蛋白(24 h TUP)水平;血清中肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-17A、γ干扰素(IFN-γ)及IL-4水平;肾组织中IgA沉积情况;肾脏中IL-1β、Caspase-1、IL-18及NLRP3的表达情况。 结果与模型组相比,雷公藤甲素组血清Scr、BUN及尿液中24 h TUP含量明显降低(P < 0.05~P < 0.01);雷公藤甲素能降低血清中TNF-α、IL-17A、IFN-γ和L-4水平(P < 0.05~P < 0.01),减轻IgA的沉积(P < 0.01),抑制IL-1β、Caspase-1、IL-18及NLRP3的表达(P < 0.05~P < 0.01)。 结论雷公藤甲素对IgA肾病大鼠肾脏具有保护作用,其作用机制可能是通过抑制NLRP3炎症小体的激活,进而抑制炎症反应。 Abstract:ObjectiveTo investigate the protective effects of triptolide on kidney of IgA nephropathy(IgAN)rats and its relationship with NLRP3 inflammasome. MethodsForty SPF SD male rats were randomly divided into the control group, model group, low-dose triptolide group and high-dose triptolide groups.The IgAN rat model was established by oral bovine γ-globulin(BGG)for 8 weeks and intravenous injection of BGG, and treated with intragastric administration combined with low- and high-dose triptolide for 8 weeks.The levels of creatinine(Scr), urea nitrogen(BUN), total protein(TP), albumin, alanine aminotransferase(ALT), aspartate aminotransferase(AST), 24 h urinary protein(24 h TUP), TNF-α, IL-17A, IFN-γ and IL-4 were detected in four groups.The deposition of IgA and expression levels of IL-1β, Caspase-1, IL-18 and NLRP3 in renal tissue were observed. ResultsCompared with the model group, the levels of serum Scr and BUN, and 24 h TUP significantly decreased in triptolide group(P < 0.05 to P < 0.01).The triptolide could decrease the levels of serum TNF-α, IL-17A, IFN-γ, and IL-4(P < 0.05 to P < 0.01), reduce the deposition of IgA(P < 0.01), and inhibit the expression of IL-1β, Caspase-1, IL-18 and NLRP3(P < 0.05 to P < 0.01). ConclusionsThe protective effects of triptolide on IgA nephropathy may be related to the inhibition of NLRP3 inflammasome for suppressing the renal inflammatory response. -
Key words:
- triptolide /
- IgA nephropathy /
- inflammation /
- NLRP3 inflammasome
-
表 1 生化指标及24 h UTP含量变化的比较(x±s;ni=10)
指标 对照组 模型组 低剂量组 高剂量组 F P MS组内 BUN/(mmol/L) 3.91±0.53 19.87±2.99** 12.37±2.65△ 11.52±2.01△△ 20.21 < 0.01 0.003 Scr/(μmol/L) 41.02±3.58 66.83±11.02* 45.76±5.68△ 41.59±10.03△ 6.48 < 0.05 3.622 TP/(g/L) 59.03±8.22 60.52±10.57 59.63±7.86 63.19±10.28 0.12 >0.05 0.004 ALT/(U/L) 39.98±6.35 43.17±4.97 45.91±6.04 42.81±3.72 0.61 >0.05 0.005 AST/(U/L) 88.04±10.85 91.48±10.35 87.59±9.28 85.64±7.96 0.19 >0.05 0.008 24 h UTP/(mg/24 h) 1.98±0.14 46.92±9.95** 29.91±5.69△△ 24.68±3.73△△ 28.40 < 0.01 8.368 与对照组比较* P < 0.05,**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01 表 2 肾组织中炎症因子水平的比较(x±s;ni=10)
指标 对照组 模型组 低剂量组 高剂量组 F P MS组内 TNF-α/(ng/mL) 101.76±20.01 291.33±49.60** 199.62±25.54△ 168.68±21.05△△ 19.05 < 0.01 2.523 IL-17A/(ng/mL) 7.58±1.45 28.04±4.50* 16.12±4.58△ 13.16±3.25△ 14.58 < 0.05 0.062 IFN-γ/(ng/mL) 8.43±3.00 19.26±12.98** 12.51±3.20△ 11.77±4.65△ 4.75 < 0.05 4.732 IL-4/(ng/mL) 3.63±0.61 11.20±1.31** 6.33±0.64△△ 5.83±1.12△△ 32.74 < 0.01 5.019 IgA相对荧光强度 100±21.54 280.73±42.39** 171.69±41.02△△ 165.07±32.52△△ 13.64 < 0.01 0.000 与对照组比较* P < 0.05,**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01 表 3 肾组织中IL-1β、Caspase-1、IL-18及NLRP3蛋白的相对表达(x±s;ni=10)
蛋白指标 对照组 模型组 低剂量组 高剂量组 F P MS组内 IL-1β 1.00±0.36 1.97±0.50* 1.32±0.21△ 1.36±0.15△△ 4.47 < 0.05 0.003 Caspase-1 1.00±0.19 2.91±0.33** 1.99±0.38△△ 1.83±1.23△△ 22.35 < 0.01 0.008 IL-18 1.00±0.17 2.32±0.12** 1.71±0.13△△ 1.76±1.13△△ 41.95 < 0.01 0.187 NLRP3 1.00±0.21 2.53±0.55** 1.90±0.29△△ 1.76±0.28△△ 9.24 < 0.01 1.732 与对照组比较*P < 0.05,**P < 0.01;与模型组比较△P < 0.05,△△P < 0.01 -
[1] TRIMARCHI H, BARRATT J, CATTRAN DC, et al.Oxford classification of IgA nephropathy 2016:an update from the IgA Nephropathy Classification Working Group[J].Kidney Int, 2017, 91(5):1014. doi: 10.1016/j.kint.2017.02.003 [2] YOON CY, CHANG TI, KANG EW, et al.Clinical usefulness of the Oxford classification in determining immunosuppressive treatment in IgA nephropathy[J].Ann Med, 2017, 49(3):217. doi: 10.1080/07853890.2016.1252058 [3] LIN J, CHENG Z, QIAN Q.Elderly patients with glomerular diseases and IgA nephropathy[J].Nephrology(Carlton), 2017, 22:20. [4] ROBERT T, BERTHELOT L, CAMBIER A, et al.Molecular insights into the pathogenesis of IgA nephropathy[J].Trends Mol Med, 2015, 21(12):762. doi: 10.1016/j.molmed.2015.10.003 [5] D'AMICO G.Natural history of idiopathic IgA nephropathy and factors predictive of disease outcome[J].Semin Nephrol, 2004, 24(3):179. doi: 10.1016/j.semnephrol.2004.01.001 [6] 靳会欣, 庞国勋, 赵彩霞.雷公藤甲素药理作用及分子水平机制研究进展[J].河北医药, 2017, 39(12):1884. doi: 10.3969/j.issn.1002-7386.2017.12.038 [7] FU Y, LIN Q, GONG T, et al.Renal-targeting triptolide glucosamine conjugate exhibits lower toxicity and superior efficacy in attenuation of ischemia/reperfusion renal injury in rats[J].Acta Pharmacol Sin, 2016, 37(11):1467. doi: 10.1038/aps.2016.44 [8] 范鸿儒, 杨继红, 王萌, 等.雷公藤甲素延缓糖尿病肾病进展的实验研究[J].中国临床保健杂志, 2018, 21(3):377. doi: 10.3969/J.issn.1672-6790.2018.03.024 [9] CAO Y, HUANG X, FAN Y, et al.Protective effect of triptolide against glomerular mesangial cell proliferation and glomerular fibrosis in rats involves the TGF-β1/Smad signaling pathway[J].Evid Based Complement Alternat Med, 2015, 2015:814089. [10] SCHRODER K, TSCHOPP J.The inflammasomes[J].Cell, 2010, 140(6):821. doi: 10.1016/j.cell.2010.01.040 [11] LORENZ G, DARISIPUDI MN, ANDERS HJ.Canonical and non-canonical effects of the NLRP3 inflammasome in kidney inflammation and fibrosis[J].Nephrol Dial Transplant, 2014, 29(1):41. doi: 10.1093/ndt/gft332 [12] SHI B, NI Z, CAO L, et al.Serum IL-18 is closely associated with renal tubulointerstitial injury and predicts renal prognosis in IgA nephropathy[J].Mediators Inflamm, 2012:728417. [13] HAHN WH, CHO BS, KIM SD, et al.Interleukin-1 cluster gene polymorphisms in childhood IgA nephropathy[J].Pediatric Nephrol, 2009, 24(7):1329. doi: 10.1007/s00467-009-1146-5 [14] KATZIR Z, LEIBOVITCH E, Vaknin H, et al.Effect of atorvastatin on IgA nephropathy in the rat[J].Clin Nephrol, 2013, 79(3):214. doi: 10.5414/CN107621 [15] TIAN J, WANG Y, GUO H, et al.The Akt/mTOR/p70S6K pathway is activated in IgA nephropathy and rapamycin may represent a viable treatment option[J].Exp Mol Pathol, 2015, 99(3):435. doi: 10.1016/j.yexmp.2015.08.004 [16] HAN F, WANG S, CHANG Y, et al.Triptolide prevents extracellular matrix accumulation in experimental diabetic kidney disease by targeting microRNA-137/Notch1 pathway[J].J Cell Physiol, 2017, 233(3):2225. [17] XUE M, CHENG Y, HAN F, et al.Triptolide Attenuates Renal Tubular Epithelial-mesenchymal Transition Via the MiR-188-5p-mediated PI3K/AKT Pathway in Diabetic Kidney Disease[J].Int J Biol Sci, 2018, 14(11):1545. doi: 10.7150/ijbs.24032 [18] KAMEI K, OGURA M, SATO M, et al.Evolution of IgA nephropathy into anaphylactoid purpura in six cases——further evidence that IgA nephropathy and Henoch-Schonlein purpura nephritis share common pathogenesis[J].Pediatr Nephrol, 2016, 31(5):779. doi: 10.1007/s00467-015-3290-4 [19] SHIBANO T, TAKAGI N, MAEKAWA K, et al.Epidemiological survey and clinical investigation of pediatric IgA nephropathy[J].Clin Exp Nephrol, 2016, 20(1):111. doi: 10.1007/s10157-015-1129-8 [20] 王骞, 叶紫, 徐蝶衣, 等.滋阴凉血汤对IgA肾病大鼠的肾脏保护机制研究[J].广州中医药大学学报, 2018, 35(4):672. [21] 杨南, 郭登洲.活血通络清热利湿方对IgA肾病大鼠肾组织IL-13、IL-4 mRNA及血清CIC的影响[J].中华中医药杂志, 2018, 33(7):2820. [22] 潘立军, 詹继红, 蔡青.补肾调肝化瘀法治疗气阴两虚型IgA肾病临床观察[J].中华中医药学刊, 2017, 35(12):3131. [23] YANG L, WANG Y, NUERBIVE A, et al.Effects of periostracum cicadae on cytokines and apoptosis regulatory proteins in an IgA nephropathy rat model[J].Int J Mol Sci, 2018, 19(6):1599. doi: 10.3390/ijms19061599 [24] YANG Q, SUN M, CHEN Y, et al.Triptolide protects podocytes from TGF-β-induced injury by preventing miR-30 downregulation[J].Am J Transl Res, 2017, 9(11):5150. [25] 梁倩.IgA肾病患者外周血单个核细胞活化与凋亡及雷公藤甲素干预研究[D].长沙: 中南大学, 2009. [26] GUO C, LI Y, ZHANG R, et al.Protective effect of salidroside against diabetic kidney disease through inhibiting BIM-Mediated apoptosis of proximal renal tubular cells in rats[J].Front Pharmacol, 2018, 9:1433. doi: 10.3389/fphar.2018.01433 [27] 王天然, 邹自英, 李继红, 等.槲皮素干预实验性慢性肾衰大鼠尿量与尿蛋白量动态变化[J].中国现代应用药学, 2012, 29(1):8. [28] 耿嘉, 白妍, 张雪枫, 等.清心莲子丸治疗IgA肾病的疗效观察及其对血清IFN-γ、IL-4水平的影响[J].中国中医药科技, 2018, 25(3):319. [29] NOGAKI F, MUSO E, KOBAYASHI I, et al.Interleukin12 induces crescentic glomerular lesions in a high IgA strain of ddY mice, independently of changes in IgA deposition[J].Nephrol Dial Transplant, 2000, 15(8):1146. doi: 10.1093/ndt/15.8.1146 [30] STANGOU M, BANTIS C, SKOULAROPOULOU M, et al.Th1, Th2 and Treg/T17 cytokines in two types of proliferative glomerulonephritis[J].Indian J Nephrol, 2016, 26(3):159. doi: 10.4103/0971-4065.159303 [31] TSAI YL, HHUA KF, CHEN A, et al.NLRP3 inflammasome:Pathogenic role and potential therapeutic target for IgA nephropathy[J].Sci Rep, 2017(7):41123. [32] ZHANG L, WANG XZ, LI YS, et al.Icariin ameliorates IgA nephropathy by inhibition of nuclear factor kappa b/Nlrp3 pathway[J].FEBS Open Bio, 2017, 7(1):54. doi: 10.1002/2211-5463.12161 [33] CHANG YP, KA SM, HSU WH, et al.Resveratrol inhibits NLRP3 inflammasome activation by preserving mitochondrial integrity and augmenting autophagy[J].J Cell Physiol, 2015, 230(7):1567. doi: 10.1002/jcp.24903 -





 下载:
下载: