-
乳腺癌作为女性中最常见的癌症,占女性癌症死亡原因的第二位[1],对女性健康造成了极大的威胁。目前乳腺癌的治疗手段主要包括手术治疗、放疗、化疗及内分泌治疗等[2-5]。紫杉醇是一种从裸子植物红豆杉的树皮中分离的天然次生代谢产物,在多种癌症中具有广泛的活性,包括乳腺癌、子宫内膜癌、非小细胞肺癌[6],但作为转移性乳腺癌一线化疗药物,仍然存在一些缺陷,如水溶性较差、生物利用度比较低以及较高的化疗不良反应等。纳米药物是使用纳米微粒作为载体来搭载药物,使药物和纳米颗粒结合而制成的药物,相对于常规药物具有粒径较小、催化效率高、吸附能力较强、活性中心多等优点。本研究分析紫杉醇长循环纳米载药胶束在乳腺癌耐药细胞中的作用,并探讨其联合病毒巨噬细胞炎性蛋白Ⅱ(vMIP-Ⅱ)N端肽(NT21MP)的作用。
-
人乳腺癌细胞株MCF-7于中科院细胞库购买;构建耐药细胞所用药物为紫杉醇;PEG2000-DPE于艾韦特公司购买;胎牛血清、DMEM高糖培养基于Hyclone公司购买;BAX、BCL-2、caspase3、N-cadherin、Vimentin、E-cadherin、snail、Slug、P-gp、BCRP、MRP抗体于Proteinteche公司购买;细胞凋亡试剂盒于Muse公司购买;细胞周期试剂盒于江苏凯基生物公司购买;β-actin抗体于武汉博士德公司购买;维生素E-聚乙二醇琥珀酸酯1000(TPGS)于阿拉丁生化公司购买;BCA-试剂盒于碧云天生物公司购买。
-
用紫杉醇递增浓度梯度诱导MCF-7细胞耐药性的产生,使MCF-7细胞处于10 μg/mL的紫杉醇浓度中稳定生长。培养细胞均用含有10%的胎牛血清的DMEM高糖培养基,并在5%CO2、37 ℃的环境下培养。所有用于实验的细胞均处于对数生长期。当细胞融合度至90%左右时,用0.25%的胰蛋白酶消化液消化离心并传代。
-
采用磺酰罗丹明B(Sulforhodamine B,SRB)染色法检测细胞增殖的活性,将对数生长期的细胞消化种在96孔板中,加药处理24 h后,吸出培养基,每孔加入200 μL 10%的三氯乙酸(TCA)溶液固定,100 μL 0.4%的SRB溶液染色。用1%乙酸溶液反复洗涤,每孔分别加入150 μL 10 mmol/L的Trisbase溶液,置于脱色摇床上剧烈摇动15 min。在515 nm波长下检测吸光度。存活率=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)。
-
检测细胞迁移能力,收集处于对数生长期的细胞,制备成单个细胞的混悬液,均匀的接种于6孔板中,置于37 ℃、5% CO2的培养箱中培养,待细胞密度长至90%且细胞处于对数生长期时,用10 μL无菌枪头垂直地在6孔板内划两道宽度均匀的直线,同时保证每孔内直线的宽度一致。吸去6孔板内的培养液,用PBS轻柔洗涤细胞2次后,再进行加药处理,处理完后随即拍照记录0 h的直线宽度,将6孔板放置于5% CO2、37 ℃培养箱内继续培养24 h,在24 h时观察并拍照记录直线宽度。
-
检测细胞侵袭能力,将处于对数生长期的细胞铺在6孔板中,当细胞融合度达到80%时对细胞进行处理,离心后重悬细胞。Transwell小室预先用60 μL的稀释的Matrigel基质胶处理好备用。向24孔板中加入600 μL含10%胎牛血清培养基,在上室加入100 μL的细胞悬液,24 h后取出小室弃上清,用棉签轻柔的擦去上室里未穿过的细胞。在下室中加入600 μL 4%的多聚甲醛固定细胞30 min。瑞氏-吉姆萨染液染色后,用高倍镜观察细胞数量。
-
将处于对数生长期的细胞用胰蛋白酶消化下来制成单细胞悬液,接种在6孔板中,置于5%CO2、37 ℃培养箱中孵育。当细胞密度达到80%进行不同分组的加药处理,继续置于5%CO2、37 ℃培养箱中孵育过夜。将细胞消化离心(1 000 r/min)5 min后弃上清。用预冷的PBS洗涤细胞,70%乙醇固定细胞,置于4 ℃冰箱过夜。1 000 r/min离心5 min后弃上清,用预冷的PBS洗涤细胞2次,继续离心后弃上清。每组加入50 mg/mL碘化丙啶(PI)染液500 μL和100 μg/mL RNase A 2 μL,室温避光染色30 min。用300目的尼龙网将细胞悬液过滤,上机检测细胞周期情况。
-
将处于对数生长期的细胞接种在6孔板中,5% CO2、37 ℃的培养箱中孵育过夜。细胞密度达到80%时进行实验处理,继续孵育24 h。用不含EDTA的胰蛋白酶将细胞消化后离心(1 000 r/min)5 min,弃清液。预冷的PBS洗涤细胞2次,弃清液,调整细胞密度约5×105个/毫升,取细胞悬液50 μL,加入同等体积的细胞凋亡试剂,室温避光30 min。300目的尼龙网过滤细胞悬液,上机检测细胞的凋亡情况。
-
配制SDS-聚丙烯酰胺凝胶,在每孔中加入25 μg的蛋白。设置恒定电压70 V,当蛋白跑到浓缩胶与分离胶的交界处时将电压调至100 V,直到溴酚蓝条带跑至分离胶边缘时,停止电泳。PVDF膜浸泡在甲醇溶液中激活;200 mA转膜1.5~2 h。将转膜好后的PVDF膜放于封闭液中封闭2 h。将膜浸泡在对应的一抗中4 ℃过夜。将PVDF膜浸泡在二抗中并置于37 ℃水浴2 h,用TBS洗膜3次后加入显影剂上机曝光。
-
采用方差分析和q检验。
-
空白纳米胶束载体对乳腺癌耐药细胞株没有明显细胞毒性,不同浓度紫杉醇胶束组的细胞存活率均低于紫杉醇组,紫杉醇胶束联合NT21MP组的细胞存活率更低(P < 0.01)(见表 1)。
分组 存活率/% 0.5 μmol/L 1 μmol/L 10 μmol/L 纳米胶束组 98.32±0.13 98.29±0.52 96.32±0.31 NT21MP组 99.25±1.75 98.45±0.86 94.55±1.59 紫杉醇组 90.68±0.22 80.18±4.56 64.58±1.26 紫杉醇纳米胶束组 82.73±3.78** 71.04±2.78** 50.26±0.63** 紫杉醇纳米胶束+NT21MP组 70.89±2.35**## 59.71±5.03**## 41.37±2.53**## F 91.56 79.00 862.60 P <0.01 <0.01 <0.01 MS组内 4.588 10.967 2.202 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 1 不同药物对乳腺癌耐药细胞株MCF-7/PR增殖的影响(ni=3;x±s)
-
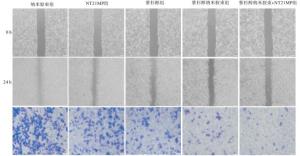
与空白纳米胶束组比较,NT21MP以及紫杉醇处理组细胞的迁移、侵袭能力下降,紫杉醇纳米胶束较单独紫杉醇处理的乳腺癌耐药细胞的迁移、侵袭能力进一步下降(P<0.01),且以紫杉醇纳米胶束联合多肽NT21MP作用更加明显(P<0.01)(见图 1、表 2)。
分组 n 迁移率/% 侵袭细胞数/个 纳米胶束组 3 73.83±1.47 116.33±8.23 NT21MP组 3 65.06±1.28 88.00±7.65 紫杉醇组 3 49.66±2.12 58.33±1.31 紫杉醇纳米胶束组 3 32.16±0.55** 32.33±1.46** 紫杉醇纳米胶束+NT21MP组 3 26.76±0.97**## 16.66±1.02**## F — 649.5 186.80 P — <0.01 <0.01 MS组内 — 1.907 26.229 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 2 不同药物对乳腺癌耐药细胞迁移、侵袭能力的影响(x±s)
-
与空白纳米胶束组比较,紫杉醇和NT21MP处理组乳腺癌细胞凋亡的数量和G2/M期细胞数量增加,紫杉醇纳米胶束组较紫杉醇处理组乳腺癌细胞的凋亡率和G2/M期细胞数量进一步增加(P<0.01),且以紫杉醇纳米胶束联合NT21MP组更为显著(P<0.01)(见图 2、表 3、表 4)。
分组 n 早期凋亡率/% F P MS组内 纳米胶束组 3 2.96±0.34 NT21MP组 3 8.13±0.75 紫杉醇组 3 17.46±1.25 125.00 <0.01 2.129 紫杉醇纳米胶束组 3 19.70±2.37** 紫杉醇纳米胶束+NT21MP组 3 26.60±1.67**## q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 3 不同药物对乳腺癌耐药细胞凋亡的影响(x±s)
分组 n G0/G1 S G2/M 纳米胶束组 3 55.03±0.41 33.61±0.98 8.49±1.82 NT21MP组 3 38.67±1.07 34.93±2.78 10.36±2.56 紫杉醇组 3 26.28±2.97 30.77±4.02 13.73±1.22 紫杉醇纳米胶束组 3 12.56±0.78** 26.38±1.17** 15.98±0.84** 紫杉醇纳米胶束+NT21MP组 3 9.83±2.67**## 20.29±0.85**## 17.75±0.27**## F — 296.90 19.78 18.22 P — <0.01 <0.01 <0.01 MS组内 — 3.574 5.388 2.427 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 4 不同药物对乳腺癌耐药细胞周期的影响(x±s)
-
与紫杉醇组相比,紫杉醇纳米胶束可以明显下调抑凋亡蛋白Bcl-2的蛋白表达水平,并促进凋亡相关蛋白Bax、caspase3的表达上升(P < 0.01);紫杉醇纳米胶束联合多肽NT21MP进一步下调乳腺癌耐药细胞中Bcl-2蛋白的表达量,增加caspase3和Bax的蛋白表达(P < 0.01);紫杉醇纳米胶束对耐药蛋白P-gp、BCRP的抑制能力强于紫杉醇,且以紫杉醇纳米胶束联合NT21MP作用更显著(P < 0.01)(见图 3、表 5)。
分组 n P-gp BCRP caspase3 Bax Bcl-2 纳米胶束组 3 1.00±0.008 1.00±0.006 1.00±0.003 1.00±0.005 1.00±0.001 NT21MP组 3 0.902±0.005 0.972±0.062 1.196±0.004 1.172±0.010 0.820±0.010 紫杉醇组 3 0.812±0.009 0.731±0.031 1.267±0.005 1.231±0.008 0.763±0.022 紫杉醇纳米胶束组 3 0.712±0.012** 0.626±0.013** 1.330±0.011** 1.401±0.020** 0.711±0.071** 紫杉醇纳米胶束+NT21MP组 3 0.669±0.004**## 0.558±0.010**## 1.523±0.008**## 1.579±0.012**## 0.569±0.032**## F — 201.03 759.53 132.16 776.93 291.03 P — <0.01 <0.01 <0.01 <0.01 <0.01 MS组内 — 0.000 0.002 0.000 0.001 0.000 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 5 不同药物对乳腺癌耐药细胞的耐药及凋亡相关蛋白表达的影响(x±s)
-
与紫杉醇组比较,紫杉醇纳米胶束组EMT相关标志物E-cadherin蛋白表达水平明显上调,Vimentin、Slug蛋白表达水平下调,且以紫杉醇纳米胶束联合NT21MP作用更显著(P < 0.01)(见图 4、表 6)。
分组 n Vimentin E-cadherin Slug 纳米胶束组 3 1.00±0.004 1.00±0.002 1.00±0.005 NT21MP组 3 0.911±0.0050 1.072±0.032 0.887±0.006 紫杉醇组 3 0.805±0.005 1.252±0.006 0.753±0.012 紫杉醇纳米胶束组 3 0.731±0.012** 1.355±0.032** 0.676±0.218** 紫杉醇纳米胶束+NT21MP组 3 0.608±0.007**## 1.562±0.003**## 0.607±0.010**## F — 1286.54 304.03 191.83 P — <0.01 <0.01 <0.01 MS组内 — 0.000 0.001 0.000 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 6 不同药物对乳腺癌耐药细胞EMT相关蛋白表达的影响(x±s)
-
紫杉醇在临床上是治疗乳腺癌和卵巢癌的一线药物,虽然效果显著,但其难溶于水,且药物利用率较低[7-10]。随着纳米技术的不断发展,纳米技术在医药领域被广泛应用。纳米药物是使用纳米微粒作为载体搭载药物,使药物和纳米颗粒结合而制成的药物。与常规药物相比,纳米材料搭载的药物具有提高药物的效率、稳定性,增强药物的靶向作用、溶解度以及药物控释等优点。由于纳米载体修饰药物方式的多样化,使药剂型具有更大的发展空间和巨大潜能。
PEG2000-DSPE载药胶束是一种高分子化合物,胶束粒径均一,能够增加细胞摄取,且具有抗肿瘤活性,对正常组织毒性作用较小。同时PEG2000-DSPE载药胶束制剂实现了靶向、缓释给药,延长了血循环时间,还可以提高化疗药物溶解性和药效,保护药物免于降解[11]。因此,PEG2000-DSPE纳米胶束常被应用于难溶或不溶性药物的增溶剂,是一种良好的抗肿瘤药物纳米胶束载体。TPGS是一种新型生物材料,在抗多重耐药和促进药物吸收方面具有重要作用[12]。TPGS作为一种非离子表面活性剂,具有乳化药物、生物相容性和稳定的理化性质,因此TPGS可作为一种辅助稳定剂,使药物的性质更加稳定[13]。甲氨蝶呤与金-白蛋白纳米粒子结合后,使甲氨蝶呤的稳定性更好, 对乳腺癌细胞的杀伤能力更强[14]。纳米脂质体搭载阿霉素后大大地降低了药物的心脏毒性,并且能提高阿霉素对肿瘤细胞的抑制作用[15]。PEG-DSPE搭载吉西他滨,增加了小鼠多种免疫细胞的数量,增强吉西他滨治疗胆管癌的效果[16]。基于TPGS的抗肿瘤药物纳米制剂具有更好的抗肿瘤效果,循环时间长以及生物利用度高,设计了基于TPGS修饰的纳米胶束系统(PEG2000-DSPE-TPGS),并联合NT21MP对乳腺癌的影响。所以本研究以纳米载体为切入点,使PEG2000-DSPE-TPGS搭载紫杉醇制成紫杉醇纳米胶束。通过比较紫杉醇、紫杉醇纳米胶束及其联合多肽NT21MP对乳腺癌细胞增殖、迁移、侵袭、凋亡、周期等生物学活性的影响,并探讨紫杉醇纳米胶束及其联合多肽NT21MP对乳腺癌耐药细胞的作用机制。本研究结果表明,紫杉醇纳米胶束对乳腺癌细胞的增殖、迁移、侵袭、凋亡的抑制作用明显强于紫杉醇,紫杉醇纳米胶束联合多肽NT21MP后抑制作用进一步加强,且细胞存活率随着浓度的升高,抑制能力进一步增强。
此外,在本研究中,紫杉醇纳米胶束及其联合多肽NT21MP处理乳腺癌耐药细胞后,EMT相关蛋白E-cadherin表达上调,Vimentin、Slug表达下调,而紫杉醇纳米胶束联合多肽NT21MP的效果更加明显。本研究还发现,紫杉醇纳米胶束抑制抗凋亡蛋白Bcl-2的表达,促进凋亡蛋白Bax、caspase3的表达。紫杉醇纳米胶束联合多肽NT21MP效果更明显,同时对耐药蛋白P-gp、BCRP的作用也是如此。
综上所述,紫杉醇通过与TPGS-PEG2000-DSPE结合制成紫杉醇纳米胶束,可以改善紫杉醇药物原有的缺陷,提升药效。紫杉醇纳米胶束在体外可有效抑制乳腺癌耐药细胞的增殖、迁移、侵袭以及逆转耐药和EMT的作用,通过联合多肽NT21MP可以更有效地抑制乳腺癌耐药细胞的生物学活性以及逆转EMT和耐药。
紫杉醇长循环纳米胶束联合vMIP-ⅡN端肽逆转乳腺癌细胞耐药的研究
Study on the paclitaxel long-circulating nanomicelles combined with NT21MP to reverse drug resistance in breast cancer MCF-7/PR cells
-
摘要:
目的探讨紫杉醇长循环纳米载药胶束联合病毒巨噬细胞炎性蛋白Ⅱ(vMIP-Ⅱ)N端肽(NT21MP)对乳腺癌紫杉醇耐药细胞株(MCF-7/PR)耐药性的影响。 方法采用磺酰罗丹明B(SRB)染色法检测乳腺癌耐药细胞株MCF-7/PR的存活率;细胞划痕及Transwell实验检测紫杉醇纳米载药胶束联合NT21MP对乳腺癌耐药细胞迁移、侵袭能力的影响;流式细胞术分析细胞凋亡、周期;Western blotting实验检测细胞凋亡、耐药及上皮间充质转化相关蛋白水平表达。 结果相对于紫杉醇组,紫杉醇纳米胶束更有效地抑制细胞增殖、迁移和侵袭,凋亡蛋白Bax、caspase3的蛋白表达水平上调,抗凋亡蛋白Bcl-2表达水平下调,且耐药相关蛋白MRP、P-gp和EMT相关蛋白Vimentin、Slug表达水平下调,E-cadherin表达上调(P < 0.01);相对于紫杉醇纳米胶束组,紫杉醇纳米胶束与NT21MP联合组对细胞增殖、迁移、侵袭、细胞周期的抑制,以及抗凋亡和逆转耐药作用更明显(P < 0.01)。 结论紫杉醇纳米胶束可有效发挥逆转乳腺癌细胞耐药性的作用,且以紫杉醇纳米胶束联合多肽药物NT21MP作用更明显。 -
关键词:
- 乳腺肿瘤 /
- 病毒巨噬细胞炎性蛋白ⅡN端肽 /
- 紫杉醇 /
- 耐药
Abstract:ObjectiveTo investigate the effects of paclitaxel long-circulating nanomicelles combined with vMIP-Ⅱ-N-terminal peptide(NT21MP) on drug resistance of paclitaxel-resistant brest cancer MCF-7/PR cells. MethodsSulforhodamine B(SRB) staining was used to detect the survival rate of breast cancer paclitaxel-resistant cell line MCF-7/PR.Cell scratch and Transwell assay were used to detect the effects of paclitaxel nanomicelles combined with NT21MP on the migration and invasion of paclitaxel-resistant cells.Flow cytometry was used to analyze the apoptosis and cell cycle.Western blotting was used to detect the expression of apoptosis, drug resistance and EMT-related proteins. ResultsCompared with paclitaxel group, the paclitaxel nanomicelles could effectively inhibit the cell proliferation, migration and invasion, the expression levels of apoptotic proteins Bax and caspase3 were up-regulated, the expression levels of anti-apoptotic proteins Bcl-2 were down-regulated, the expression levels of MRP, P-GP and EMT-related proteins Vimentin and Slug were down-regulated, and the expression levels of E-cadherin were up-regulated(P < 0.01).Compared with the paclitaxel nanomicelles group, the paclitaxel nanomicelles combined with NT21MP group had more significant effects on the inhibition of cell proliferation, migration, invasion, cycle, anti-apoptosis and reversal paclitaxel resistance. ConclusionsThe paclitaxel nanomicelles can effectively reverse the drug resistance of paclitaxel-resistant breast cancer cells, and the effects of the combination of paclitaxel manomicelles and NT21MP is more significant. -
Key words:
- breast neoplasms /
- vMIP-Ⅱ-N-terminal peptide /
- paclitaxel /
- drug resistance
-
表 1 不同药物对乳腺癌耐药细胞株MCF-7/PR增殖的影响(ni=3;x±s)
分组 存活率/% 0.5 μmol/L 1 μmol/L 10 μmol/L 纳米胶束组 98.32±0.13 98.29±0.52 96.32±0.31 NT21MP组 99.25±1.75 98.45±0.86 94.55±1.59 紫杉醇组 90.68±0.22 80.18±4.56 64.58±1.26 紫杉醇纳米胶束组 82.73±3.78** 71.04±2.78** 50.26±0.63** 紫杉醇纳米胶束+NT21MP组 70.89±2.35**## 59.71±5.03**## 41.37±2.53**## F 91.56 79.00 862.60 P <0.01 <0.01 <0.01 MS组内 4.588 10.967 2.202 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 2 不同药物对乳腺癌耐药细胞迁移、侵袭能力的影响(x±s)
分组 n 迁移率/% 侵袭细胞数/个 纳米胶束组 3 73.83±1.47 116.33±8.23 NT21MP组 3 65.06±1.28 88.00±7.65 紫杉醇组 3 49.66±2.12 58.33±1.31 紫杉醇纳米胶束组 3 32.16±0.55** 32.33±1.46** 紫杉醇纳米胶束+NT21MP组 3 26.76±0.97**## 16.66±1.02**## F — 649.5 186.80 P — <0.01 <0.01 MS组内 — 1.907 26.229 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 3 不同药物对乳腺癌耐药细胞凋亡的影响(x±s)
分组 n 早期凋亡率/% F P MS组内 纳米胶束组 3 2.96±0.34 NT21MP组 3 8.13±0.75 紫杉醇组 3 17.46±1.25 125.00 <0.01 2.129 紫杉醇纳米胶束组 3 19.70±2.37** 紫杉醇纳米胶束+NT21MP组 3 26.60±1.67**## q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 4 不同药物对乳腺癌耐药细胞周期的影响(x±s)
分组 n G0/G1 S G2/M 纳米胶束组 3 55.03±0.41 33.61±0.98 8.49±1.82 NT21MP组 3 38.67±1.07 34.93±2.78 10.36±2.56 紫杉醇组 3 26.28±2.97 30.77±4.02 13.73±1.22 紫杉醇纳米胶束组 3 12.56±0.78** 26.38±1.17** 15.98±0.84** 紫杉醇纳米胶束+NT21MP组 3 9.83±2.67**## 20.29±0.85**## 17.75±0.27**## F — 296.90 19.78 18.22 P — <0.01 <0.01 <0.01 MS组内 — 3.574 5.388 2.427 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 5 不同药物对乳腺癌耐药细胞的耐药及凋亡相关蛋白表达的影响(x±s)
分组 n P-gp BCRP caspase3 Bax Bcl-2 纳米胶束组 3 1.00±0.008 1.00±0.006 1.00±0.003 1.00±0.005 1.00±0.001 NT21MP组 3 0.902±0.005 0.972±0.062 1.196±0.004 1.172±0.010 0.820±0.010 紫杉醇组 3 0.812±0.009 0.731±0.031 1.267±0.005 1.231±0.008 0.763±0.022 紫杉醇纳米胶束组 3 0.712±0.012** 0.626±0.013** 1.330±0.011** 1.401±0.020** 0.711±0.071** 紫杉醇纳米胶束+NT21MP组 3 0.669±0.004**## 0.558±0.010**## 1.523±0.008**## 1.579±0.012**## 0.569±0.032**## F — 201.03 759.53 132.16 776.93 291.03 P — <0.01 <0.01 <0.01 <0.01 <0.01 MS组内 — 0.000 0.002 0.000 0.001 0.000 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 表 6 不同药物对乳腺癌耐药细胞EMT相关蛋白表达的影响(x±s)
分组 n Vimentin E-cadherin Slug 纳米胶束组 3 1.00±0.004 1.00±0.002 1.00±0.005 NT21MP组 3 0.911±0.0050 1.072±0.032 0.887±0.006 紫杉醇组 3 0.805±0.005 1.252±0.006 0.753±0.012 紫杉醇纳米胶束组 3 0.731±0.012** 1.355±0.032** 0.676±0.218** 紫杉醇纳米胶束+NT21MP组 3 0.608±0.007**## 1.562±0.003**## 0.607±0.010**## F — 1286.54 304.03 191.83 P — <0.01 <0.01 <0.01 MS组内 — 0.000 0.001 0.000 q检验:与紫杉醇组比较**P<0.01;与紫杉醇纳米胶束组比较##P<0.01 -
[1] FAHAD ULLAH M.Breast cancer:current perspectives on the disease status[J].Adv Exp Med Biol, 2019, 1152:51. [2] LETO G.Current status and future directions in the treatment of bone metastases from breast cancer[J].Clin Exp Pharmacol Physiol, 2019, 46(10):968. doi: 10.1111/1440-1681.13139 [3] LIN X, HONG S, CHEN J, et al.The potential targets for metastases:a study on altered circular RNA profile in breast cancer liver metastases[J].Epigenomics, 2019, 1750:1911. [4] ZHANG T, LIP H, HE C, et al.Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages[J].Adv Healthc Mater, 2019, 8(18):e1900543. doi: 10.1002/adhm.201900543 [5] GADALLA R, HASSAN H, IBRAHIM SA, et al.Tumor microenvironmental plasmacytoid dendritic cells contribute to breast cancer lymph node metastasis via CXCR4/SDF-1 axis[J].Breast Cancer Res Treat, 2019, 174(3):679. [6] ALQAHTANI FY, ALEANIZY FS, EL TAHIR E, et al.Paclitaxel[J].Profiles Drug Subst Excip Relat Methodol, 2019, 44:205. doi: 10.1016/bs.podrm.2018.11.001 [7] BAKRANIA AK, VARIYA BC, PATEL SS.Novel targets for paclitaxel nano formulations:hopes and hypes in triple negative breast cancer[J].Pharmacol Res, 2016, 111:577. doi: 10.1016/j.phrs.2016.07.023 [8] LIU Y, NG Y, TOH MR, et al.Lipid-dendrimer hybrid nanosystem as a novel delivery system for paclitaxel to treat ovarian cancer[J].J Control Release, 2015, 220(Pt A):438. [9] HASSAN MS, AWASTHI N, LI J, et al.Superior therapeutic efficacy of nanoparticle albumin bound paclitaxel over cremophor-bound paclitaxel in experimental esophageal adenocarcinoma[J].Transl Oncol, 2018, 11(2):426. [10] ERICA G, THOMAS LS.The paradox of paclitaxel neurotoxicity:mechanisms and unanswered questions[J].Neuropharmacology, 2013, 76(1):175. [11] SARISOZEN C, VURAL I, LEVCHENKO T, et al.PEG-PE-based micelles co-loaded with taxol and cyclosporine A or loaded with taxol and targeted by anticancer antibody overcome drug resistance in cancer cells[J].Drug Deliv, 2012, 19(4):169. doi: 10.3109/10717544.2012.674163 [12] HUANG L, CHEN H, ZHENG Y, et al.Nanoformulation of D-α-tocopheryl polyethylene glycol 1000 succinate-b-poly (ε-caprolactone-ran-glycolide) diblock copolymer for breast cancer therapy[J].Integr Biol(Camb), 2011, 3(10):993. [13] ZHANG Z, TAN S, FENG SS.Vitamin E TPGS as a molecular biomaterial for drug delivery[J].Biomaterials, 2012, 33(19):4889. doi: 10.1016/j.biomaterials.2012.03.046 [14] WANG Q, ZHANG P, LI Z, et al.Evaluation of polymer nanoformulations in hepatoma therapy by established rodent models[J].Theranostics, 2019, 9(5):1426. doi: 10.7150/thno.31683 [15] DAI W, JIN W, ZHANG J, et al.Spatiotemporally controlled co-delivery of anti-vasculature agent and cytotoxic drug by octreotide-modified stealth liposomes[J].Pharm Res, 2012, 29(10):2902. doi: 10.1007/s11095-012-0797-2 [16] KIM DH, IM BN, HWANG HS, et al.Gemcitabine-loaded DSPE-PEG-PheoA liposome as a photomediated immune modulator for cholangiocarcinoma treatment[J].Biomaterials, 2018, 183:139. doi: 10.1016/j.biomaterials.2018.08.052 -




 下载:
下载:





