-
广玉兰又名荷花玉兰,是木兰科木兰属植物,为常绿阔叶大叶乔木。《湖南植物志》中记载广玉兰的树皮、花及叶入药,具有祛风散寒、行气镇痛的功效,可治疗外感风寒头痛、鼻塞、呕吐腹泻、高血压、偏头痛等[1]。广玉兰中含有多种化学成分,如生物碱类、黄酮类、木脂素类、萜类、倍半萜内酯、脂肪酸类等[2-4]。现代药理学研究[4-7]表明,广玉兰具有抗炎、抗氧化、抗惊厥、抑制平滑肌等作用。近期,本课题组对广玉兰果实的化学成分及抗肿瘤活性进行研究过程中,首次获得了新颖结构的新木脂素类化合物双和厚朴酚A[8]。新木脂素类化合物是由C6-C3骨架的苯丙素氧化聚合而成,具有较强的生物活性,如抗肿瘤作用、肝保护和抗氧化作用、抗人类免疫缺陷病毒作用等[9]。然而,目前对广玉兰果实中有关双和厚朴酚A提取工艺的研究未曾报道。因此,本研究以广玉兰果实为原料,考察提取溶媒、料液比、浸泡时间及提取次数等因素,并以L9(34)正交试验筛选出最佳提取条件,为广玉兰资源的综合利用提供科学依据。
-
XFB-200型小型粉碎机(吉首市忠诚制药机械厂),梅特勒-托利多XP205型分析天平(瑞士梅特勒-托利多公司),SPD-15C型反相高效液相色谱仪[日本岛津企业管理(中国)有限公司],KQ5200B型超声波清洗器(昆山市超声仪器有限公司),IKARV10型旋转蒸发仪(上海人和科学仪器有限公司),Milli-QBiocel型超纯水仪(美国Millipore公司),Anke TGL-16B型高速离心机(上海安亭科学仪器厂),色谱柱SunFireTM C18(4.6×250mm, 5μm,美国Waters公司)。
-
药材采集于自蚌埠医学院内(经鉴定为木兰科木兰属植物广玉兰的果实),无水乙醇(分析纯)、无水甲醇(分析纯)、色谱甲醇、乙酸乙酯、二氯甲烷、正己烷(天津大茂化学试剂厂),双和厚朴酚A标准品(本课题组从广玉兰中分离纯化得到),乙腈(色谱纯,美国TEDIA公司),水(双蒸水,来自Milli-QBiocel超纯水仪)。
-
采用SunFireTM C18(4.6×250mm, 5μm)色谱柱,流动相为乙腈:水(75: 25,V/V),流速为1.0mL/min,柱温25℃,进样量为20μL,检测波长为254nm。
-
分别称取8份广玉兰果实粉末。第1份:取细粉末12g,加水500 mL加热煮沸45 min,得滤液备用。第2份:取细粉末12g,加无水甲醇100mL热回流3次,每次1 h,过滤,合并滤液备用。第3份:取细粉末12g,加无水甲醇200mL浸泡48h,过滤,得滤液备用。第4份:取细粉末12g,加无水乙醇100mL热回流3次,每次1h,过滤,合并滤液备用。第5份:取细粉末12g,加无水乙醇200mL浸泡48h,过滤,得滤液备用。第6份:取细粉末20g,加乙酸乙酯100mL浸泡48h, 过滤,得滤液备用。第7份:取细粉末20g,加二氯甲烷100mL浸泡48h,过滤,得滤液备用。第8份:取细粉末20g,加正己烷100mL浸泡48h,过滤,得滤液备用。
-
精密称取双和厚朴酚A标准品1.0 mg,并用色谱甲醇稀释成不同浓度的对照品溶液。
-
分别吸取对照品溶液和供试品溶液20 μL,注入HPLC色谱仪,并在上述色谱条件下进行分析。
-
精密称取双和厚朴酚A标准品并将其稀释成0.94 mg/mL,再将其等倍数稀释成9份,其质量浓度分别为470.000、235.000、117.500、58.750、29.375、14.688、7.344、3.672、1.836 μg/mL。进样量均为20 μL,测得峰面积。分别吸取上述系列浓度溶液,注入HPLC色谱仪进行分析,并记录峰面积。
-
取双和厚朴酚A标准品1mg并稀释成1mg/mL,在同一天内对同一份样品连续测定6次,用相对标准偏差来计算日内精密度。
-
取广玉兰果实粉末正己烷提取的浸膏5.75mg,用色谱甲醇将其稀释成5.75mg/mL,在色谱条件下连续进样6次,测其峰面积和RSD值。
-
取广玉兰果实粉末正己烷提取浸膏9.3mg,用色谱甲醇将其溶解稀释成9.3mg/mL,分别于0、2、4、6、8、10、24h进样,测峰面积并计算相对标准偏差(RSD)值。
-
称取广玉兰果实粉末10g,选择正己烷为提取溶剂,以料液比(A)、浸泡时间(B)、提取次数(C)为考察指标,按照L9(34)正交表进行试验,因素水平表见表 1。
水平 因素 料液比(A) 浸泡时间(B) 提取次数(C) 1 1:10 12 h 1 2 1:30 24 h 3 3 1:50 48 h 6 表 1 试验因素计划表
-
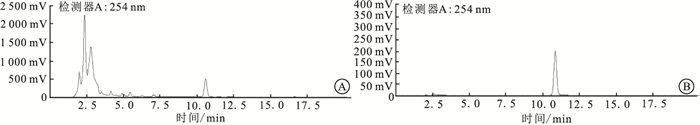
按照“1.3.1色谱条件”下进行分析,待测组分峰形良好(见图 1)。双和厚朴酚A(对照品)保留时间为10.8 min,溶媒提取浸膏中双和厚朴酚A与其他杂质峰可达到基线分离。
-
以峰面积为纵坐标(Y),浓度为横坐标(X), 得线性回归方程为Y=4.5E+ 7X-53 724,r=0.999 6(n=9),表明双和厚朴酚A在0.184~470μg/mL浓度范围内具有良好的线性关系。
-
取双和厚朴酚A标准品并配置成1mg/mL,在同一天内对同一份样品连续进样6次,按“1.3.1色谱条件”进行分析。用RSD来计算日内精密度,RSD为0.68%,表明仪器精密度良好(见表 2)。
测试序号 峰面积 RSD值/% 1 72 361 120 0.68 2 71 059 594 3 71 897 281 4 72 152 289 5 72 902 056 6 72 217 752 表 2 双和厚朴酚A标准品的精密度试验结果
-
取广玉兰果实粉末正己烷提取浸膏5.7mg,用色谱甲醇将其稀释成5.7mg/mL,在色谱条件下连续进样6次,测其峰面积和并计算RSD为1.61%(见表 3)。
测试序号 峰面积 RSD值/% 1 1 161 111 1.60 2 1 180 453 3 1 197 080 4 1 194 462 5 1 185 337 6 1 218 410 表 3 用正己烷提取广玉兰果实粉末的重现性试验结果
-
取广玉兰果实粉末正己烷提取浸膏9.3 mg,用色谱甲醇将其溶解配制成9.3 mg/mL,分别取常温放置不同时间(0、2、4、6、8、10、24 h)的供试品溶液进行分析,测峰面积并计算RSD值(见表 4),RSD为1.39%,表明供试品溶液在常温放置24 h内基本稳定。
测试时间 峰面积 RSD值/% 0 2 948 182 1.39 2 3 012 384 4 3 024 136 6 3 062 223 8 3 006 213 10 3 023 739 24 3 078 221 表 4 广玉兰药材粉末正己烷提取浸膏的稳定性试验结果
-
取各种溶媒浸泡所得的浸膏进样,通过测得的峰面积进行比较(见表 5)。从实验数据比较可以发现,正己烷浸泡法提取的有效成分量最多;但为了进一步确定正己烷的投料比、浸泡时间、提取次数等因素的影响关系,为此设计了正交实验。
方法 药材量/g 浸膏量/g 进样浓度/(mg/mL) 双和厚朴酚A含量/(mg/g) 水提法 12.2332 2.7815 10.6 0.283 甲醛回流 12.1003 1.0083 10.3 1.553 甲醛浸泡 12.3401 0.8075 10.5 1.905 乙醇回流 12.3025 0.9069 10.2 2.059 乙醇浸泡 12.4545 0.4403 10.9 3.486 乙醇乙酯浸泡 20.0882 0.3515 12.1 3.291 二氯甲烷浸泡 19.9969 0.3679 11.7 3.991 正已烷浸泡 20.043 5 0.115 0 11.5 6.575 表 5 各种溶媒提取浸膏的含量测定结果
-
以双和厚朴酚A含量为指标,各因素对正己烷提取结果影响大小依次为A > B > C,即料液比为最主要影响因素;不同因素内各水平对结果的影响强弱为:A2 > A1 > A3;B3 > B1 > B2;C2 > C1 > C3;其最佳因素水平组合为A2B3C2,即料液比为1: 30、浸泡时间为48 h、提取次数为3次(见表 6)。研究结果显示,因素A和B具有显著影响(P < 0.05),因素C无显著影响(P > 0.05)(见表 7)。
序号 因素 双和厚朴酚A含量/(mg/mL) A B C 1 1 1 1 0.869 2 1 2 2 0.789 3 1 3 3 0.887 4 2 1 3 0.844 5 2 2 1 0.841 6 2 3 2 0.912 7 3 1 2 0.811 8 3 2 3 0.498 9 3 3 1 0.772 K1 0.848 0.841 0.827 — K2 0.866 0.709 0.837 — K3 0.694 0.857 0.743 — R 0.172 0.148 0.094 — 表 6 L9(34)正交试验设计
变异来源 SS df MS F P 料液比 0.054 2 1.543 5.14 < 0.05 浸泡时间 0.040 2 1.143 5.14 < 0.05 提取次数 0.011 2 0.314 5.14 > 0.05 误差 0.110 6 — — — 表 7 正交试验方差分析表
-
广玉兰果实中的有效成分为联苯型新木脂素类化合物,双和厚朴酚A显示出一定的抑制肿瘤细胞增殖和诱导凋亡的能力[8]。有研究[10-12]报道,厚朴酚(magnolol)、和厚朴酚(honokiol)及和厚朴新酚(obovatol)等新木脂素类化合物具有多种显著的生物学活性,如抗肿瘤、抗病毒、抗血小板、抗炎等。因此,本研究选取新木脂素类化合物双和厚朴酚A为指标成分,采用正交试验进行了提取工艺优化。参考药用植物中活性成分的含量测定的相关文献[3, 13-15],本研究采用反相高效液相色谱法测定了正交设计提取获得的样品,具有较好的灵敏度和准确度。
本研究通过不同溶媒提取比较、溶剂浓度、溶剂体积、提取时间等因素的考察,确立正交试验因素计划表,并用正交设计试验进行筛选得到了最佳提取工艺为正己烷作为提取溶媒、料液比为1: 30、浸泡时间为48 h、提取次数为3次,在该试验条件的确定下同时进行了稳定性和重复性试验,证明该提取方法切实可行。但是,在提取过程中也尝试了其他的溶媒提取(如甲醇、乙醇),发现提取后双和厚朴酚A发生降解并且提取效率低下,其可能与双和厚朴酚A在极性大的溶剂中的稳定性相关。
本研究首次通过正交设计试验对广玉兰果实中双和厚朴酚A的提取工艺进行优化,其方法简单可行、合理、稳定性好。
广玉兰果实中双和厚朴酚A提取工艺研究
Study on the extraction technology of bishonokiol A from Magnolia grandiflora seeds
-
摘要:
目的优化广玉兰果实的有效成分双和厚朴酚A的提取工艺。 方法采用反相高效液相色谱法测定不同提取溶媒中双和厚朴酚A的含量。以双和厚朴酚A得率为指标,采用L9(34)正交试验考察料液比、浸泡时间及提取次数3个因素对提取工艺的影响。 结果双和厚朴酚A的最佳提取工艺条件是正己烷为提取溶媒,料液比为130、浸泡时间为48 h、提取次数为3次。 结论通过正交设计法优选的双和厚朴酚A提取工艺简单、稳定可靠、重复性好。 Abstract:ObjectiveTo optimize the extraction technology of bishonokiol A from the Magnolia grandiflora seeds. MethodsThe concentration of bishonokiol A in different extracting solvents was determined using RP-HPLC method.The yield rate of bishonokiol A was set as the indictor, the effects of the ratio of material-to-liquid, soaking duration, and extraction times on the extraction technology were observed using L9(34) orthogonal test. ResultsThe orthogonal test showed that the ratio of material-to-liquid for 130, soaking duration for 48 h, and extraction times for three times were the best technological condition of bishonokiol A extraction. ConclusionsThe optimized extraction process designed by orthogonal test is simple, stable and reliable. -
Key words:
- bishonokiol A /
- Magnolia grandiflora /
- orthogonal design
-
表 1 试验因素计划表
水平 因素 料液比(A) 浸泡时间(B) 提取次数(C) 1 1:10 12 h 1 2 1:30 24 h 3 3 1:50 48 h 6 表 2 双和厚朴酚A标准品的精密度试验结果
测试序号 峰面积 RSD值/% 1 72 361 120 0.68 2 71 059 594 3 71 897 281 4 72 152 289 5 72 902 056 6 72 217 752 表 3 用正己烷提取广玉兰果实粉末的重现性试验结果
测试序号 峰面积 RSD值/% 1 1 161 111 1.60 2 1 180 453 3 1 197 080 4 1 194 462 5 1 185 337 6 1 218 410 表 4 广玉兰药材粉末正己烷提取浸膏的稳定性试验结果
测试时间 峰面积 RSD值/% 0 2 948 182 1.39 2 3 012 384 4 3 024 136 6 3 062 223 8 3 006 213 10 3 023 739 24 3 078 221 表 5 各种溶媒提取浸膏的含量测定结果
方法 药材量/g 浸膏量/g 进样浓度/(mg/mL) 双和厚朴酚A含量/(mg/g) 水提法 12.2332 2.7815 10.6 0.283 甲醛回流 12.1003 1.0083 10.3 1.553 甲醛浸泡 12.3401 0.8075 10.5 1.905 乙醇回流 12.3025 0.9069 10.2 2.059 乙醇浸泡 12.4545 0.4403 10.9 3.486 乙醇乙酯浸泡 20.0882 0.3515 12.1 3.291 二氯甲烷浸泡 19.9969 0.3679 11.7 3.991 正已烷浸泡 20.043 5 0.115 0 11.5 6.575 表 6 L9(34)正交试验设计
序号 因素 双和厚朴酚A含量/(mg/mL) A B C 1 1 1 1 0.869 2 1 2 2 0.789 3 1 3 3 0.887 4 2 1 3 0.844 5 2 2 1 0.841 6 2 3 2 0.912 7 3 1 2 0.811 8 3 2 3 0.498 9 3 3 1 0.772 K1 0.848 0.841 0.827 — K2 0.866 0.709 0.837 — K3 0.694 0.857 0.743 — R 0.172 0.148 0.094 — 表 7 正交试验方差分析表
变异来源 SS df MS F P 料液比 0.054 2 1.543 5.14 < 0.05 浸泡时间 0.040 2 1.143 5.14 < 0.05 提取次数 0.011 2 0.314 5.14 > 0.05 误差 0.110 6 — — — -
[1] FEI J, ZHOU TY.Flora of China volume 5[M].Beijing:Science Press, 1957:31. [2] MOHAMED SM, HASSAN EM, IBRAHIM NA.Cytotoxic and antiviral activities of aporphine alkaloids of Magnolia grandiflora L[J].Nat Prod Res 2010, 24(15):1395. doi: 10.1080/14786410902906959 [3] 张倩, 唐娜娜, 于海林, 等.广玉兰果实脂肪酸成分的GC-MS分析[J].河南大学学报(医学版), 2009, 28(22):101. [4] FELTENSTEIN MW, SCHUHLY W, WARNICK JE, et al.Anti-inflammatory and anti-hyperalgesic effects of sesquiterpene lactones from Magnolia and Bear's foot[J].Pharmacol Biochem Behav 2004, 79(2):299. doi: 10.1016/j.pbb.2004.08.008 [5] 何开跃, 李晓储, 樊亚苏, 等.广玉兰叶片抗氧化活性评价[J].林业科学研究, 2007, 20(5):644. doi: 10.3321/j.issn:1001-1498.2007.05.009 [6] BASTIDAS-RAMIREZ BE, NAVARRO-RUIZ N, QUEZADA-ARELLANO JD, et al.Anticonvulsant effects of Magnolia grandiflora L.in the rat[J].J Ethnopharmacol, 1998, 61(2):143. doi: 10.1016/S0378-8741(98)00028-2 [7] 齐汝霞, 李军, 陈维刚, 等.广玉兰幼果水提物对动物立体平滑肌作用的影响[J].济宁医学院学报, 2006, 29(3):23. doi: 10.3969/j.issn.1000-9760.2006.03.009 [8] LI HM, ZHAO SR, HUO Q, et al.A new dimeric neolignan from Magnolia grandiflora L.seeds[J].Arch Pharm Res, 2015, 38(6):1066. doi: 10.1007/s12272-014-0476-4 [9] 裴月湖, 娄红祥.天然药物化学[M].北京:人民卫生出版社, 2016. [10] ARORA S, SINGH S, PIAZZA GA, et al.Honokiol:a novel natural agent for cancer prevention and therapy[J].Current Molecular Medicine, 2012, 12:1244. doi: 10.2174/156652412803833508 [11] YU JY, LEE JJ, JUNG JK, et al.Anti-platelet activity of diacetylated obovatol through regulating cyclooxygenase and lipoxygenase activities[J].Arch Pharm Res, 2012, 35:2191. doi: 10.1007/s12272-012-1217-1 [12] OH JH, KANG LL, BAN JO, et al.Anti-inflammatory effect of 4-O-methylhonokiol, compound isolated from Magnolia officinalis through inhibition of NF-κB[J].Chemico-Biological Interactions, 2009, 180:506. doi: 10.1016/j.cbi.2009.03.014 [13] 张斌, 蒋立科, 王红梅.广玉兰叶总黄酮的提取工艺研究[J].化学与生物工程, 2009, 26(5):32. doi: 10.3969/j.issn.1672-5425.2009.05.009 [14] 朱娜, 李见春, 张文静, 等.徐长卿药材中丹皮酚超声提取工艺研究[J].亚太传统医药, 2015, 11(2):37. [15] 郑庆委, 张涛, 徐志本.水提法和微波助提法在蛹虫草多糖提取中的应用[J].蚌埠医学院学报, 2011, 36(11):1263. doi: 10.3969/j.issn.1000-2200.2011.11.040 -





 下载:
下载: