-
急性呼吸窘迫综合征(ARDS)是指由各种非心源性致病因素所导致的急性进行性呼吸衰竭,临床表现为顽固性低氧、呼吸窘迫、双肺弥漫性浸润及并发多器官障碍。几十年来,ARDS病死率仍保持在30%~45%[1]。探索ARDS的发生机制、发现新的治疗手段对于降低病死率至关重要。近年来,人们在ARDS动物模型及脓毒症导致的ARDS病人中发现了呼吸道微生物群落的一些特殊变化,这一现象逐渐得到临床关注[2-4]。以ARDS病人为研究对象,研究其呼吸道微生物群落特点,可能对理解ARDS发病机制、发展过程及临床诊治提供更直接的依据。为此,我们进行了以下研究。
-
按照纳入及排除标准招募受试对象,签署知情同意书。课题得到蚌埠医学院伦理委员会的批准。纳入2016年12月至2017年6月气管插管的ARDS病人7例(ARDS组),收集病人肺泡灌洗液(BALF)和上消化道液(GJ);纳入同期健康志愿者4名(对照组),均为健康体检者,平均年龄28岁,均无肺部疾病,4周内无上呼吸道感染病史,3个月内均未曾使用抗生素,收集BALF(HB)标本。ARDS病人的临床信息见表 1。治疗期间共采集3个时间点的BALF用于分析病人肺内和上消化道内菌群,分别为:插管第0~1天标本记为A亚组(BALF)和B亚组(GJ);插管第3~4天标本记为C亚组(BALF)和D亚组(GJ);插管第7~9天标本记为E亚组(BALF)和F亚组(GJ)。因筛查出病人7为乙型肝炎携带者,退出本次研究。
病人 年龄/岁 性别 吸烟与否 酗酒与否 既往史 ARDS诱因 ARDS程度 28 d生存情况 细菌培养 病人1 53 男 是 是 无 重症肺炎 重度 生存 培养阴性 病人2 39 男 否 否 无 重症肺炎 轻度 死亡 培养阴性 病人3 68 女 否 否 左侧输尿管结石 脓毒症、多器官功能障碍、左肾盂脓肿 中度 生存 大肠埃希菌 病人4 65 女 否 否 冠心病、高血压3级 重症肺炎 中度 生存 培养阴性 病人5 84 女 否 否 冠心病、腰椎压缩性骨折 重症肺炎 重度 死亡 培养阴性 病人6 48 女 否 否 2型糖尿病 重症肺炎 中度 生存 洋葱伯克霍尔德菌 病人8 73 男 是 否 冠心病、高血压3级 重症肺炎 中度 生存 棒状杆菌、乙酸钙不动杆菌 表 1 ARDS病人的临床信息
-
纳入标准:(1)均为诊断为ARDS的住院病人,标准参考ARDS柏林定义[5];(2)年龄18周岁以上;(3)需气管插管并机械通气治疗病人。排除标准:(1)有明确消化道疾病者(如:既往确诊胃溃疡、胃癌、克罗恩病、溃疡性结肠炎等);(2)有慢性肺部疾病(如慢性肺间质纤维化或慢性支气管炎等),曾经接受免疫调节剂治疗[如粒细胞集落刺激因子、环磷酰胺、环孢霉素、干扰素和肿瘤坏死因子-α拮抗剂等(不包括糖皮质激素)],部分肺切除术后;(3)有血液系统疾病,慢性肝病、器官移植者及其他免疫缺陷情况(如人类免疫缺陷病毒及粒细胞减少症等);(4)入院前已行气管插管机械通气病人>48 h者。
-
于研究对象的右中叶或病变部位以37 ℃0.9%氯化钠溶液进行常规肺泡灌洗术,回收40 mL后终止操作。BALF 1 h内送实验室预处理。取常规细菌培养,剩余部分冻存。
-
ARDS病人常规留置鼻胃管,禁饮禁食4~6 h后经鼻胃管快速注入37 ℃灭菌0.9%氯化钠溶液50 mL,5 min后回抽,待回收液40 mL左右终止操作。胃液1 h内送实验室预处理(去污、分装)。
-
每5 mL细胞沉淀加500 μL细胞裂解液完全裂解细胞,按经典的酚-三氯甲烷法提取DNA,提取后的DNA用1%的琼脂糖凝胶电泳检测DNA完整性,并使用Qubit Fluoroumeter测定浓度,所提取的DNA冻存于-80 ℃冰箱。
-
测序工作委托华大基因(BGI)代为完成,过程如下:通过Illumina平台(HiSeq 2500/4000)将细菌16S rDNA进行Paired-end测序,利用软件USEARCH (v7.0.1090)将拼接好的序列在97%相似度下聚类为操作分类单元(Operational Taxonomic Units,OTU)。得到OTU代表序列后,通过RDP classifer (v2.2)软件将OTU代表序列与数据库有比对进行物种注释,置信度阈值设置为0.80。基于OTU和物种注释结果进行样品物种复杂度分析及组间物种差异分析。
-
采用方差分析和χ2检验。
-
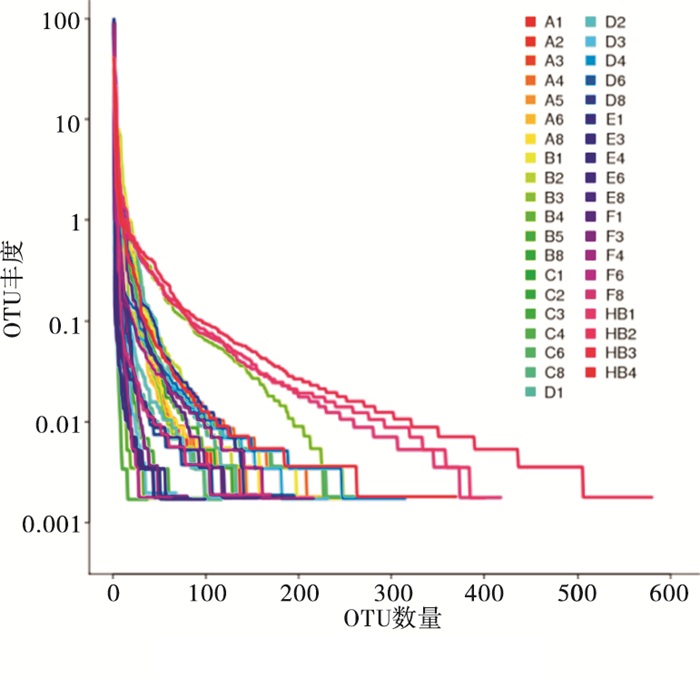
所有样品共得到2 287 643条序列(Tags),平均每个样品58 657条(平均长度252 bp),SD值为650(平均1 bp);再依据97%相似度将Tags聚类为OTU,共产生1 255个OTU。OTU Rank曲线(见图 1)展现每个样品中菌种多样性(丰富程度和均匀程度)特征。Shannon指数反映群落的多样性,样品Shannon指数的稀释曲线见图 2,当曲线趋于平缓或达平台期时,说明本研究每个标本的测序量已基本反映标本中细菌物种的多样性组成。
-
本研究对ARDS病人呼吸道、上消化道标本以及对照组呼吸道标本等进行了16S rDNA检测。3组标本Simpson指数(一种反映标本中物种多样性的指标,指数越小则细菌种类越丰富)差异无统计学意义(P>0.05)(见表 2)。主成分分析(principal component analysis,PCA)结果显示:ARDS组和对照组的呼吸道菌群有显著的分离趋势。其中,主成分1(principal components 1,PC1)可以解释34.32%的变异,主成分2(PC2)可以解释21.71%的变异;PC1方向差异主要是由于采集标本的部位不同,PC2方向差异主要由于ARDS和健康对照者的差异造成(见图 3)。
分组 n Simpson指数 F P MS组内 对照组 4 0.14±0.07 ARDS病人呼吸道组 18 0.45±0.31 2.16 >0.05 0.086 ARDS病人上消化道组 17 0.47±0.30 表 2 3组标本Simpson指数比较结果(x±s)
-
高通量测序获取39个标本(ARDS病人呼吸道组n=18, ARDS病人上消化道组n=17, 健康对照组n=4)细菌群落的门水平至种水平的构成信息:在门水平,ARDS病人与健康人肺内菌群构成差异有统计学意义,Firmicutes(88.99% vs.38.56%,χ2= 6.49,P < 0.05)在ARDS肺内显著增加,而ARDS病人肺内Bacteroidetes(7.69% vs.24.50%,χ2= 3.89,P < 0.05)和Proteobacteria(2.55% vs.10.54%,χ2= 5.31,P < 0.05)显著减少。可见ARDS病人随着插管时间延长,病人肺内菌群中Proteobacteria(2.55% vs.74.65%,χ2=5.01,P < 0.05)丰度明显增加,Firmicutes(88.99% vs.9.81%,χ2=14.67,P < 0.05)相对丰度减少。ARDS病人上消化道内菌群在插管期间亦有变化,但是在门水平改变并无显著统计学意义,而在属水平上Acinetobacter(0.53% vs.53.70%,χ2= 6.99,P < 0.05)相对丰度增加。根据样品细菌群落相对丰度构建样品物种相对丰度柱状图见图 4。
-
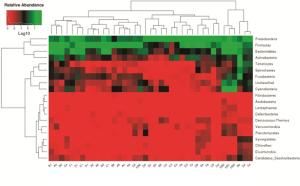
对ARDS病人不同时间点的BALF和GJ样品中的物种相对丰度进行聚类分析,构建样品物种聚类热图见图 5(横向聚类表示某物种在各样品丰度相似情况,纵向聚类表示所有物种在不同样品间表达的相似情况)。聚类结果显示:插管当日呼吸道与上消化道内菌群物种结构与第3~4天和7~9天有明显不同,而第3~4天和第7~9天肺内菌群物种构成较相似。ARDS病人随着气管插管时间延长肺内菌群变化主要表现为Proteobacteria相对丰度明显增加,Firmicutes相对丰度减少,其他菌群(如fusobacteria)也有少许变动。对比A亚组(n=7)与B亚组(n=6)内Proteobacteria(2.55% vs.21.16%,χ2=10.66,P < 0.05)发现病人肺内与上消化道内的Proteobacteria在插管初期差异有统计学意义,而对比C亚组(n=6)与D亚组(n=6)(47.71% vs.72.15%,χ2=2.57,P>0.05)及E亚组(n=5)与F亚组(n=5)(74.65% vs.85.72%,χ2=1.49,P>0.05)内Proteobacteria的相对丰度已无明显差异。可见随ARDS病人随插管延长,肺内与上消化道内的菌群结果相似性增加。
-
数以百亿的微生物存在于健康人体,即人体微生物群落,参与人体发育、免疫、营养和健康等各个方面, 包括呼吸系统在内的很多系统的疾病与人体微生物群落种类、结构的改变有关[7]。随着高通量测序技术进步,完整深入地鉴定呼吸系统菌群的种类和结构成为可能[8]。
ARDS发病率和死亡率高,是当今基础和临床研究的热点和难点[1]。其发病机制复杂,涉及炎症反应、细胞功能、血管损伤等方面。但是这些ARDS发病的“下游”机制研究并未取得突破性进展。而肺部微生物组在ARDS发生和发展中的作用逐渐得到关注[9]。
我们的研究共纳入ARDS病人7例及健康体检者4名。共计检测39个标本,其Shannon指数的稀释曲线反映标本质控良好、检测符合要求,其结果可相对准确反映标本细菌物种的多样性特征。
健康的下呼吸道由多种微生物其中包括潜在的致病菌组成动态的稳定的生态系统,健康人肺内的致病菌并不会致病。肺微生物群落维持肺部炎症反应和抗炎免疫之间的稳态。我们研究发现对照组肺部细菌群落在门水平主要为Firmicutes(38.6%)、Bacteroidetes(24.5%)、Cyanobacteria(20.9%)、Proteobacteria(10.5%)等17类,不但表明肺内有细菌,而且具有相当的物种多样性。之前有研究[4, 10-11]发现健康肺脏优势菌群主要为Firmicutes、Bacteroidetes、Proteobacteria等,我们的研究与这些研究结果基本一致。本组ARDS病人肺内在门水平菌群主要为Firmicutes(89.0%)、Bacteroidetes(7.7%)、Proteobacteria(2.6%)、Actinobacteria(0.5%)等14类。由此可见,ARDS组与对照组肺微生物组存在显著的差异性,ARDS发病初期肺Firmicutes相对丰度较健康人明显增加,从而导致其肺内菌群多样性明显下降。由于已有研究[9]表明呼吸道内细菌与ARDS病程进展密切有关,该类细菌是否参与ARDS病人早期炎症反应值得进一步关注[12]。
本研究中,随着气管插管和机械通气的进行,ARDS病人肺脏微生物组也随之发生一定程度的改变:Firmicutes丰度第3天即开始下降、而Proteobacteria则丰度迅速上升,我们同时也观察呼吸道菌种多样性下降。KELLY等[13]的研究发现,早期机械通气病人的上、下呼吸道菌群的多样性开始降低,并随着插管时间延长而进一步减少。细菌组学研究显示Actinobacteria、Bacteroidetes、Firmicutes、Proteobacteria等是口腔和胃肠道门水平的常驻菌[14-15],而健康人肺内微生物组主要来源于口咽部[11, 16]。通过对比,我们发现插管当日ARDS病人呼吸道标本与上消化道标本Proteobacteria存在显著的差异性,但随着住院时间延长呼吸道与上消化道Proteobacteria的相对丰度已无明显差异,这种呼吸道与上消化道微生物组逐渐趋同的现象尚未见类似报道。
ARDS病人肺微生物组的生长环境发生极大的改变,如肺水肿、肺内氧含量和温度梯度改变以及应激反应信号分子刺激作用,肺部转变为适合病原体生长的富营养状态。ARDS病人在接受治疗的过程中,气管内插管和丧失意识以致病人的呼吸与消化道动力学异常改变,将加剧体内菌群迁移[9]。在一项由脓毒症所导致的ARDS的研究[17]提示了消化道菌群对于维持肺部促症和抗炎之间的免疫稳态的重要作用。因此,ARDS病人的肺内微生物组这种改变与ARDS发展、以及肠道微生物组在其中的作用值得进一步探讨。
综上所述,ARDS病人肺内菌群多样性与健康人存在显著的差异性,主要表现为多样性减少、均衡性降低、某些细菌丰度增加等;随着气管插管时间延长,肺内以Proteobacteria为主的相对丰度明显增加,而这种变化与上消化菌群变化逐渐趋同。我们推测ARDS病人这种特殊的肺脏菌群的结构变化或可能引起微生物稳态改变或机体炎症反应,从而影响疾病的发生或进展。ARDS病人肺部菌群与疾病关联性,也提示其或许可以作为ARDS诊断、监测的生物标记物,甚至治疗的靶点,值得进一步关注和探索。本研究由于样本量较少、评价仍不够全面、仅在门水平进行笼统描述、缺乏大样本或多中心研究等。相信未来随着更多病人和健康人群纳入研究、获取更多相关数据,研究结果更具准确性、普遍性;并最终为ARDS的合理诊疗、降低病死率提供理论依据。
急性呼吸窘迫综合征病人呼吸道和上消化道微生物组的变化特征
Microbiome characteristics of the respiratory and upper gastrointestinal tract in patients with acute respiratory distress syndrome
-
摘要:
目的了解急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)病人肺内和消化道内菌群结构的动态变化特征。 方法收集7例ARDS病人的肺泡灌洗液(BALF)和上消化道液(GJ)以及4名健康志愿者(对照组)的BALF(HB)的标本。通过对标本中细菌16S rDNA进行高通量测序和生物信息学分析,了解各组标本细菌群落的构成、演变及关联性。 结果ARDS病人肺内厚壁菌门细菌(Firmicutes)丰度显著增加,占全部细菌88.99%,对照组为38.56.%,差异有统计学意义(P < 0.05);而拟杆菌门细菌(Bacteroidetes)分布明显下降,占7.69%,对照组为24.50%,差异有统计学意义(P < 0.05);变形菌门细菌(Proteobacteria)也较对照组明显下降(2.55% vs.10.54%,P < 0.05)。但随着插管时间延长,ARDS病人肺内菌群中变形菌门细菌相对丰度由2.55%增加至74.65%、厚壁菌门细菌相对丰度则由88.99%降至9.81%。ARDS病人上消化道内菌群在插管期间亦有变化,但是在门水平改变并无统计学意义,仅Acinetobacter属(0.53% vs.53.70%,P < 0.05)相对丰度增加。 结论ARDS病人肺内菌群多样性发生改变,且与消化菌群变化有趋同现象,提示其或参与ARDS发生发展,也提示其可能作为ARDS诊断、监测生物标记物的潜在价值。 -
关键词:
- 急性呼吸窘迫综合征 /
- 微生物组 /
- 细菌16S rDNA /
- 机械通气
Abstract:ObjectiveTo investigate the dynamic characteristics of microbiota in the respiratory and upper gastrointestinal tract in patients with acute respiratory distress syndrome (ARDS). MethodsThe bronchoalveolar lavage fluid (BALF) and gastric juice (GJ) from 7 ARDS patients and BALF from 4 healthy volunteers were collected.The gene sequences of bacterial 16S rDNA in all samples were obtained via high-throughput sequencing, and its bio-informatics was analyzed to understand the composition, evolution and correlation of microbiota. ResultsThe abundance of phylum Firmicutes (88.99%) significantly increased in the lung microbiota of ARDS patients compared with the healthy subjects (38.56%), and the difference of which was statistically significant (P < 0.05).The abundance of phylum Bacteroidetes in ARDS patients (7.69%) significantly decreased, and the difference of which between ARDS patients and healthy subjects (24.50%) was statistically significant (P < 0.05).The abundance of phylum Proteobacteria in ARDS patients (2.55%) significantly decreased compared with the control group (10.54%) (P < 0.05).With the intubation time prolonging, the relative abundance of phylum Proteobacteria in lung microbiota of ARDS patients increased from 2.55% to 74.65%, and the relative abundance of phylum Firmicutes decreased from 88.99% to 9.81%.The change of microbiota of upper gastrointestinal tract of ARDS patients was found during intubation, which was not statistically significant (P>0.05), and the relative abundance of phylum Acinetobacter significantly increased in the genus level (0.53% vs 53.70%, P < 0.05). ConclusionsThe microbiota diversity in respiratory tract changes, and has similarity with that of the upper gastrointestinal tract in patients with ARDS.The microbiota of the respiratory tract may involve in the onset and progress of ARDS, which can serve as a possible biomarker in the diagnosis and prognosis of ARDS. -
Key words:
- acute respiratory distress syndrome /
- microbiome /
- 16S rDNA /
- mechanical ventilation
-
表 1 ARDS病人的临床信息
病人 年龄/岁 性别 吸烟与否 酗酒与否 既往史 ARDS诱因 ARDS程度 28 d生存情况 细菌培养 病人1 53 男 是 是 无 重症肺炎 重度 生存 培养阴性 病人2 39 男 否 否 无 重症肺炎 轻度 死亡 培养阴性 病人3 68 女 否 否 左侧输尿管结石 脓毒症、多器官功能障碍、左肾盂脓肿 中度 生存 大肠埃希菌 病人4 65 女 否 否 冠心病、高血压3级 重症肺炎 中度 生存 培养阴性 病人5 84 女 否 否 冠心病、腰椎压缩性骨折 重症肺炎 重度 死亡 培养阴性 病人6 48 女 否 否 2型糖尿病 重症肺炎 中度 生存 洋葱伯克霍尔德菌 病人8 73 男 是 否 冠心病、高血压3级 重症肺炎 中度 生存 棒状杆菌、乙酸钙不动杆菌 表 2 3组标本Simpson指数比较结果(x±s)
分组 n Simpson指数 F P MS组内 对照组 4 0.14±0.07 ARDS病人呼吸道组 18 0.45±0.31 2.16 >0.05 0.086 ARDS病人上消化道组 17 0.47±0.30 -
[1] BELLANI G, LAFFEY JG, PHAM T, et al.Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J].JAMA, 2016, 315(8):788. doi: 10.1001/jama.2016.0291 [2] HUANG YJ, KIM E, COX MJ, et al.A persistent and diverse airway microbiota present during chronic obstructive pulmonary disease exacerbations[J].OMICS, 2010, 14(1):9. doi: 10.1089/omi.2009.0100 [3] TARI H, STEPHEN H, RUBY P, et al.The biodiversity hypothesis and allergic disease:world allergy organization position statement[J].World Allergy Organization J, 2013, 6(1):3. [4] HILTY M, BURKE C, PEDRO H, et al.Disordered microbial communities in asthmatic airways[J].PLoS One, 2010, 5(1):e8578. doi: 10.1371/journal.pone.0008578 [5] RANIERI VM, RUBENFELD GD, THOMPSON BT, et al.Acute respiratory distress syndrome:the Berlin Definition[J].JAMA, 2012, 307(23):2526. [6] SAMBROOK J, RESSEL DW.Molecular Cloning:A Laboratory Manual.3rd.[M].New York:Cold Spring Harbor Laboratory Press, 2001:4. [7] DONIA MS, FISCHBACH MA, HUMAN MICROBIOTA.Small molecules from the human microbiota[J].Science, 2015, 349(6246):1254766. doi: 10.1126/science.1254766 [8] WEINSTOCK GM.Genomic approaches to studying the human microbiota[J].Nature, 2012, 489(7415):250. doi: 10.1038/nature11553 [9] DICKSON RP.The microbiome and critical illness[J].Lancet Respir, Med, 2016, 4(1):59. doi: 10.1016/S2213-2600(15)00427-0 [10] MORRIS A, BECK JM, SCHLOSS PD, et al.Comparison of the respiratory microbiome in healthy nonsmokers and smokers[J].Am J Respir Crit Care Med, 2013, 187(10):1067. doi: 10.1164/rccm.201210-1913OC [11] SEGAL LN, ALEKSEYENKO AV, CLEMENTE JC, et al.Enrichment of lung microbiome with supraglottic taxa is associated with increased pulmonary inflammation[J].Microbiome, 2013, 1(1):19. doi: 10.1186/2049-2618-1-19 [12] BUTTENSCHOEN K, KORNMANN M, BERGER D, et al.Endotoxemia and endotoxin tolerance in patients with ARDS[J].Langenbecks Arch Surg, 2008, 393(4):473. doi: 10.1007/s00423-008-0317-3 [13] BRENDAN JK, ⅡE L, KYLE B, et al.Composition and dynamics of the repiratory tract microbiome in intubated patients[J].Microbiome, 2016, 4:7. doi: 10.1186/s40168-016-0151-8 [14] CHEN T, YU WH, IZARD J, et al.The Human Oral Microbiome Database:a web accessible resource for investigating oral microbe taxonomic and genomic information[J].Database(Oxford), 2010, 2010:baq013. [15] LEY RE, PETERSON DA, GORDON JI.Ecological and evolutionary forces shaping microbial diversity in the human intestine[J].Cell, 2006, 124(4):837. doi: 10.1016/j.cell.2006.02.017 [16] DICKSON RP, ERB-DOWNWARD JR, FREEMAN CM, et al.Spatial variation in the healthy human lung microbiome and the adapted island model of lung biogeography[J].Ann Am Thorac Soc, 2015, 12(6):821. doi: 10.1513/AnnalsATS.201501-029OC [17] DICKSON RP, SINGER BH, NEWSTEAD MW, et al.Enrichment of the lung microbiome with gut bacteria in sepsis and the acute respiratory distress syndrome[J].Nature Microbiol, 2016, 1(10):16113. doi: 10.1038/nmicrobiol.2016.113 -





 下载:
下载: