-
结直肠癌(colorectal cancer,CRC)具有高发病率及死亡率的特点[1]。目前,结直肠癌的治疗以手术治疗为主,结合化疗、放疗等综合治疗。但对于广泛肝转移的结直肠癌治疗效果仍然有限,并成为病人的主要死亡原因[2]。因此,亟需找到结直肠癌新的治疗方法,提高结直肠癌病人的早期诊断率和生存率。通过人类基因组的大规模测序及高通量转录分析发现,人体内蛋白编码基因仅占约20 000种,其余绝大部分的基因对应的产物为非编码RNA[3]。这些非编码RNA根据分子量大小又可以分为短链非编码RNA及长链非编码RNA(long non-coding RNA, LncRNA),LncRNA是指一类转录本长度>200个核苷酸且不能翻译成蛋白质的RNA分子,曾一度被认为是无意义的转录而未受到重视[4]。LncRNA具有高度保守的序列元件,亚细胞定位于细胞核内或细胞质中,近期研究[5]显示,LncRNA通过与蛋白质、DNA、RNA相互作用,在转录、转录后、表观遗传等多个水平调控基因的表达。LOEWER等[6]在2010年报道了一种能调节已经分化的细胞转换为多能诱导干细胞重编程过程的LncRNA,并将这该RNA命名为LncRNA-ROR(LncRNA regulator of reprogramming,ROR)。后期研究[7-8]发现,ROR不仅能调控细胞的重编程过程,其在多种肿瘤细胞的增殖、侵袭、迁移、凋亡中发挥重要作用并与病人预后密切相关。目前,ROR在结直肠癌中的研究甚少,其在结直肠癌中的表达情况及所发挥的作用尚鲜见报道。本研究拟采用qRT-PCR检测ROR在结直肠癌组织中的表达情况,并通过增殖功能实验初步探索ROR在结直肠癌细胞增殖中的作用。
-
结直肠癌细胞SW620由安徽医科大学基础医学院实验室馈赠,40例结直肠癌组织及相应正常组织(距肿瘤切缘5cm以外)取自安徽医科大学第一附属医院2016年的结直肠癌手术病人,其中男28例,女12例,年龄24~80岁;依据AJCC肿瘤分期标准行术后TNM分期:Ⅰ期6例,Ⅱ期15例,Ⅲ期16例,Ⅳ期3例;淋巴结转移病人17例,无淋巴结转移病人23例。浸润深度T1 2例,T2 8例,T3 18例,T4 12例。纳入标准:(1)所有病人术前未进行化疗、放疗及免疫治疗;(2)术后均经病理学确诊为结直肠癌;(3)病人知情同意将标本用于科研。排除标准:(1)自身免疫性疾病病人;(2)感染性疾病病人。ROR、GAPDH引物由上海生工生物工程有限公司设计并合成;委托上海生工生物工程有限公司构建ROR过表达的慢病毒转染体系,CCK-8试剂盒购自南京凯基生物;qRT-PCR试剂盒购自TaKaRa试剂公司。ROR表达水平的分组依据为ROR表达水平的中位数。
-
结直肠癌细胞SW620用含10%FBS的1640培养基,置于5%CO2、37 ℃培养箱中常规传代培养,选对数生长期的细胞,将合成的含ROR的慢病毒滴入培养液中,24 h后换液,qRT-PCR检测转染效果,获得稳转细胞株后行后续实验。
-
按照TrizolRNA提取试剂盒说明提取总RNA后,按照TaKaRa试剂盒说明将RNA反转录成cDNA,ROR引物为:F:5′-CCA GGA CAA TGA AAC CAC-3′,R:5′-AGG AGC CCA AAG TAA CAG-3′,GAPDH引物为:F:GGA GCG AGA TCC CTC CAA AAT,R:GGC TGT TGT CAT ACT TCT CAT GG。以上引物通过Primer Bank在线数据库获得并通过验证。PCR反应的条件为:94℃预变性5min;94℃变性40 s,45 ℃退火40 s,72 ℃延伸60 s,从变性到延伸共做35个循环。采用2-ΔΔCt法计算ROR的相对表达量。
-
取对数生长期的细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,将细胞悬浮在1640培养液中取100 μL铺于96孔板中,设复孔3个,每孔加入10 μLCCK-8试剂,放入细胞培养箱孵育,分别在0 h、24 h、48 h、72 h、96 h时间点用酶标仪检测每个孔中450 nm处吸光度值,并根据测定结果绘制细胞增殖曲线。
-
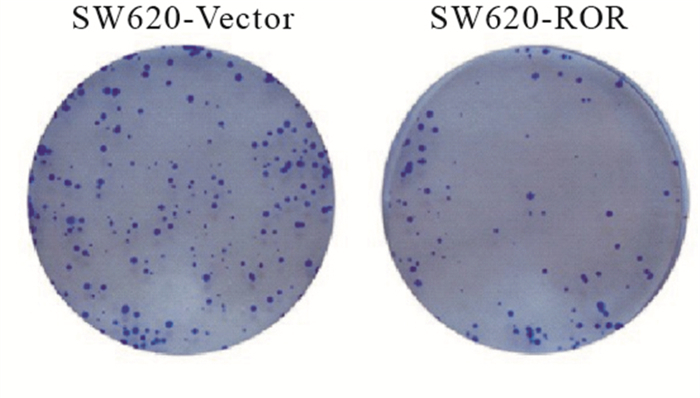
取对数生长期的各组细胞,用胰蛋白酶消化后用1640培养液悬浮,每组细胞分别以每皿1 000个细胞的密度接种在含10 mL 37 ℃预温培养液的皿中,摇晃使细胞分散均匀。5%CO2、37 ℃培养箱中培养2周。弃去上清液,用PBS洗2次,4%多聚甲醛固定15 min。用GIMSA染色30 min,漂洗3次后拍照。
-
采用t检验和χ2检验。
-
通过qRT-PCR检测40例结直肠癌病人的肿瘤组织及其配对正常组织标本中ROR的表达水平显示,结直肠癌组织中ROR的表达水平明显低于配对的正常组织水平(P<0.01)(见表 1)。
分组 n ROR的RNA相对表达量 t P 正常组织 40 1.12±0.41 9.01 <0.01 癌组织 40 0.47±0.20 表 1 ROR在结直肠癌与在正常组织中的表达情况比较($\overline x \pm s$)
-
研究显示,ROR的表达水平与结直肠癌的TNM分期具有相关性(P<0.05),而与病人性别、年龄、肿瘤大小、淋巴结转移无明显相关(P>0.05)(见表 2)。
变量 n ROR表达情况 χ2 P 高 低 性别 男 31 10 21 0.46 >0.05 女 9 4 5 年龄/岁 ≥65 28 11 17 0.75 >0.05 < 65 12 3 9 肿瘤大小/cm ≥5 21 5 16 2.43 >0.05 < 5 19 9 10 淋巴结转移 阴性 23 6 17 1.89 >0.05 阳性 17 8 9 TNM分期 Ⅰ+Ⅱ 21 11 10 5.87 <0.05 Ⅲ+Ⅳ 19 3 16 表 2 ROR表达情况与病人临床病理因素的关系
-
利用基因过表达技术,在结直肠癌细胞系SW620中转染构建好的LV5-ROR及空载的LV5-NC慢病毒,qRT-PCR技术检测转染后细胞中ROR的表达量。与对照组比较,转染SW620细胞系中的ROR表达量明显增高,过表达效果满意,2组之间差异有统计学意义(P<0.01)(见表 3)。
分组 n ROR的表达量 t P SW620-Vector 3 1.34±0.23 -7.19 <0.01 SW620-ROR 3 12.5±2.68 表 3 经转染筛选后ROR在结直肠癌细胞SW620中的表达情况($\overline x \pm s$)
-
CCK-8实验显示:SW620-ROR细胞在第2天增殖能力降低,随着时间的推移,差距进一步明显,与对照组比较,差异具有统计学意义(P<0.01)(见表 4)。平板克隆实验结果表明:过表达ROR后,结直肠癌细胞的增殖能力减弱,与对照组比较,差异有统计学意义(P<0.01)(见表 5、见图 1)。
分组 n 第0天 第1天 第2天 第3天 第4天 SW620-Vector 3 0.38±0.03 0.43±0.05 0.53±0.08 0.81±0.09 1.20±0.11 SW620-ROR 3 0.39±0.04 0.41±0.07 0.46±0.08 0.61±0.07 0.82±0.08 t — -0.35 0.40 1.07 3.04 4.84 P — >0.05 >0.05 >0.05 <0.05 <0.01 表 4 CCK-8实验显示SW620-Vector与SW620-ROR的细胞增殖能力(OD450)的比较($\overline x \pm s$)
分组 n 克隆数 t P SW620-Vector 3 266.00±29.33 10.39 <0.01 SW620-ROR 3 63.67±16.67 表 5 平板克隆实验显示SW620-Vector与SW620-ROR细胞形成的克隆数比较
-
人类基因组测序显示,人类基因组的98%以上为非编码序列,LncRNA占其中绝大多数[9]。随着大量非编码RNA的发现,人们的研究焦点逐渐从编码RNA转移到非编码RNA。近年来越来越多研究显示,LncRNA是一类基因表达调控元件,能在基因转录、转录后、表观遗传等方面调控基因表达[10-11],且异常表达的LncRNA与代谢性疾病、神经退行性疾病、自身免疫疾病等密切相关[12-13]。随着研究的深入,LncRNA与肿瘤的发生、发展、凋亡等生物学行为上的作用逐渐被发现。ROR位于人类第18号染色体,全长为2.6 kb,由4个外显子组成,主要存在于胚胎干细胞和多能诱导干细胞中,亚细胞定位于细胞核及细胞质。在体内,ROR主要通过调控转录因子的表达来维持胚胎干细胞自我更新性和多能性;研究人员发现在氧化应激、DNA损伤等刺激下,ROR与p53、转录因子Nrf2之间存在调控机制[14-15]。研究表明,ROR参与调节细胞生长发育、分化、代谢等多种生物学行为,在癌症进程中发挥着抑癌基因或癌基因等不同生物学特性[16],在胰腺癌[17]、肝癌[18]、乳腺癌[19]、膀胱癌[20]组织或细胞系中高表达,而在胶质瘤组织及细胞系中表达较低[21]。HOU等[19]研究发现,ROR的表达与乳腺癌病情有关,沉默ROR可抑制乳腺肿瘤的生长和癌细胞转移,并通过对miR-205、miR-145的调控影响细胞的分化、凋亡、侵袭、转移等过程,ROR通过调控上皮间变促进乳腺癌的转移。在肝癌化疗中,ROR作为信号介质可以减轻化疗药对细胞的损伤作用[18, 22]。TAKAHASHI等[18]研究表明,ROR作为低氧响应因子在恶性肝癌细胞中表达明显增加,ROR基因沉默后,HIF-1α和其反应蛋白表达量降低,而且在低氧环境下作用会更加明显,在低氧环境中ROR能够通过调节HIF-1α及其下游基因来调控肝癌细胞的生长增殖。在鼻咽癌中,LI等[23]研究表明DNA损伤直接促进p53蛋白表达量增加,增加的p53能够促进ROR转录,增加的ROR从细胞核进入细胞质,抑制p53 mRNA的转录。这样ROR与p53形成了负反馈调节回路。ROR通过抑制p53的信号通路引起癌细胞的耐药。FENG等[21]报道在胶质瘤细胞中ROR的上调导致胶质瘤细胞增殖能力下降,ROR的干扰引起胶质瘤细胞中的KLF4 mRNA表达增加,最终引起胶质瘤细胞的增殖及侵袭转移。ROR通过上调E盒结合锌指蛋白调控细胞的上皮间变,从而促进胰腺癌细胞的侵袭和转移[17]。ROR在不同器官中扮演不同甚至截然相反的角色,我们推测可能与组织器官的特异性有关,具体机制有待进一步研究。
本研究中发现,40例结直肠癌及其配对正常组织中,ROR在结直肠癌中的表达量明显低于正常组织,发现及证实了ROR与结直肠癌的负相关关系;此外,通过对ROR表达与病人临床病理资料的相关性分析,发现低表达的ROR与结直肠癌的TNM分期相关,与病人性别、年龄、淋巴结及远处转移无明显关系。我们将在后续工作中完善病人随访资料,对ROR行生存分析。进一步,利用基因过表达技术,采用慢病毒转染的方法研究过表达ROR后对结直肠癌细胞生物学行为产生的影响,结果显示, 通过慢病毒转染,有效实现了ROR在结直肠癌细胞系SW620中的稳定过表达。过表达ROR后结直肠癌细胞SW620的增殖能力明显降低。本研究初步探索了ROR在结直肠癌中的表达及作用,为结直肠癌的早期诊断及预后提供有力的指导作用。结合上述文献报告,我们将在下一步的研究中进一步探讨ROR是否影响结直肠癌的转移、凋亡等其他生物学行为。ROR作为早期肠癌的一个新型分子标志物,其临床价值值得进一步探索。
长链非编码RNA-ROR对结直肠癌SW620细胞增殖的影响
Effect of LncRNA-ROR on the proliferation of colorectal cancer SW620 cells
-
摘要:
目的了解长链非编码RNA-ROR(LncRNA-ROR)在结直肠癌SW620细胞增殖中的作用。 方法选择40例结直肠癌组织及相应正常组织(距肿瘤切缘5cm以外),首先采用qRT-PCR技术检测LncRNA-ROR在结直肠癌组织中的表达情况,并分析其表达与病人临床病理因素的相关性。构建慢病毒载体LV5-ROR、LV5-Vector转染到结直肠癌细胞SW620中,验证LncRNA-ROR的表达,分析LncRNA-ROR过表达对结直肠癌细胞CCK-8功能及SW620平板克隆形成的影响。 结果与正常组织比较,LncRNA-ROR在结直肠癌组织中低表达(P < 0.01),其表达水平与TNM分期具有相关性(P < 0.05)。经转染筛选后,qRT-PCR检测证实SW620中的LncRNA-ROR表达增加,其高表达导致SW620增殖能力的下降(P < 0.01)。 结论LncRNA-ROR的过表达抑制了结直肠癌细胞SW620的增殖。 -
关键词:
- 结直肠肿瘤 /
- LncRNA-ROR /
- SW620细胞 /
- 增殖
Abstract:ObjectiveTo investigate the effects of long non-coding RNA-ROR(LncRNA-ROR) on the proliferation of colorectal cancer SW620 cells. MethodsThe expression level of LncRNA-ROR in colorectal cancer tissue was detected using qRT-PCR, and the relationship between the expression level of LncRNA-ROR and clinicopathological data was analyzed.The lentiviral vector LV5-ROR was constructed, and transfected into the colorectal cancer SW620 cells and verified.The effects of LncRNA-ROR overexpression on the function and colony formation of SW620 cells were analyzed. ResultsCompared with the normal tissue, the expression level of LncRNA-ROR was low in colorectal cancer tissue(P < 0.01), and its expression level was closely related to TNM stage(P < 0.05).After transfection, the expression level of LncRNA-ROR increasing in SW620 cells was identified by qRT-PCR, and its high expression led to the decreasing of proliferation function of SW620 cells(P < 0.01). ConclusionsThe overexpression of LncRNA-ROR can inhibit the proliferation of SW620 cells. -
Key words:
- colorectal neoplasms /
- long non-coding RNA-ROR /
- SW620 cells /
- proliferation
-
表 1 ROR在结直肠癌与在正常组织中的表达情况比较(
$\overline x \pm s$ 分组 n ROR的RNA相对表达量 t P 正常组织 40 1.12±0.41 9.01 <0.01 癌组织 40 0.47±0.20 表 2 ROR表达情况与病人临床病理因素的关系
变量 n ROR表达情况 χ2 P 高 低 性别 男 31 10 21 0.46 >0.05 女 9 4 5 年龄/岁 ≥65 28 11 17 0.75 >0.05 < 65 12 3 9 肿瘤大小/cm ≥5 21 5 16 2.43 >0.05 < 5 19 9 10 淋巴结转移 阴性 23 6 17 1.89 >0.05 阳性 17 8 9 TNM分期 Ⅰ+Ⅱ 21 11 10 5.87 <0.05 Ⅲ+Ⅳ 19 3 16 表 3 经转染筛选后ROR在结直肠癌细胞SW620中的表达情况(
$\overline x \pm s$ 分组 n ROR的表达量 t P SW620-Vector 3 1.34±0.23 -7.19 <0.01 SW620-ROR 3 12.5±2.68 表 4 CCK-8实验显示SW620-Vector与SW620-ROR的细胞增殖能力(OD450)的比较(
$\overline x \pm s$ 分组 n 第0天 第1天 第2天 第3天 第4天 SW620-Vector 3 0.38±0.03 0.43±0.05 0.53±0.08 0.81±0.09 1.20±0.11 SW620-ROR 3 0.39±0.04 0.41±0.07 0.46±0.08 0.61±0.07 0.82±0.08 t — -0.35 0.40 1.07 3.04 4.84 P — >0.05 >0.05 >0.05 <0.05 <0.01 表 5 平板克隆实验显示SW620-Vector与SW620-ROR细胞形成的克隆数比较
分组 n 克隆数 t P SW620-Vector 3 266.00±29.33 10.39 <0.01 SW620-ROR 3 63.67±16.67 -
[1] SIEGEL R, DESANTIS C, JEMAL A.Colorectal cancer statistics, 2014[J].CA Cancer J Clin, 2014, 64(2):104. doi: 10.3322/caac.21220 [2] CHEN WQ, LI H, SUN KX, et al.Report of Cancer Incidence and Mortality in China, 2014[J].Zhonghua Zhong Liu Za Zhi, 2018, 40(1):5. [3] STEIN LD.Human genome:end of the beginning[J].Nature, 2004, 431(7011):915. doi: 10.1038/431915a [4] WANG KC, CHANG HY.Molecular mechanisms of long noncoding RNAs[J].Molecular Cell, 2011, 43(6):904. doi: 10.1016/j.molcel.2011.08.018 [5] HAUPTMAN N, GLAVAČ D.Long non-coding RNA in cancer[J].Int J Mol Sci, 2013, 14(3):4655. doi: 10.3390/ijms14034655 [6] LOEWER S, CABILI MN, GUTTMAN M, et al.Large intergenic non-coding RNA-RoR modulates reprogramming of human induced pluripotent stem cells[J].Nat Genet, 2010, 42(12):1113. doi: 10.1038/ng.710 [7] YUAN JH, YANG F, WANG F, et al.A long noncoding RNA activated by TGF-β promotes the invasion-metastasis cascade in hepatocellular carcinoma[J].Cancer Cell, 2014, 25:666. doi: 10.1016/j.ccr.2014.03.010 [8] YANG QQ, DENG YF.Long non-coding RNAs as novel biomarkers and therapeutic targets in head and neck cancers[J].Int J Clin Exp Pathol, 2014, 7(4):1286. [9] HUNG T, CHANG HY.Long noncoding RNA in genome regulation:prospects and mechanisms[J].RNA Biol, 2010, 7(5):582. doi: 10.4161/rna.7.5.13216 [10] GUTSCHNER T, DIEDERICHS S.The hallmarks of cancer:a long non-coding RNA point of view[J].RNA Biol, 2012, 9(6):703. doi: 10.4161/rna.20481 [11] GUTTMAN M, RINN JL.Modular regulatory principles of large non-coding RNAs[J].Nature, 2012, 482(7385):339. doi: 10.1038/nature10887 [12] WAPINSKI O, CHANG HY.Long noncoding RNAs and human disease[J].Trends Cell Biol, 2011, 21(6):354. doi: 10.1016/j.tcb.2011.04.001 [13] GIBB EA, BROWN CJ, LAM WL.The functional role of long non-coding RNA in human carcinomas[J].Mol Cancer, 2011, 10(1):38. [14] ZHANG A, ZHOU N, HUANG J, et al.The human long non-coding RNA-RoR is a p53 repressor in response to DNA damage[J].Cell Res, 2013, 23(3):340. doi: 10.1038/cr.2012.164 [15] ZHANG Y, XIA J, LI Q, et al.NRF2/long noncoding RNA ROR signaling regulates mammary stem cell expansion and protects against estrogen genotoxicity[J].J Biol Chem, 2014, 289(45):31310. doi: 10.1074/jbc.M114.604868 [16] REZAEI M, EMADI-BAYGI M, HOFFMANN MJ, et al.Altered expression of LINC-ROR in cancer cell lines and tissues[J].Tumour Biol, 2016, 37(2):1763. [17] ZHAN HX, WANG Y, LI C, et al.LincRNA-ROR promotes invasion, metastasis and tumor growth in pancreatic cancer through activating ZEB1 pathway[J].Cancer Lett, 2016, 374(2):261. [18] TAKAHASHI K, YAN IK, HAGA H, PATEL T.Modulation of hypoxia-signaling pathways by extracellular linc-RoR[J].J Cell Sci, 2014, 127(7):1585. doi: 10.1242/jcs.141069 [19] HOU P, ZHAO Y, LI Z, et al.LincRNA-ROR induces epithelial-to-mesenchymal transition and contributes to breast cancer tumorigenesis and metastasis[J].Cell Death Dis, 2014, 5(6):e1287. doi: 10.1038/cddis.2014.249 [20] BERRONDO C, FLAX J, KUCHEROV V, et al.Expression of the long non-coding RNA hotair correlates with disease progression in bladder cancer and is contained in bladder cancer patient urinary exosomes[J].PloS One, 2016, 11(1):e0147236. doi: 10.1371/journal.pone.0147236 [21] FENG S, YAO J, CHEN Y, et al.Expression and functional role of reprogramming-related long noncoding RNA (lincRNA-ROR) in glioma[J].J Mol Neurosci, 2015, 56(3):623. doi: 10.1007/s12031-014-0488-z [22] TAKAHASHI K, YAN IK, KOGURE T, HAGA H, PATEL T.Extracellular vesicle-mediated transfer of long non-coding RNA ROR modulates chemosensitivity in human hepatocellular cancer[J].FEBS Open Bio, 2014, 4:458. doi: 10.1016/j.fob.2014.04.007 [23] LI L, GU M, YOU B, et al.Long non-coding RNA ROR promotes proliferation, migration and chemoresistance of nasopharyngeal carcinoma[J].Cancer Sci, 2016, 107(9):1215. doi: 10.1111/cas.12989 -




 下载:
下载: