-
糖尿病是以机体持续高血糖为主要特征的代谢性疾病[1]。长期的高血糖,会导致各种器官组织,特别是神经、肾、心血管等的慢性损害及功能障碍。糖尿病引起的认知功能障碍也是其慢性损害之一,主要表现为学习能力下降、记忆功能减退、空间定向困难等[2]。目前,关于糖尿病认知功能障碍的发病机制尚不清楚,糖代谢紊乱、氧化应激、炎症反应等均参与其中[3]。硫化氢(hydrogen sulfide,H2S)是新型气体信号分子,具有抗炎症、抗氧化等作用[4-6]。内源性H2S主要以L-半胱氨酸为底物,在胱硫醚-β-合成酶(cystathionine-β-synthetase,CBS)和胱硫醚-γ-裂解酶的催化作用下产生。其中CBS主要存在于神经系统,且在海马组织中高度表达[7]。研究证据[8]显示H2S在中枢神经系统中发挥着关键性的调节作用。硫氢化钠(sodium hydrosulfide,NaHS)常作为H2S的外源性供体。研究[9]发现,外源性H2S对糖尿病引起的抑郁症具有一定的抑制作用,但是对糖尿病大鼠认知障碍影响及作用机制尚不清楚。因此,本研究通过建立糖尿病大鼠模型,观察外源性H2S对糖尿病大鼠空间学习记忆的影响,并探讨其作用机制。
-
雄性SD大鼠32只购于蚌埠医学院实验动物中心,体质量160~200 g,自由饮食、饮水。链脲佐菌素(steptozotocin,STZ)和NaHS购自Sigma公司;总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒均购自南京建成生物工程研究所;RNA提取试剂TRIzol购自Invitrogen公司;逆转录试剂盒和实时荧光定量聚合酶链式反应(real time-quantitative polymerase chain reaction,RT-qPCR)试剂盒购自大连宝生物公司;核因子E2相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)、血红素氧化酶1(heme oxygenase-1,HO-1)和β-actin的引物序列由上海生工生物工程股份有限公司合成,Nrf2引物序列:5′-TAG ATG ACC ATG AGT CGC TTG C-3′ (正向),5′-GCC AAA CTT GCT CCA TGT CC-3′(反向),扩增产物长度151 bp;HO-1引物序列:5′-GTG CAG AGA ATT CTG AGT TCA-3′(正向),5′-GCC GTA TAG ATA TGG TAC AAG-3′(反向),扩增产物长度100 bp;β-actin引物序列:5′-CGT AAA GAC CTC TAT GCC AAC A-3′(正向),5′-AGC CAC CAA TCC ACA CAG AG-3′(反向),扩增产物长度163 bp。
-
所有大鼠适应性饲养1周后,进行水迷宫训练2次,选择认知能力正常的大鼠为实验大鼠,随机分为正常组和糖尿病组(STZ)。大鼠禁食12 h后,STZ组一次性腹腔注射STZ 55 mg/kg(溶于新鲜配制的pH 4.5的柠檬酸溶液中),正常组大鼠腹腔注射等体积柠檬酸溶液。3 d后,尾静脉采血测空腹血糖(fasting blood glucose,FBG),取FBG≥ 16.7 mmol/L为1型糖尿病模型。模型建立成功4周后,将STZ组大鼠随机分为糖尿病对照(STZ)组和STZ+NaHS(SH)组,正常组大鼠随机分为正常对照(CON)组和CON+NaHS(CH)组,每组均8只。SH组和CH组大鼠每天腹腔注射56 μmol/kg NaHS(溶于0.9%氯化钠溶液中,现配现用);CON组和STZ组大鼠每天腹腔注射等体积0.9%氯化钠溶液,共干预4周。每周监测大鼠FBG和体质量(body weight,BW)。
-
从NaHS干预第4周的第3天上午9:00开始,进行水迷宫实验。训练时,先将大鼠放置在平台上适应30 s,然后以非平台象限为起始点,将大鼠头部朝向水池壁轻放入水中,摄像头连续记录90 s内找到平台的所需时间作为逃避潜伏期。若在90 s内大鼠仍未找到平台,则将其引导至平台上休息30 s后移出水池,将时间记为90 s。每天随机排序3个非平台象限,以每个非平台象限作为起始点,记录3次时间并计算平均值。连续训练5 d后,于第6天撤去平台。将大鼠从原先固定平台的对侧象限放入。摄像仪记录其在120 s内在水池中的路径,分析大鼠在正确象限停留时间和到达正确象限的潜伏期。
-
大鼠Morris水迷宫测试结束后半小时,将大鼠放入密闭容器内,充入异氟烷麻醉后,断头取全脑组织,用预冷的0.9%氯化钠溶液清洗,滤纸吸干水分。用直镊将两侧的大脑皮层拨开,暴露出双侧的海马组织,再将海马组织与大脑皮层及周围的脑组织分开(1~1.5 g),取左侧的海马组织,用4%多聚甲醛溶液固定,脱水、石蜡包埋后切片,进行HE染色。
-
取各组大鼠海马组织,加入9倍体积的0.9%氯化钠溶液,制备海马组织匀浆,离心后取上清,利用BCA蛋白定量试剂盒测定蛋白浓度,分别按相应试剂盒说明书方法检测T-AOC、SOD、GSH-Px和MDA水平。
-
采用TRIzol试剂提取海马组织总RNA,逆转录成cDNA后,利用RT-qPCR试剂盒扩增Nrf2、HO-1和β-actin基因。扩增条件:95 ℃预变性3 min后,以95 ℃变性30 s,55 ℃ 30 s,72 ℃ 50 s,反应35个循环,最后72 ℃延伸8 min,以β-actin作为内参,按2-ΔΔCt计算相对表达量。
-
采用方差分析和q检验。
-
与CON组比较,STZ组和SH组大鼠FBG增加(P < 0.01),BW降低(P < 0.01)。与STZ组比较,SH组中FBG差异无统计学意义(P>0.05),BW增高(P < 0.01)。CON组和CH组FBG和BW水平差异无统计学意义(P>0.05)(见表 1)。
分组 n FBG/ (mmol/L) BW/g CON组 8 5.38±0.72 452.14±28.49 STZ组 8 23.46±2.15** 218.58±22.80** SH组 8 21.95±2.08** 246.61±24.52**## CH组 8 5.56±0.64##△△ 443.72±29.26##△△ F — 322.05 178.99 P — < 0.01 < 0.01 MS组内 — 2.469 697.225 q检验:与CON组比较**P < 0.01;与STZ组比较##P < 0.01;与SH组比较△△P < 0.01 表 1 各组大鼠FBG和BW水平比较(x±s)
-
与CON组大鼠比较,STZ组和SH组大鼠第3~5天的逃避潜伏期延长,且在第6天的空间探索实验中在正确象限停留时间减少,到达正确象限的潜伏期延长,差异均有统计学意义(P < 0.01)。与STZ组比较,SH组大鼠第3~5天的逃避潜伏期缩短,且在第6天的空间探索实验中在正确象限停留时间延长,到达正确象限的潜伏期缩短,差异均有统计学意义(P < 0.05~P < 0.01)。CH组与CON组比较差异无统计学意义(P>0.05)(见表 2)。
分组 逃避潜伏期/s 正确象限
停留时间/s到达正确象限的
潜伏期/s第1天 第2天 第3天 第4天 第5天 CON组 69.59±5.62 62.04±4.96 44.35±3.87 27.62±2.79 20.43±2.05 48.52±3.24 9.65±1.27 STZ组 74.52±5.21 68.35±4.89 64.01±4.50** 55.22±5.68** 52.17±4.13** 28.13±2.86** 22.64±2.38** SH组 75.47±5.17 66.72±4.83 57.61±4.75**# 43.62±4.19**# 37.50±4.36**# 39.58±3.11**# 15.27±1.46**# CH组 70.05±5.73 63.22±5.38 46.79±4.64##△△ 27.33±3.75##△△ 22.13±3.41##△△ 49.27±3.38##△△ 9.28±1.34##△△ F 2.47 2.76 34.39 81.70 136.50 78.32 111.70 P > 0.05 > 0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 29.570 25.200 19.830 17.920 12.970 9.943 2.801 q检验:与CON组比较**P < 0.01;与STZ组比较#P < 0.05,##P < 0.01;与SH组比较△△P < 0.01 表 2 各组大鼠Morris水迷宫行为学测试结果比较(x±s;ni=8)
-
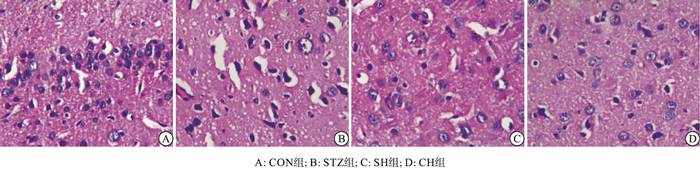
CON组大鼠海马神经元细胞核呈圆形,大而规则,未见明显的核固缩或体积缩小。STZ组大鼠海马神经元中部分出现细胞核固缩、深染及空泡变性。与STZ组比较,SH组大鼠海马区的病变相对减轻,大鼠海马神经元形态较完整,固缩变性的神经元少见。CH组大鼠海马神经元细胞核呈圆形,未见明显的核固缩和空泡(见图 1)。
-
与CON组比较,CH组各项指标差异无统计学意义(P>0.05);STZ组海马组织中MDA含量升高,T-AOC、SOD和GSH-Px活性下降(P < 0.01)。与STZ组比较,SH组中MDA含量降低,T-AOC、SOD和GSH-Px活性增高,差异均有统计学意义(P < 0.05)(见表 3)。
分组 T-AOC/(U/mg) SOD/(U/mg) GSH-Px/(U/mg) MDA/(nmol/mg) CON组 25.62±2.37 143.27±18.49 95.40±9.85 4.72±0.54 STZ组 13.24±1.76** 84.63±9.73** 54.82±6.49** 8.96±1.07** SH组 19.53±2.15**# 119.86±12.21**# 77.56±8.64**# 6.53±0.85**# CH组 24.85±2.29##△△ 145.50±17.65##△△ 98.63±10.22##△△ 4.81±0.59##△△ F 56.49 28.52 40.69 50.36 P < 0.01 < 0.01 < 0.01 < 0.01 MS组内 4.645 224.300 79.560 0.627 q检验:与CON组比较**P < 0.01;与STZ组比较#P < 0.05, ##P < 0.01;与SH组比较△△P < 0.01 表 3 各组大鼠海马组织T-AOC、SOD、GSH-Px和MDA水平(x±s;ni=8)
-
与CON组比较,STZ组Nrf2和HO-1 mRNA表达降低;与STZ组比较,SH组Nrf2和HO-1 mRNA表达增加,差异均有统计学意义(P < 0.01)。CH组与CON组比较差异无统计学意义(P>0.05)(见表 4)。
分组 Nrf2/β-actin HO-1/β-actin CON组 0.98±0.10 0.97±0.11 STZ组 0.52±0.08** 0.65±0.09** SH组 0.85±0.15**## 1.25±0.16**## CH组 1.03±0.13##△△ 1.03±0.12##△△ F 30.22 32.66 P < 0.01 < 0.01 MS组内 0.014 0.015 q检验:与CON组比较**P < 0.01;与STZ组比较##P < 0.01;与SH组比较△△P < 0.01 表 4 各组大鼠海马组织Nrf2和HO-1 mRNA表达(x±s;ni=8)
-
本研究通过一次性腹腔注射STZ诱导制备1型糖尿病大鼠模型,并利用Morris水迷宫对各组大鼠进行学习和空间记忆能力测试,结果显示,与CON组大鼠比较,STZ组大鼠FBG明显增加,其逃避潜伏期和到达正确象限的潜伏期明显延长,在正确象限停留时间显著减少。这表明持续高血糖会损伤大鼠的学习和空间记忆能力,出现明显的认知功能障碍。海马组织的HE染色结果显示,STZ组大鼠神经元细胞核固缩、空泡变性。因此进一步说明,糖尿病可引起海马组织病理结构异常,诱发认知功能障碍。
H2S是继一氧化氮和一氧化碳之后迄今观察到的第3种内源性气体信号分子,在神经系统发挥重要的生理调节作用。本研究结果显示,给予糖尿病大鼠外源性H2S干预后,虽然空腹血糖值无显著性差异,但大鼠BW减轻有所缓解,同时Morris水迷宫结果显示,与STZ组大鼠比较,逃避潜伏期和到达正确象限的潜伏期明显缩短,大鼠在正确象限停留时间明显延长,这提示外源性H2S具有改善糖尿病大鼠的学习和空间记忆能力。HE染色结果也进一步证实,H2S明显减轻糖尿病大鼠的海马组织病理改变。这些结果均证实,外源性H2S对糖尿病大鼠的认知功能障碍具有明显的改善作用。
氧化应激是糖尿病认知功能障碍的重要诱导因素[10]。当机体长期处于持续高血糖的状态下,会产生过量的活性氧簇,氧化应激损伤明显加重,进而引起海马组织结构异常,导致学习记忆功能障碍[11]。T-AOC反映组织的总抗氧化能力。SOD和GSH-Px是重要的抗氧化酶,其活性高低反映了组织抵抗氧化应激的能力。MDA是机体脂质过氧化反应的终产物,可以反映组织氧化损伤的程度。本实验结果显示,与CON组比较,STZ组大鼠海马组织中总抗氧化水平和抗氧化酶活性显著下降,MDA含量明显升高,证实糖尿病大鼠海马组织中存在氧化应激损伤。JIANG等[12]研究发现,外源性H2S可以增强创伤性脑损伤大鼠脑组织的抗氧化酶活性,减少氧化产物含量。本实验结果也显示,给予外源性H2S干预后,与STZ组相比,SH组中T-AOC水平、SOD和GSH-Px活性明显升高,MDA含量显著降低,提示外源性H2S可以通过增强抗氧化酶活性、减少脂质过氧化,抑制海马组织的氧化应激损伤。
Nrf2是细胞氧化还原稳态的主要调节因子。在生理条件下,Nrf2分布于细胞质内,当组织氧化应激增高时,Nrf2易位至细胞核,激活下游抗氧化基因HO-1的表达[13]。HO-1又称热休克蛋白32,机体各处均可见其表达,是一种受多种因素诱导的应激蛋白。在还原型辅酶Ⅱ和氧气同时存在的条件下,HO-1可催化血红素分解释放胆绿素,然后进一步降解为抗氧化活性更强的胆红素,可有效抑制脂质过氧化。因此,Nrf2/HO-1通路在体内发挥重要的抗氧化作用[14]。研究[15]表明,通过上调海马组织Nrf2/HO-1通路的表达可明显减轻因脑缺血引起的氧化应激损伤。此外,CHEN等[16]研究发现,外源性H2S可激活神经性疼痛大鼠脊髓中的Nrf2/HO-1通路,减轻大鼠的疼痛。本研究结果显示,与CON组比较,STZ组大鼠海马组织中Nrf2和HO-1表达明显降低,氧化应激损伤加重。外源性给予H2S干预后,与STZ组比较,SH组大鼠海马组织中Nrf2和HO-1表达明显升高,提示外源性H2S可通过上调海马组织Nrf2/HO-1通路,增强糖尿病大鼠海马组织抗氧化应激损伤的能力。
综上所述,外源性H2S可明显改善糖尿病大鼠的认知功能障碍,减轻海马组织的病理结构变化,其机制可能与抑制海马组织氧化应激损伤,上调Nrf2/HO-1通路表达相关。
硫化氢对糖尿病大鼠空间学习记忆和海马组织氧化应激的影响
Effects of hydrogen sulfide on spatial learning and memory and oxidative stress in hippocampus tissue of diabetic rat
-
摘要:
目的 观察硫化氢(H2S)对糖尿病大鼠空间学习记忆的影响,并探讨其机制。 方法 雄性SD大鼠随机分为正常(CON)组、糖尿病(STZ)组、糖尿病+硫氢化钠(NaHS)组(SH组)和正常+NaHS(CH)组,每组8只。采用一次性腹腔注射链脲佐菌素的方法制备1型糖尿病大鼠模型。造模成功4周后,SH组和CH组大鼠每天腹腔注射NaHS溶液56 μmol/kg。处理4周后,测定大鼠空腹血糖(FBG)和体质量(BW);利用Morris水迷宫测试各组大鼠的空间学习记忆能力(逃避潜伏期、正确象限停留时间和到达正确象限的潜伏期);HE染色观察海马组织病理结构改变;利用试剂盒检测海马组织总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)水平;实时荧光定量聚合酶链式反应检测海马组织核因子E2相关因子2(Nrf2)和血红素氧化酶1(HO-1)mRNA表达情况。 结果 与CON组比较,CH组各项指标差异均无统计学意义(P>0.05);STZ组逃避潜伏期和到达正确象限的潜伏期延长,在正确象限停留时间缩短,大鼠海马组织病理结构损伤明显,FBG和MDA含量增加,BW、T-AOC、SOD、GSH-Px活性和Nrf2、HO-1 mRNA表达下降,差异均有统计学意义(P < 0.01)。与STZ组比较,除FBG外,SH组中以上各项指标均明显改善,差异均有统计学意义(P < 0.05~P < 0.01)。 结论 H2S可以改善糖尿病大鼠的认知功能障碍,其机制可能与抑制海马组织氧化应激损伤、上调Nrf2/HO-1通路的表达相关。 -
关键词:
- 硫化氢 /
- 糖尿病 /
- 海马 /
- 氧化应激 /
- Nrf2/HO-1通路
Abstract:Objective To investigate the effects of hydrogen sulfide (H2S) on spatial learning and memory in diabetic rats, and explore the underlying mechanism. Methods Male rats were randomly divided into normal (CON) group, diabetes mellitus (STZ) group, diabetes+sodium hydrosulfide (NaHS) (SH) group, and normal+NaHS (CH) group, with 8 rats in each group.Type 1 diabetes was induced by a single intraperitoneal injection of streptozotocin.Four weeks after successfully making the model, rats in SH group and CH group were intraperitoneally injected with 56 μmol/kg NaHS solution once a day.After treatment for 4 weeks, the fasting blood glucose (FBG) and body weight (BW) were measured.Spatial learning and memory abilities including escape latency, time spent in the target quadrant, and escape latency to the target quadrant were assessed by Morris water maze.The morphology of hippocampus tissue was observed by HE staining.The levels of total antioxidant capacity (T-AOC), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and malondialdehyde (MDA) in hippocampus tissue were determined by the kits.The mRNA expression of nuclear factor erythroid 2-related factor 2 (Nrf2) and heme oxygenase-1 (HO-1) in hippocampus tissue were detected using real time-quantitative polymerase chain reaction. Results Compared with the CON group, there was no significant difference in the various indexes in the CH group (P>0.05).In the STZ group, the escape latency and escape latency to the target quadrant were extended, and the time spent in the target quadrant was shortened (P < 0.01).The histological structure of hippocampus tissue was obviously damaged.The levels of FBG and MDA were increased (P < 0.01), whereas BW, the levels of T-AOC, SOD, GSH-Px activity, and Nrf2, HO-1 mRNA expression were decreased, the difference of which was statistically significant (P < 0.01).Compared with the STZ group, except for FBG, the above indicators were markedly improved in the SH group (P < 0.05 to P < 0.01). Conclusions H2S attenuates cognitive dysfunction in diabetic rats, the mechanism of which might be associated with the inhibition of oxidative stress and up-regulation of the Nrf2/HO-1 pathway in hippocampus tissue. -
Key words:
- hydrogen sulfide /
- diabetes mellitus /
- hippocampus /
- oxidative stress /
- Nrf2/HO-1 pathway
-
表 1 各组大鼠FBG和BW水平比较(x±s)
分组 n FBG/ (mmol/L) BW/g CON组 8 5.38±0.72 452.14±28.49 STZ组 8 23.46±2.15** 218.58±22.80** SH组 8 21.95±2.08** 246.61±24.52**## CH组 8 5.56±0.64##△△ 443.72±29.26##△△ F — 322.05 178.99 P — < 0.01 < 0.01 MS组内 — 2.469 697.225 q检验:与CON组比较**P < 0.01;与STZ组比较##P < 0.01;与SH组比较△△P < 0.01 表 2 各组大鼠Morris水迷宫行为学测试结果比较(x±s;ni=8)
分组 逃避潜伏期/s 正确象限
停留时间/s到达正确象限的
潜伏期/s第1天 第2天 第3天 第4天 第5天 CON组 69.59±5.62 62.04±4.96 44.35±3.87 27.62±2.79 20.43±2.05 48.52±3.24 9.65±1.27 STZ组 74.52±5.21 68.35±4.89 64.01±4.50** 55.22±5.68** 52.17±4.13** 28.13±2.86** 22.64±2.38** SH组 75.47±5.17 66.72±4.83 57.61±4.75**# 43.62±4.19**# 37.50±4.36**# 39.58±3.11**# 15.27±1.46**# CH组 70.05±5.73 63.22±5.38 46.79±4.64##△△ 27.33±3.75##△△ 22.13±3.41##△△ 49.27±3.38##△△ 9.28±1.34##△△ F 2.47 2.76 34.39 81.70 136.50 78.32 111.70 P > 0.05 > 0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 29.570 25.200 19.830 17.920 12.970 9.943 2.801 q检验:与CON组比较**P < 0.01;与STZ组比较#P < 0.05,##P < 0.01;与SH组比较△△P < 0.01 表 3 各组大鼠海马组织T-AOC、SOD、GSH-Px和MDA水平(x±s;ni=8)
分组 T-AOC/(U/mg) SOD/(U/mg) GSH-Px/(U/mg) MDA/(nmol/mg) CON组 25.62±2.37 143.27±18.49 95.40±9.85 4.72±0.54 STZ组 13.24±1.76** 84.63±9.73** 54.82±6.49** 8.96±1.07** SH组 19.53±2.15**# 119.86±12.21**# 77.56±8.64**# 6.53±0.85**# CH组 24.85±2.29##△△ 145.50±17.65##△△ 98.63±10.22##△△ 4.81±0.59##△△ F 56.49 28.52 40.69 50.36 P < 0.01 < 0.01 < 0.01 < 0.01 MS组内 4.645 224.300 79.560 0.627 q检验:与CON组比较**P < 0.01;与STZ组比较#P < 0.05, ##P < 0.01;与SH组比较△△P < 0.01 表 4 各组大鼠海马组织Nrf2和HO-1 mRNA表达(x±s;ni=8)
分组 Nrf2/β-actin HO-1/β-actin CON组 0.98±0.10 0.97±0.11 STZ组 0.52±0.08** 0.65±0.09** SH组 0.85±0.15**## 1.25±0.16**## CH组 1.03±0.13##△△ 1.03±0.12##△△ F 30.22 32.66 P < 0.01 < 0.01 MS组内 0.014 0.015 q检验:与CON组比较**P < 0.01;与STZ组比较##P < 0.01;与SH组比较△△P < 0.01 -
[1] JIA Q, MEHMOOD S, LIU X, et al.Hydrogen sulfide mitigates myocardial inflammation by inhibiting nucleotide-binding oligomerization domain-like receptor protein 3 inflammasome activation in diabetic rats[J].Exp Biol Med (Maywood), 2020, 245(3):221. doi: 10.1177/1535370219899899 [2] GASPAR JM, BAPTISTA FI, MACEDO MP, et al.Inside the diabetic brain:role of different players involved in cognitive decline[J].ACS Chem Neurosci, 2016, 7(2):131. doi: 10.1021/acschemneuro.5b00240 [3] LIU YW, ZHU X, ZHANG L, et al.Cerebroprotective effects of ibuprofen on diabetic encephalopathy in rats[J].Pharmacol Biochem Behav, 2014, 117:128. doi: 10.1016/j.pbb.2013.11.027 [4] BELTOWSKI J.Hydrogen sulfide in pharmacology and medicine——An update[J].Pharmacol Rep, 2015, 67(3):647. doi: 10.1016/j.pharep.2015.01.005 [5] PAUL BD, SNYDER SH.Modes of physiologic H2S signaling in the brain and peripheral tissues[J].Antioxid Redox Signal, 2015, 22(5):411. doi: 10.1089/ars.2014.5917 [6] XIE L, FENG H, LI S, et al.SIRT3 mediates the antioxidant effect of hydrogen sulfide in endothelial cells[J].Antioxid Redox Signal, 2016, 24(6):329. doi: 10.1089/ars.2015.6331 [7] PAUL BD, SNYDER SH.Gasotransmitter hydrogen sulfide signaling in neuronal health and disease[J].Biochem Pharmacol, 2018, 149:101. doi: 10.1016/j.bcp.2017.11.019 [8] OLAS B.Hydrogen sulfide in signaling pathways[J].Clin Chim Acta, 2015, 439:212. doi: 10.1016/j.cca.2014.10.037 [9] TANG ZJ, ZOU W, YUAN J, et al.Antidepressant-like and anxiolytic-like effects of hydrogen sulfide in streptozotocin-induced diabetic rats through inhibition of hippocampal oxidative stress[J].Behav Pharmacol, 2015, 26(5):427. doi: 10.1097/FBP.0000000000000143 [10] ZEINIVAND M, NAHAVANDI A, ZARE M.Deferoxamine regulates neuroinflammation and oxidative stress in rats with diabetes-induced cognitive dysfunction[J].Inflammopharmacology, 2020, 28(2):575. doi: 10.1007/s10787-019-00665-7 [11] 颜文慧, 张纯茜, 邢通, 等.尼可地尔可改善链脲佐菌素诱导的糖尿病小鼠的认知功能障碍[J].南方医科大学学报, 2018, 38(4):384. doi: 10.3969/j.issn.1673-4254.2018.04.03 [12] JIANG X, HUANG Y, LIN W, et al.Protective effects of hydrogen sulfide in a rat model of traumatic brain injury via activation of mitochondrial adenosine triphosphate-sensitive potassium channels and reduction of oxidative stress[J].J Surg Res, 2013, 184(2):e27. doi: 10.1016/j.jss.2013.03.067 [13] NEGI G, NAKKINA V, KAMBLE P, et al.Heme oxygenase-1, a novel target for the treatment of diabetic complications:focus on diabetic peripheral neuropathy[J].Pharmacol Res, 2015, 102:158. doi: 10.1016/j.phrs.2015.09.014 [14] 贾强, 王元元, 刘小粉, 等.金雀异黄酮对糖尿病大鼠心肌Nrf2/HO-1通路的影响[J].中南大学学报(医学版), 2019, 44(8):850. [15] WANG R, TU J, ZHANG Q, et al.Genistein attenuates ischemic oxidative damage and behavioral deficits via eNOS/Nrf2/HO-1 signaling[J].Hippocampus, 2013, 23(7):634. doi: 10.1002/hipo.22126 [16] CHEN H, XIE K, CHEN Y, et al.Nrf2/HO-1 signaling pathway participated in the protection of hydrogen sulfide on neuropathic pain in rats[J].Int Immunopharmacol, 2019, 75:105746. doi: 10.1016/j.intimp.2019.105746 -
 20200407.pdf
20200407.pdf
 20200407.pdf
20200407.pdf
-





 下载:
下载: