-
近几十年来,随着人们生活方式的改变以及激素的过度使用,乳腺癌的发病率和发病人数在逐年提升,已成为全球发病人数第二高的恶性肿瘤[1],在我国也是最常见的恶性肿瘤之一[2]。浸润性乳腺癌(infiltrating breast carcinoma,IBC,非特殊型)是乳腺癌中最常见的组织学类型。尽管近年来各种新的治疗方法和技术层出不穷,但IBC病人总的生存时间并没有显著提高,这可能与IBC病人术后复发与转移有关。口腔癌过表达蛋白1(oral cancer overexpressed protein 1,ORAOV1)最初是从口腔鳞状细胞癌中发现的一个候选癌基因,其定位于人染色体11q13。ORAOV1参与细胞周期、凋亡及血管生成等生物学活动[3-4]。ORAOV1蛋白表达异常增高常常与肿瘤细胞增殖快、分化差、预后不良等密切相关[5]。肿瘤组织通过诱导大量新生血管形成促进其快速生长,并进一步促进其发生浸润转移,从而增加病人术后复发和转移的概率。血管生成抑制因子1(vasohibin 1,VASH1)是近年来才发现的一种关于血管生成的负反馈调节因子[6],该因子主要是由血管内皮细胞生长因子(VEGF)、成纤维细胞生长因子2(FGF2)及血小板源性生长因子(PDGF)等共同刺激血管内皮细胞合成的,并负反馈性地抑制血管生成[7-8]。但是,越来越多的研究[9]表明VASH1高表达却常常意味着病人预后不良。本研究旨在通过免疫组织化学EliVisionTM plus法寻找能够预测IBC病人术后浸润、转移和预后的生物预测因子,为临床治疗提供一点线索。
-
239例IBC标本(IBC组)和100例相应的癌旁正常乳腺组织(对照组)收集自蚌埠医学院第一附属医院病理科,手术时间为2008-2010年;术前有过新辅助放、化疗或生物治疗病史的病例均被排除。所有病人均有完整的临床、病理资料以及术后总的生存时间资料,随访时间从手术日期开始,截至2015年12月或死亡(通过打电话、E-mail以及微信等随访)。随访时间为9~91个月。病人年龄27~77岁。所有入选的IBC组织和正常乳腺组织均经病理科医师再次阅片证实。
-
兔抗人ORAOV1多克隆抗体(ab211446,浓缩液,稀释比1:150)、VASH-1多克隆抗体(ab199732,浓缩液,稀释比1:100)购自美国Abcam生物有限公司;EliVisionTM plus及DAB显色试剂盒购自福州迈新生物技术有限公司。
-
本实验中所有石蜡包埋标本均经4%中性甲醛溶液固定,再经过连续4 μm厚切片等过程,最后经过二甲苯溶液脱蜡及梯度浓度的乙醇溶液脱二甲苯至水洗。免疫组织化学步骤按照EliVisionTM plus试剂盒说明步骤进行;ORAOV1和VASH1蛋白的染色步骤均根据各自要求进行,阳性对照片用已知阳性切片,空白对照用同种属的IgG替代。
-
ORAOV1蛋白阳性染色定位于细胞核,VASH-1蛋白阳性染色定位于细胞质和膜,相应部位出现黄色或棕黄色颗粒为阳性。根据参考文献[10]中介绍的阳性结果判定依据:将染色强度和染色范围来分别计分,然后将阳性强度得分和阳性范围得分相乘,得出一个0~12分的积分值范围。根据参考文献中的结果划分,将积分≥3分判定为阳性, < 3分判定为阴性。所有的病理阅片结果均由两位有经验的病理医师通过独立双盲法获得。
-
采用χ2检验、Speaman等级相关、生存分析(采用Kaplan-Meier方法)及log-rank检验。
-
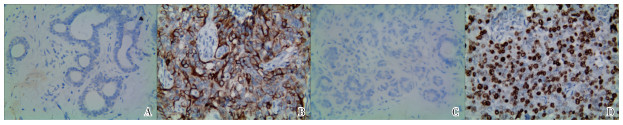
VASH1蛋白在对照组中的阳性率为12.0%(12/100), 低于在IBC组的56.9%(136/239)(χ2=57.79,P < 0.01)(见图 1A、1B)。对IBC组VASH1蛋白阳性率与临床病理因素之间的关系分析显示,与组织的分化程度、TNM分期、淋巴结转移和肿瘤组织的大小均有关系(P < 0.05~P < 0.01),与IBC病人的年龄及肿瘤位置等之间均无相关性(P>0.05)(见表 1)。
变量 n ORAOV1 VASH1 阳性 χ2 P 阳性 χ2 P 年龄/岁 < 50
≥50110
12969(62.73)
70(54.26)1.75 >0.05 40(36.36)
63(48.84)3.77 >0.05 肿瘤长径/cm ≤2.0 82 46(56.10) 43(47.56) >2.0~5.0 133 80(60.15) 21.06 < 0.01 75(56.39) 14.76 < 0.01 >5.0 24 23(95.83) 23(91.67) 部位 左侧
右侧118
12166(55.93)
73(60.33)0.48 >0.05 60(50.85)
76(62.81)3.49 >0.05 分化程度 高 59 24(40.68) 25(42.37) 中 113 70(61.95) 10.31 < 0.01 67(59.29) 7.44 < 0.05 低 67 45((67.16) 44(32.84) 淋巴结转移 无
有111
12849(44.14)
90(70.31)16.73 < 0.01 44(39.64)
92(71.88)25.19 < 0.01 TNM分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ128
11155(42.97)
84(75.68)26.13 < 0.01 57(44.53)
79(71.17)17.20 < 0.01 ER表达 阴性
阳性91
14858(63.74)
81(54.73)1.88 >0.05 63(69.23)
73(49.32)9.11 < 0.01 PR表达 阴性
阳性105
13455(52.38)
84(62.69)2.57 >0.05 61(58.10)
75(55.97)0.11 >0.05 HER2表达 阴性
阳性142
9775(52.82)
64(65.80)4.10 < 0.05 77(54.23)
59(60.82)1.02 >0.05 VASH1表达 阴性
阳性103
13630(29.13)
109(80.15)62.70 < 0.01 表 1 IBC中ORAOV1和VASH1的表达及其与临床各病理因素之间的关系[n;百分率(%)]
-
对照组中ORAOV1蛋白的阳性率13.0%(13/100)低于IBC组中58.2%(139/239)(χ2=58.13,P < 0.01(见图 1C、1D)。对IBC组ORAOV1蛋白阳性率与临床病理因素之间的关系分析显示,与年龄组、肿瘤位置均无关系(P>0.05),随着IBC组织的分化越差、肿瘤组织越大,ORAOV1蛋白的阳性率也越高(P < 0.01),淋巴结转移组中的ORAOV1蛋白的阳性率明显高于淋巴结无转移组(P < 0.01),高TNM分期组中的ORAOV1蛋白的阳性率明显高于低TNM分期组(P < 0.01)(见表 1)。
-
Spearman相关分析显示,在IBC组织中ORAOV1蛋白的阳性率与VASH1蛋白的阳性率呈正相关关系(r=0.512,P < 0.01),ORAOV1蛋白的阳性率与ER及PR蛋白之间无相关性(r=-0.089、0.104,P>0.05),与HER2蛋白呈正相关关系(r=0.131,P < 0.05);VASH1蛋白与ER蛋白呈负相关关系(r=-0.195,P < 0.01),与PR及HER2蛋白无相关性(r=-0.021、0.065,P>0.05)。
-
将本研究中涉及到所有临床病理参数, 包括年龄、肿瘤长径、肿瘤位置、分化程度、淋巴结转移、TNM分期、ER、PR、HER2、ORAOV1及VASH1等因素全部带入COX多因素模型进行分析,结果表明阳性表达的ORAOV1和VASH1蛋白、肿瘤长径和TNM分期高低是影响IBC病人术后总生存时间的独立预后因素(P < 0.05~P < 0.01)(见表 2)。
自变量 B SE P Exp(B) 95%CI ORAOV1 0.576 0.195 < 0.01 1.779 1.213~2.609 VASH1 0.549 0.195 < 0.01 1.732 1.182~2.538 TNM分期 0.379 0.169 < 0.01 1.460 1.048~2.034 肿瘤长径 0.267 0.130 < 0.05 1.307 1.012~1.687 表 2 COX多因素分析
-
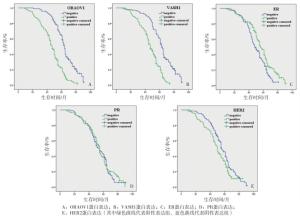
本研究中总的5年生存率约为35.6%(85/239)。Kaplan-Meier法生存分析表明ORAOV1蛋白阳性组中位生存时间为(44.8±15.2)个月,低于阴性组的(61.7±13.6)个月(χ2=53.39,P < 0.01)(见图 2A);VASH1蛋白阳性组为(45.0±14.1)个月,低于阴性组的(61.0±15.6)个月(χ2=49.60,P < 0.01)(见图 2B);ER蛋白阳性组为(53.9±17.7)个月,低于阴性组的(48.6±14.6)个月(χ2=8.98,P < 0.01), (见图 2C);PR蛋白阳性组为(52.0±17.5)个月,与阴性组为(51.7±15.9)个月差异无统计学意义(χ2=0.17,P>0.05)(见图 2D);HER2蛋白阳性组为(48.0±16.9)个月,低于阴性组的(54.6±16.2)个月(χ2=5.11,P < 0.05)(见图 2E)。
-
近年来,罹患乳腺癌的人数不断增加,且年龄不断年轻化,因此,迫切需要寻找能早期诊断、预测其浸润和转移及预后的分子。ORAOV1是近年来发现的一个新的癌基因,研究表明它是人染色体11q13区域基因扩增的主要驱动因子[3]。在多种肿瘤的发生过程中,ORAOV1在调节肿瘤细胞增殖和血管生成方面起着重要作用[4-5, 11-12]。本研究主要通过免疫组织化学方法检测ORAOV1蛋白在IBC组织及其相应的癌旁正常对照组中的表达情况,发现在IBC组织中ORAOV1蛋白的阳性率显著高于对照组;且ORAOV1蛋白阳性率的高低差异在IBC组织的不同分化程度、TNM分期高低等之间均有统计学意义;淋巴结转移组中ORAOV1蛋白的阳性率显著高于其在淋巴结无转移组中的,差异也有统计学意义。上述结果表明,ORAOV1蛋白表达的异常增高可能参与了IBC的发生、发展、浸润及转移等过程,与其他学者[13-14]的结果相一致。
VASH1是一个由血管内皮细胞产生的特异性的抑制血管新生的蛋白,其位于人染色体14q24.3,包含7个内含子和8个外显子。VASH1蛋白可以在人体许多器官中表达,但在脑和胎盘组织中最常见。在体外实验中,VASH1蛋白可以抑制血管内皮细胞增殖、并促使其凋亡[15];VASH1能够抑制由VEGF和FGF2诱导的血管形成[6],并且还可以抑制淋巴管生成[8]。在本研究中,我们发现在IBC组中VASH1蛋白阳性率显著高于对照组,差异有统计学意义。并且随着IBC组织的分化越差、肿瘤组织越大,VASH1蛋白的阳性率也越高,差异均有统计学意义;淋巴结转移组中VASH1蛋白的阳性率显著高于其在淋巴结无转移组中,VASH1蛋白的阳性率在高TNM分期组中显著高于其在低TNM分期组中,差异也均有统计学意义。IBC组织为满足其快速增殖的需要,分泌大量VEGF和FGF2等因子促进血管形成,而VASH1蛋白的水平主要受到VEGF和FGF2的调控的血管内皮细胞产生,并负反馈性的抑制血管形成,因此VASH1的水平升高反而意味着肿瘤组织增殖快、分化差、易发生淋巴结转移以及预后差,与文献[9, 13, 16]报道一致。
复发和转移是IBC病人治疗失败最主要的原因。尽管TNM分期能够为每个病人的治疗方案提供一个总的策略,但是其不能全面地反映每个肿瘤病人的异质性及具体的生物学行为,因此,迫切需要寻找到一些能够预测IBC病人生物学行为及异质性的分子标志物。本研究总的生存分析发现,IBC病人总的5年生存率为35.6%。ORAOV1蛋白、VASH1蛋白和HER2蛋白阳性组IBC病人术后总的生存时间明显低于其阴性组病人;ER阳性组病人的术后总的生存时间明显高于其阴性组病人,log-rank分析表明差异均有统计学意义。多因素分析表明阳性表达的ORAOV1和VASH1蛋白、肿瘤长径及TNM分期高低是影响IBC病人术后总的生存时间的可能独立预后因素。Spearman等级相关检测表明ORAOV1和VASH1蛋白的表达呈正相关,且ORAOV1蛋白还与HER2蛋白的阳性表达呈正相关,VASH1蛋白与ER蛋白的阳性表达呈负相关关系,差异均有统计学意义。ORAOV1蛋白表达的异常增高参与了IBC的发生,并促进IBC的快速增殖、浸润和转移。在肿瘤的演进过程中,增殖的IBC细胞及其周围的其他细胞通过分泌VEGF、FGF2和PDGF等因子诱导血管形成,提供充足的营养成分及氧以促进IBC进一步快速增殖,并促使IBC细胞通过新生的血管、淋巴管侵袭、转移,而VEGF、FGF2及PDGF等同时能够促进血管内皮细胞合成VASH1,负反馈性的抑制血管形成,从而导致部分肿瘤组织由于生长过快、且又无法获得足够的营养和氧而发生坏死。由于病人体内的VASH1水平与VEGF、FGF2及PDGF水平相关,因此VASH1高表达反而意味着预后差。尽管本研究通过免疫组织化学方法得出一些有用的结果,但是手段和方法比较单一,希望在以后的研究中,能通过相关的体内及体外实验来进一步证实上述结果。
综上所述,ORAOV1蛋白的异常表达参与了IBC发生,可能与VASH1协同促进IBC的发展、侵袭及转移等过程。因此,可以通过联合检测IBC病人肿瘤组织中ORAOV1和VASH1蛋白表达情况,作为预测其可能发生浸润、转移以及预后的可能指标之一。
ORAOV1和Vasohibin1在乳腺癌中的表达及其临床意义
Expression of ORAOV1 and Vasohibin1 in infiltrating breast carcinoma, and their clinicopathological significance
-
摘要:
目的检测乳腺浸润性乳腺癌(infiltrating breast carcinoma,IBC)中口腔癌过表达蛋白1(oral cancer overexpressed protein 1,ORAOV1)和血管生成抑制因子1(vasohibin1,VASH1)的表达情况及其相互之间的关系,并分析它们在IBC中的临床意义。 方法通过免疫组织化学方法检测239例IBC和100例相应的正常乳腺组织中ORAOV1和VASH1蛋白的阳性表达情况。 结果在IBC组织中,ORAOV1和VASH1蛋白的阳性率分别为58.2%和56.9%;对照组中,ORAOV1和VASH1蛋白的阳性率分别为13.0%和12.0%,其表达差异在2组间均有统计学意义(P < 0.01)。ORAOV1和VASH1蛋白阳性率的差异在IBC病人肿瘤组织的不同分化程度之间、淋巴结转移与否之间、肿瘤大小之间及不同TNM分期之间差异均有统计学意义(P < 0.05~P < 0.01);且ORAOV1蛋白的阳性率与VASH1蛋白的阳性率之间呈正相关关系(P < 0.01)。在IBC病人中ORAOV1和VASH1蛋白阳性组术后的生存时间明显低于阴性组(P < 0.05~P < 0.01)。多因素回归分析显示阳性表达的ORAOV1和VASH1蛋白、肿瘤组织的大小及TNM分期高低均是影响IBC病人术后生存时间的独立预后因子(P < 0.05~P < 0.01)。 结论表达异常增高的ORAOV1和VASH1可能参与IBC的发生、发展,并促进其浸润和转移;在IBC病人肿瘤组织中联合检测ORAOV1和VASH1蛋白的表达情况对预测其发展和预后均有重要意义。 Abstract:ObjectiveTo investigate the expression levels of oral cancer overexpressed protein 1(ORAOV1)and vasohibin 1(VASH1)in infiltrating breast carcinoma(IBC), their relationship with each other, and their clinical significance in IBC. MethodsThe positive expression of ORAOV1 and VASH1 protein in 239 cases of IBC tissue and 100 cases of normal mammary tissue were detected using immunohistochemistry. ResultsThe positive rates of ORAOV1 and VASH1 protein in IBC tissue and control tissues were 58.2% & 56.9% and 13.0% & 12.0%, respectively, and the expression differences of whose were statistically significant between two groups(P < 0.05).The differences of the positive expression rates of ORAOV1 and VASH1 protein among IBC patients with different degrees of differentiation, lymph node metastasis, tumor size and TNM stage were statistically significant(P < 0.05 to P < 0.01).The positive rate of ORAOV1 protein was positively correlated with the positive rate of VASH1 protein(P < 0.01).The overall survival time of IBC's patients with positive expression ORAOV1 and VASH1 was lower than that of IBC's patients with negative expression of ORAOV1 and VASH1(P < 0.01).The results of multivariate COX regression analysis showed that the positive expression of ORAOV1 and VASH1 protein, tumor size and TNM stages were the independent prognostic factor affecting postoperative survival time of IBC patients. ConclusionsThe ORAOV1 and VASH1 with abnormally high expression may participate in the occurrence and development of IBC, and promote its infiltration and metastasis.The combined detection of ORAOV1 and VASH1 protein expression in tumor tissues of IBC patients is of great significance for the prediction of development and prognosis. -
表 1 IBC中ORAOV1和VASH1的表达及其与临床各病理因素之间的关系[n;百分率(%)]
变量 n ORAOV1 VASH1 阳性 χ2 P 阳性 χ2 P 年龄/岁 < 50
≥50110
12969(62.73)
70(54.26)1.75 >0.05 40(36.36)
63(48.84)3.77 >0.05 肿瘤长径/cm ≤2.0 82 46(56.10) 43(47.56) >2.0~5.0 133 80(60.15) 21.06 < 0.01 75(56.39) 14.76 < 0.01 >5.0 24 23(95.83) 23(91.67) 部位 左侧
右侧118
12166(55.93)
73(60.33)0.48 >0.05 60(50.85)
76(62.81)3.49 >0.05 分化程度 高 59 24(40.68) 25(42.37) 中 113 70(61.95) 10.31 < 0.01 67(59.29) 7.44 < 0.05 低 67 45((67.16) 44(32.84) 淋巴结转移 无
有111
12849(44.14)
90(70.31)16.73 < 0.01 44(39.64)
92(71.88)25.19 < 0.01 TNM分期 Ⅰ+Ⅱ
Ⅲ+Ⅳ128
11155(42.97)
84(75.68)26.13 < 0.01 57(44.53)
79(71.17)17.20 < 0.01 ER表达 阴性
阳性91
14858(63.74)
81(54.73)1.88 >0.05 63(69.23)
73(49.32)9.11 < 0.01 PR表达 阴性
阳性105
13455(52.38)
84(62.69)2.57 >0.05 61(58.10)
75(55.97)0.11 >0.05 HER2表达 阴性
阳性142
9775(52.82)
64(65.80)4.10 < 0.05 77(54.23)
59(60.82)1.02 >0.05 VASH1表达 阴性
阳性103
13630(29.13)
109(80.15)62.70 < 0.01 表 2 COX多因素分析
自变量 B SE P Exp(B) 95%CI ORAOV1 0.576 0.195 < 0.01 1.779 1.213~2.609 VASH1 0.549 0.195 < 0.01 1.732 1.182~2.538 TNM分期 0.379 0.169 < 0.01 1.460 1.048~2.034 肿瘤长径 0.267 0.130 < 0.05 1.307 1.012~1.687 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al.Global Cancer Statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2018, 68(6):394424. [2] CHEN WQ, ZHENG RS, BAADE PD, et al.Cancer statistics in China, 2015[J].CA Cancer J Clin, 2016, 66(2):115. doi: 10.3322/caac.21338 [3] HUANG X, GOLLIN SM, RAJA S, et al.High-resolution mapping of the 11q13 amplicon and identification of a gene, TAOS1, that is amplified and overexpressed in oral cancer cells[J].Proc Natl Acad Sci U S A, 2002, 99(17):11369. doi: 10.1073/pnas.172285799 [4] JIANG L, ZENG X, WANG Z, et al.Oral cancer overexpressed 1(ORAOV1)regulated cell cycle and apoptosis in cervical cancer HeLa cells[J].Mol Cancer, 2010, 9:20. doi: 10.1186/1476-4598-9-20 [5] TOGASHI Y, ARAO T, KATO H, et al.Frequent amplification of ORAOV1 gene in esophageal squamous cell cancer promotes an aggressive phenotype via proline metabolism and ROS production[J].Oncotarget, 2014, 5(10):2962. doi: 10.18632/oncotarget.1561 [6] WATANABE K, HASEGAWA Y, YAMASHITA H, et al.Vasohibin as an endothelium-derived negative feedback regulator of angiogenesis[J].J Clin Invest, 2004, 114(7):898. doi: 10.1172/JCI200421152 [7] AFFARA M, SANDERS D, ARAKI H, et al.Vasohibin-1 is identified as a master-regulator of endothelial cell apoptosis using gene network analysis[J].BMC Genomics, 2013, 14:23. doi: 10.1186/1471-2164-14-23 [8] HEISHI T, HOSAKA T, SUZUKI Y, et al.Endogenous angiogenesis inhibitor vasohibin1 exhibits broad-spectrum antilymphangiogenic activity and suppresses lymph node metastasis[J].Am J Pathol, 2010, 176(4):1950. doi: 10.2353/ajpath.2010.090829 [9] KOSAKA T, MIYAZAKI Y, MIYAJIMA A, et al.The prognostic significance of vasohibin-1 expression in patients with prostate cancer[J].Br J Cancer, 2013, 108(10):2123. doi: 10.1038/bjc.2013.169 [10] WU S, YU L, WANG D, et al.Aberrant expression of CD133 in non-small cell lung cancer and its relationship to vasculogenic mimicry[J].BMC Cancer, 2012, 12:535. doi: 10.1186/1471-2407-12-535 [11] JIANG L, ZENG X, YANG H, et al.Oral cancer overexpressed 1(ORAOV1):a regulator for the cell growth and tumor angiogenesis in oral squamous cell carcinoma[J].Int J Cancer, 2008, 123(8):1779. doi: 10.1002/ijc.23734 [12] ZHAO X, LIU D, WANG L, et al.RNAi-mediated downregulation of oral cancer overexpressed 1(ORAOV1)inhibits vascular endothelial cell proliferation, migration, invasion, and tube formation[J].J Oral Pathol Med, 2016, 45(4):256. doi: 10.1111/jop.12371 [13] LI M, CUI X, SHEN Y, et al.ORAOV1 overexpression in esophageal squamous carcinoma and esophageal dysplasia:a possible biomarker of progression and poor prognosis in esophageal carcinoma[J].Hum Pathol, 2015, 46(5):707. doi: 10.1016/j.humpath.2015.01.009 [14] 冯吉, 刘琴, 刘磊, 等.口腔癌过表达蛋白1在结肠癌中的表达及其对细胞增殖、周期、凋亡的影响[J].第三军医大学学报, 2016, 38(10):1160. [15] KERN J, BAUER M, RYCHLI K, et al.Alternative splicing of vasohibin-1 generates an inhibitor of endothelial cell proliferation, migration, and capillary tube formation[J].Arterioscler Thromb Vasc Biol, 2008, 28(3):478. doi: 10.1161/ATVBAHA.107.160432 [16] MIYAZAKI Y, KOSAKA T, MIKAMI S, et al.The prognostic significance of vasohibin-1 expression in patients with upper urinary tract urothelial carcinoma[J].Clin Cancer Res, 2012, 18(15):4145. doi: 10.1158/1078-0432.CCR-12-0073 -





 下载:
下载: