-
支气管哮喘因严重影响病人的生活质量及远期预后,已成为呼吸系统常见的慢性疾病之一[1]。尤其是儿童病人,因临床表现及发作形式多样化,且患儿就诊时对于病史及症状描述不确切,更是增加了诊断的难度,导致诊治不及时,随着病程的迁延,患儿出现进行性加重的气道狭窄和不可逆性的气道重塑。因此,早期诊断和治疗儿童支气管哮喘的重要性不言而喻。促使哮喘向慢性疾病演变的重要因素在近年来的研究中被发现,主要是由于气道炎症及气道重塑,它们在哮喘发展过程中起着重要的病理生理作用[2]。有研究[3]表明,卡介苗(bacillus calmette-guerin, BCG)通过免疫调节,发挥其减轻气道上皮细胞损伤及间质转化的作用,从而减轻哮喘性气道炎症和气道阻塞,但目前国内外对BCG在改善气道重塑的作用机制方面进行报道的相关文献较少。本研究着重探讨在BCG干预下,支气管哮喘大鼠气道重塑情况以及血清缺氧诱导因子-1α(hypoxia-inducible factor-1 alpha,HIF-1α)的表达情况,旨在为临床控制哮喘症状、改善哮喘病人预后提供实验室依据,现作报道。
-
选取清洁级健康雄性SD大鼠30只,10~12周龄,由维通利华厂家提供,在层流实验室进行喂养,提供喂养所需的专用饲料及专用水。
-
BCG,购自成都生物制品研究所有限责任公司;卵白蛋白(OVA),购自索莱宝公司;氢氧化铝,购自天津化学试剂三厂;二甲苯、无水乙醇购自中国国药;Citrate柠檬酸盐缓冲液(pH6.0)、PBS磷酸盐缓冲液(pH 7.2~7.4)、苏木素染液、中性树胶,购自中杉金桥生物科技有限公司;大鼠HIF-1α检测试剂盒,购自上海西唐生物科技有限公司。
-
全自动脱水机(ASP200S)、石蜡切片机(RM2235)、烤片台(HI1220)、水浴缸(HI1220)、加热石蜡包埋系统(G1150 H),正置荧光显微镜(DM3000),均产自德国莱卡(Leica)设备有限公司;酶标仪(Spectra Max M5),产自Molecular Devices公司;空气压缩雾化器(PARIBOYNO56),产自德国百瑞公司。
-
将30只SD大鼠按照随机数字表法分成对照组、哮喘组和BCG治疗组,每组10只。饲养条件为室温20 ℃左右、空气湿度60%左右的清洁环境,在光照-黑暗各交替12 h条件下分笼饲养,独自摄食和饮水,各组大鼠用药前均测量体重,实验过程中严格遵守无菌操作原则。
-
哮喘组大鼠在第1天和第8天,腹部皮肤消毒,腹腔注射10% OVA+氢氧化铝混合液(每毫升0.9%氯化钠溶液含100 mg OVA和100 mg氢氧化铝干粉)1 mL致敏。从第15天开始用1% OVA(每毫升0.9%氯化钠溶液含10 mg OVA)进行雾化吸入,每天1次,每次20 min,共2周,使大鼠致敏;当大鼠出现口唇发绀、呼吸急促、肢体抽动、喘息、打喷嚏、烦躁不安等症状时,表明激发试验成功。对照组大鼠制模方法同哮喘组,在相同的时间点进行腹腔注射和雾化吸入处理,但区别在于使用的是0.9%氯化钠溶液来替代OVA和氢氧化铝。
BCG治疗组大鼠制模方法同哮喘组,每天雾化前半小时使用BCG 0.025 mg[4]进行皮内注射。
-
在末次激发后24 h,对3组大鼠进行标本收集。(1)血清标本:采用乙醚吸入的方法将大鼠进行吸入麻醉,当大鼠四肢松弛,刺激无疼痛反射后,取仰卧位固定在解剖板上,在剑突下呈V字形剪开皮肤,剪断两侧胸廓暴露心脏,用枸橼酸钠抗凝管在心尖处使用真空采血针采取约5 mL新鲜血液,轻轻晃动试管,使血液与抗凝剂充分混匀,在20 ℃冰箱中放置30 min,4 000 r/min离心15 min。使用一次性清洁吸管从离心完成后的标本吸取上清液于容积2 mL的EP管中,放置在-80 ℃冰箱保存,备用,以进一步检测HIF-1α。(2)肺组织标本:采血结束后快速进行气管和肺组织分离,操作过程中需注意轻柔以避免肺组织损伤。首先用血管钳在剪下右肺前夹闭右侧主支气管,用0.9%氯化钠溶液冲洗剪下的右肺,然后将肺组织表面液体用无菌纱布吸干,在4%多聚甲醛中浸泡48 h固定标本,梯度乙醇脱水和二甲苯进行透明处理,石蜡包埋。组织切片宜选取右肺中叶,切片厚度为3 μm,烤片后备用。
-
肺组织切片常规脱蜡至水,在配置好的Weigert铁苏木素中染色5~10 min;用酸性乙醇分化液分化,水洗;用Masson蓝化液返蓝,水洗1 min;蒸馏水洗1 min;丽春红品红染色液染色时间为5~10 min;在上述操作过程中将蒸馏水∶弱酸溶液按照2∶1的比例配置成弱酸工作液,用弱酸工作液洗1 min;磷钼酸溶液洗1~2 min;用配置好的弱酸工作液洗1 min;直接入苯胺蓝染色液中染色1~2 min;用配置好的弱酸工作液洗1 min;95%乙醇快速脱水;无水乙醇脱水3次,每次5~10 s;二甲苯透明3次,每次1~2 min;中性树胶封固。
-
取大鼠血清,严格按照试剂盒说明,采用双抗体夹心ABC-ELISA法测定HIF-1α的血清含量, 记录数据。
-
运用图像分析软件测量支气管内径周长(Pi)、支气管管壁面积(WAt)、支气管平滑肌总面积(WAm)等指标,并将测量所得的WAt值和WAm值用Pi进行标化,分别代表支气管管壁厚度(WAt/ Pi),支气管平滑肌厚度(WAm/ Pi)。
-
采用方差分析和q检验、Pearson相关性分析。
-
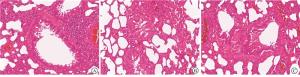
通过光学显微镜进行观察,对照组大鼠肺组织肺泡形态正常,排列均匀,肺泡壁未见明显增厚,气管及血管结构均正常;哮喘组大鼠肺组织肺泡壁有明显增厚,视野可见大量炎性细胞浸润,气管腔内可见明显黏液残留,模型构建成功;BCG治疗组大鼠肺组织整体结构趋于正常,表明BCG对大鼠哮喘有治疗作用(见图 1)。
-
3组大鼠血清HIF-1α表达水平比较,哮喘组> BCG治疗组>对照组,差异有统计学意义(P < 0.01)(见表 1)。
分组 n HIF-1α 对照组 10 10.12±0.95 哮喘组 10 20.85±2.47** BCG组 10 13.57±2.11**△△ F — 78.58 P — < 0.01 MS组内 — 3.819 q检验:与对照组比较**P < 0.01;与哮喘组比较△△P < 0.01 表 1 3组大鼠血清HIF-1α表达水平比较(x±s; pg/mL)
-
与对照组比较,哮喘组和BCG治疗组大鼠WAt/Pi均升高(P < 0.01和P < 0.05),哮喘组大鼠WAm/Pi升高(P < 0.01);与哮喘组比较,BCG治疗组大鼠WAt/Pi和WAm/Pi均降低(P < 0.01和P < 0.05)(见表 2)。
分组 n WAt/ Pi WAm/ Pi 对照组 10 5.64±3.47 1.27±0.96 哮喘组 10 56.76±29.93** 3.68±2.33** BCG治疗组 10 28.08±11.90*△△ 1.79±0.63△ F — 17.99 6.55 P — < 0.01 < 0.01 MS组内 — 349.819 2.249 q检验:与对照组比较*P < 0.05,**P < 0.01;与哮喘组比较△P < 0.05,△△P < 0.01 表 2 3组大鼠WAt/Pi和WAm/Pi的比较(x±s; μm)
-
结果显示,大鼠血清HIF-1α与支气管壁厚度和支气管平滑肌厚度之间呈正相关(r=0.618、0.503,P < 0.01)。
-
支气管哮喘的发病率呈现逐年上升趋势,其发病率升高的原因可能和感染、环境污染、全球气候变化以及雾霾天气影响等诸多因素具有一定的相关性[5]。而且由于本病易反复发作,病程迁延,严重影响病人的生活质量及远期预后,已成为呼吸系统常见的慢性疾病之一。目前哮喘防治的重要参考指南主要依据全球哮喘防治创议(Global Initiative for Asthma, GINA)方案[1],并处于不断更新中,中华医学会儿科学分会呼吸学组则制定了《儿童支气管哮喘诊断与防治指南》[6]。控制哮喘发作药物及缓解病情药物是该指南中治疗支气管哮喘的主要药物分类,这些药物主要用于控制哮喘的气道炎性反应以及气道痉挛,在哮喘急性发作期控制临床症状,在临床缓解期则用于预防喘息的急性发作。但是随着近年来研究的不断深入发现,随着病程的进展,哮喘的可逆性气流受限是可以发展为不可逆转的肺功能损害的。此类支气管哮喘病人,通常存在病情严重、病程时间长、主动或被动吸烟、持续接触过敏源和职业刺激物、持续的气道内炎症性反应等诸多因素中的一项或多项。并且近年来研究发现哮喘发病的各个环节中均伴有气道重塑的参与,因此认识到气道炎症及气道重塑在哮喘的病理生理发展过程中同时进行[7],共同参与了哮喘的发病过程。
活的牛型结核杆菌在体外经230代减毒培养后制成的活BCG,在临床上主要用于免疫接种,以预防人类结核病的发病。死BCG则由活BCG经高温灭活而成,除了短时间内用于结核免疫外,目前多数用于呼吸道疾病的辅助治疗,可用于治疗支气管哮喘等自身免疫性疾病[8]。
机体在缺氧状态下产生的HIF-1α是一种氧依赖性转录激活因子,是缺氧条件下关键细胞存活蛋白,已被确定为介导细胞对缺氧反应的重要转录因子,广泛参与机体的炎症和免疫反应,在不同条件下促进细胞存活和凋亡。HIF-1α在嗜酸性粒细胞趋化性中的作用曾由LAURA等[9]在研究髓系细胞HIF-1α诱导和调节哮喘发病机制的作用中做过首次评估,嗜酸性粒细胞HIF-1α的缺失可降低其趋化性,证实了髓系细胞中的HIF-1α在哮喘发病机制中起着重要作用,特别是在气道高反应的发展中起着重要作用。减轻过敏性气道炎症反应及新生血管形成[10-11],可通过抑制HIF-1α的表达或其活性而实现。
本研究发现,在BCG的干预下,治疗组大鼠肺组织整体结构趋于正常,相对于哮喘组大鼠肺组织肺泡壁明显增厚、大量炎性细胞浸润、气管腔可见明显黏液残留等情况而言,BCG对大鼠哮喘有明确的治疗作用。同时BCG干预组大鼠血清中HIF-1α的表达水平较哮喘组出现明显降低,说明BCG能够有效减轻过敏性气道炎症反应及新生血管形成,抑制气道上皮间质转化, 减缓气道重塑,是通过抑制哮喘大鼠血清中HIF-1α表达而发挥作用,证实了BCG治疗支气管哮喘的临床可行性。
本研究项目的意义在于为BCG在临床上治疗支气管哮喘提供理论依据,减轻患儿家庭的经济负担,减少医疗资源浪费,对提高患儿的生活质量及远期预后,有着重要而深远的意义。
卡介苗对支气管哮喘大鼠气道重塑及血清HIF-1α表达的影响
Effect of BCG on the airway remodeling and serum level of HIF-1α in bronchial asthma rats
-
摘要:
目的探讨卡介苗(BCG)干预下,支气管哮喘大鼠气道重塑以及血清缺氧诱导因子-1α(HIF-1α)的表达情况。 方法将30只清洁级健康雄性Sprague-Dawley(SD)大鼠随机分为对照组、哮喘组和BCG治疗组,每组10只。哮喘组大鼠采用腹腔注射10%卵白蛋白(OVA)+氢氧化铝混合液致敏,再用1% OVA超声雾化吸入的方法进行激发制作支气管哮喘模型;对照组大鼠采用相同的制模方法,但在相应的时间点使用0.9%氯化钠溶液替代致敏剂,进行腹腔注射和超声雾化吸入处理。BCG治疗组大鼠制模方法与哮喘组相同,每天雾化前半小时皮内注射BCG 0.025 mg进行干预治疗。3组大鼠在末次激发24 h后收集血清标本,采用ELISA法检测HIF-1α含量,采血后处死大鼠并制作气管和肺组织病理切片,观察大鼠气道炎症及气管重塑情况。运用图像分析软件测量支气管内径周长(Pi)、支气管管壁面积(WAt)、支气管平滑肌总面积(WAm)等指标, 并与Pi比较进行标化。 结果对照组大鼠肺组织中肺泡、气管、血管结构均正常;哮喘组大鼠肺泡壁明显增厚,气管腔可见黏液残留,部分可见肺泡腔内出血;BCG治疗组大鼠肺组织整体结构趋于正常。哮喘组大鼠血清中HIF-1α含量较对照组升高,经BCG干预后,大鼠血清HIF-1α降低(P < 0.01)。HIF-1α和支气管壁厚度(WAt/Pi)之间的相关性呈正相关,和支气管平滑肌厚度(WAm/Pi)之间的相关性呈正相关(P < 0.01)。 结论支气管哮喘大鼠经过BCG干预治疗,气道重塑减轻,可能是通过抑制HIF-1α的表达来发挥作用。 Abstract:ObjectiveTo investigate the effects of BCG intervention on the airway remodeling and serum hypoxia-inducible factor-1 alpha(HIF-1α)expression in bronchial asthma rats. MethodsThirtySD rats were randomly divided into the control group, asthma group and BCG treatment group(10 rats each group).The asthma group were intraperitoneally injected with 10% egg albumin(OVA)combined with aluminum hydroxide mixture for sensitization, and then stimulated by 1% OVA ultrasonic atomization inhalation to establish bronchial asthma model.The control group were treated with the same establishing model method, but at the corresponding time point, 0.9% sodium chloride solution was used to replace the sensitizer, and intraperitoneal injection and ultrasonic atomization inhalation were performed.The modeling method in BCG treatment group were the same as that of the asthma group, and the intradermal injection of 0.025 mg of BCG before half an hour of atomization was performed daily for intervention treatment.The inter-group variables were analyzed using Pearson correlation analysis method.The serum samples were collected after 24 h of last stimulation in three groups, and the contents of HIF-1α were detected using ELISA.After the rats were sacrificed, the trachea and lung histopathology sections were made to observe the airway inflammation and tracheal remodeling.The image analysis software was used to measure the internal diameter circumference(Pi), bronchial tube wall area(WAt)and total area of bronchial smooth muscle(WAm). ResultsThe structures of alveoli, trachea and blood vessels in control group were normal.In the asthma group, the alveolar wall significantly thickened, mucus remained in the trachea cavity, and intra-alveolar hemorrhage was partially observed.The overall structure of lung tissues in BCG treatment group tended to be normal.The serum HIF-1α content in asthma group increased compared with the control group, and the serum HIF-1 content decreased after BCG intervention(P < 0.01).The HIF-1α was positively correlated with bronchial wall thickness(WAt/Pi)and bronchial smooth muscle thickness(WAm/Pi)(P < 0.01). ConclusionsAfter BCG intervention treatment, the airway remodeling alleviates in bronchial asthma rats, and the effects may be by inhibiting HIF-1α expression to play. -
Key words:
- bronchial asthma /
- airway remodeling /
- Bacillus Calmette Guerin /
- hypoxia-inducible factor-1 alpha /
- rat
-
表 1 3组大鼠血清HIF-1α表达水平比较(x±s; pg/mL)
分组 n HIF-1α 对照组 10 10.12±0.95 哮喘组 10 20.85±2.47** BCG组 10 13.57±2.11**△△ F — 78.58 P — < 0.01 MS组内 — 3.819 q检验:与对照组比较**P < 0.01;与哮喘组比较△△P < 0.01 表 2 3组大鼠WAt/Pi和WAm/Pi的比较(x±s; μm)
分组 n WAt/ Pi WAm/ Pi 对照组 10 5.64±3.47 1.27±0.96 哮喘组 10 56.76±29.93** 3.68±2.33** BCG治疗组 10 28.08±11.90*△△ 1.79±0.63△ F — 17.99 6.55 P — < 0.01 < 0.01 MS组内 — 349.819 2.249 q检验:与对照组比较*P < 0.05,**P < 0.01;与哮喘组比较△P < 0.05,△△P < 0.01 -
[1] BATEMAN ED, HURD SS, BARNES PJ, et al. Global strategy for asthma management and prevention: GINA executive summary[J]. Eur Respir J, 2008, 31(1): 143. doi: 10.1183/09031936.00138707 [2] TREVOR JL, CHIPPS BE.Severe asthma in primary care: identification and management[J]. Am J Med, 2018, 131(5): 484. doi: 10.1016/j.amjmed.2017.12.034 [3] WANG P, ZHANG G, QIN X, et al. Inhibition of allergen-induce airway remodeling by neonatal bacillus Calmette-Guerin vaccination is associated with interferon-gamma-producing T cells but not regulatory T cells in mice[J]. Ann Allergy Asthma Immunol, 2011, 107(2): 163. doi: 10.1016/j.anai.2011.05.018 [4] NAHORI MA, LAGRANDERIE M, LEFORT J, et al. Effects of mycobacterium bovis BCG on the development of allergic inflammation and bronchial hyperresponsiveness in hyper-IgE BP2 mice vaccinated as new borns[J]. Vaccine, 2001, 19(11/12): 1484. [5] TOSKALA E, KENNEDY DW.Asthma risk factors[C]//International Forum of Allergy Rhinology.2015, 5(S1): S11. [6] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167. doi: 10.3760/cma.j.issn.0578-1310.2016.03.003 [7] GALLOS G, TOWNSEND E, YIM P, et al. Airway epithelium is a predominant source of endogenous airway GABA and contributes to relaxation of airway smooth muscle tone[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 304(3): L191. doi: 10.1152/ajplung.00274.2012 [8] KE X, HUANG J, CHEN Q, et al. Protective effects of combined Mycobacterium bovis BCG and interleukin-12 vaccination on airway inflammation in a murine model of allergic asthma[J]. Clin Invest Med, 2010, 33(3): 196. doi: 10.25011/cim.v33i3.13726 [9] LAURA E, CROTTY A, KATHRYN AM, et al. Myeloid cell HIF-1α regulates asthma airway resistance and eosinophil function[J]. J Mol Med(Berl), 2019, 91(5): 637. doi: 10.1007/s00109-012-0986-9 [10] 王莉, 张艳丽, 王秀芳, 等. mToR/4EBP1/HIF-α/VEGF信号通路在哮喘小鼠肺组织中的表达及意义[J]. 中国当代儿科杂志, 2017, 19(1): 104. [11] BYRNE AJ, JONES CP, GOWERS K, et al. Lung macrophages contribute to house dust mite driven airway remodeling via HIF-1α[J]. PLoS One, 2013, 8(7): 1. -




 下载:
下载:


