-
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)属于头颈部常见恶性肿瘤之一[1]。临床主要采用手术与化疗等手段治疗OSCC,但由于缺乏早期诊断OSCC的有效标志物导致大部分病人确诊时已处于中晚期,目前关于OSCC发生及转移机制尚未完全阐明。长链非编码RNA(long non-coding RNA,LncRNA)可调控基因转录、翻译等生物学过程,LncRNA表达异常与多种肿瘤发生发展密切相关[2-3]。研究[4]表明长链非编码RNA PCBP1-AS1(long non-coding RNA PCBP1-AS1,LncRNA PCBP1-AS1)可抑制外阴鳞癌细胞增殖、侵袭及迁移并促进其凋亡。近来报道指出PCBP1-AS1在口腔鳞癌中呈低表达,但关于其具体作用机制尚未阐明[5]。Janus激酶2(JAK2)/信号转导与转录激活因子3(STAT3)信号通路可参与细胞增殖、凋亡等多种生物学过程,JAK2可促使STAT3活化从而促进肿瘤发生发展[6-7]。但PCBP1-AS1是否可通过调控JAK2/STAT3信号通路而参与OSCC发生发展进程尚需进一步研究。本研究主要探讨PCBP1-AS1在OSCC细胞中的表达状态及其对细胞增殖、侵袭及凋亡的影响,初步探究其对JAK2/STAT3信号通路的调控作用,旨在为揭示OSCC发生发展机制奠定理论基础。
-
正常口腔上皮细胞HOK与口腔鳞癌细胞株CAL-27、Tca8113、KB购自美国ATCC公司。杜氏改良培养基(DMEM)、胰蛋白酶购自美国Gibco公司;pcDNA3.1购自上海吉玛制药技术有限公司;Trizol、反转录试剂盒、SYBR Green试剂盒购自日本TaKaRa公司;甲基噻唑基四唑(methylthiazolyl tetrazolium,MTT)购自美国APExBIO公司;细胞凋亡检测试剂盒购自上海泽叶生物科技有限公司;Transwell小室购自美国Corning公司;Mgtrigel基质胶购自美国BD公司;蛋白裂解液与二喹啉甲酸(BCA)蛋白定量试剂盒购自上海碧云天生物技术研究所;兔抗人细胞周期依赖蛋白激酶1(CDK1)、基质金属蛋白酶-2(MMP-2)、B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关蛋白(Bax)单抗购自美国CST公司;兔抗人Janus激酶2(JAK2)及其磷酸化激酶(p-JAK2)单抗购自北京博奥森生物技术有限公司;鼠抗人信号转导与转录激活因子3(STAT3)及其磷酸化(p-STAT3)单抗购自美国Santa Cruz公司;辣根过氧化物酶标记的山羊抗兔、山羊抗鼠IgG二抗均购自北京义翘神州科技有限公司。
-
细胞培养于DMEM培养基,培养条件:37 ℃、5%CO2培养箱,传代培养至第3代时。收集对数生长期CAL-27细胞,0.25%胰蛋白酶消化,加入DMEM培养基制备细胞悬液接种于24孔板,待细胞生长融合至50%时进行转染,转染前更换为不含胎牛血清的DMEM培养基,随机分为pcDNA-control组(细胞中转染pcDNA-control)、pcDNA-PCBP1-AS1组(细胞中转染PCBP1-AS1过表达质粒),各组细胞转染6 h后更换为含有10%胎牛血清的DMEM培养基,继续培养48 h。
-
收集各组细胞,根据Trizol试剂盒说明书操作提取细胞总RNA,应用Nanodrop2000c超微量分光光度计测定RNA浓度,将RNA反转录合成cDNA,严格按照试剂盒说明书进行操作,PCBP1-AS1正向引物5′-TGC CAA GAG CCT ATC CAT TC-3′,反向引物:5′-TCA CTC CCT TCA CCC TGT CT-3′;GAPDH正向引物5′-GCA CCG TCA AGG CTG AGA AC-3′,反向引物:5′-TGG TGA AGA CGC CAG TGG A-3′,引物由上海生工生物工程股份有限公司设计合成。以cDNA为模板进行qRT-PCR反应,反应条件:95 ℃ 2 min,95 ℃ 30 s,60 ℃30 s,72 ℃ 30 s,循环35次。PCBP1-AS1以GAPDH为内参,采用2-ΔΔCt法计算PCBP1-AS1相对表达量。
-
收集各组对数生长期CAL-27细胞,0.25%胰蛋白酶消化,制备单细胞悬液(3×104个/毫升),接种至96孔板(每孔200 μL),分别于转染24、48、72 h时每孔分别加入20 μL MTT溶液,室温孵育4 h,弃上清液,每孔分别加入150 μL二甲基亚砜(DMSO),低速振荡10 min,酶标仪检测各孔吸光度值(OD490 nm)。
-
预备实验:培养液预冷一定时间,以9∶1的比例稀释Matrigel基质胶,按照每孔40 μL的密度将Matrigel基质胶稀释液平铺于Transwell小室上室,37 ℃、体积分数5%CO2培养箱孵育5 h。实验步骤:取对数生长期CAL-27细胞,0.25%胰蛋白酶消化,加入不含胎牛血清的培养液制备单细胞悬液(5×104个/毫升),取200 μL接种于Transwell小室上室,另取500 μL含有10%胎牛血清的培养液加入Transwell小室的下室,37 ℃、体积分数5%CO2培养箱孵育24 h,PBS洗涤,多聚甲醛固定20 min,0.1%结晶紫染液染色10 min,湿棉签擦去小室内未侵袭细胞,显微镜下随机选取5个视野观察侵袭细胞数。
-
分别取各组对数生长期CAL-27细胞,预冷PBS清洗,加入500 μL结合缓冲液,依次加入5 μL膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)与5 μL碘化丙啶(PI),室温避光孵育10 min,应用流式细胞仪检测细胞凋亡率。
-
收集各组口腔鳞癌CAL-27细胞,加入蛋白裂解液,冰上裂解30 min提取细胞总蛋白,测定蛋白浓度时严格按照BCA试剂盒说明书进行操作,100 ℃高温煮沸蛋白变性,按照每孔加入30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,封闭2 h,孵育一抗稀释液(CDK1稀释比1∶800,MMP-2、Bcl2、Bax、p-JAK2、p-STAT3稀释比1∶1 000,内参β-actin稀释比1∶1 000),4 ℃孵育过夜,TBST洗涤3次×15 min,孵育二抗稀释液(1∶2 000),孵育1 h,TBST洗涤,曝光,显影,凝胶成像分析系统及应用ImageJ软件分析各条带灰度值。
-
采用t检验、单因素方差分析、LSD-t检验。
-
与正常口腔上皮细胞HOK相比,口腔鳞癌细胞CAL-27、Tca8113、KB中PCBP1-AS1的表达水平显著降低(P < 0.01),PCBP1-AS1在口腔鳞癌CAL-27细胞中的表达水平相对降低,因而选用口腔鳞癌CAL-27细胞进行后续研究(见表 1)。
分组 PCBP1-AS1表达量 HOK 1.00±0.15 CAL-27 0.28±0.04** Tca8113 0.31±0.05** KB 0.33±0.03** F 52.63 P < 0.01 MS组内 0.007 LSD-t检验:与正常口腔上皮细胞HOK比较**P < 0.01 表 1 qRT-PCR检测口腔鳞癌细胞株中PCBP1-AS1的表达(x±s;ni=3)
-
pcDNA-control组与pcDNA-PCBP1-AS1组细胞中PCBP1-AS1表达量分别为1.00±0.13和3.05±0.38,差异有统计学意义(P < 0.01)。相较于pcDNA-control组,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞增殖活力显著降低(P < 0.01)(见表 2)。
分组 PCBP1-AS1表达量 细胞增殖(OD值) F P MS组内 24 h 48 h 72 h pcDNA-control 1.00±0.13 0.50±0.06 0.74±0.07 1.05±0.12 19.51 < 0.01 0.010 pcDNA-PCBP1-AS1 3.05±0.38 0.36±0.04** 0.42±0.06** 0.53±0.05** 135.10 < 0.01 0.038 t 8.84 3.36 6.01 6.93 — — — P < 0.01 < 0.05 < 0.01 < 0.01 — — — LSD-t检验:与PCBP1-AS1表达量比较**P < 0.01 表 2 PCBP1-AS1过表达对CAL-27细胞增殖的影响(x±s;ni=3)
-
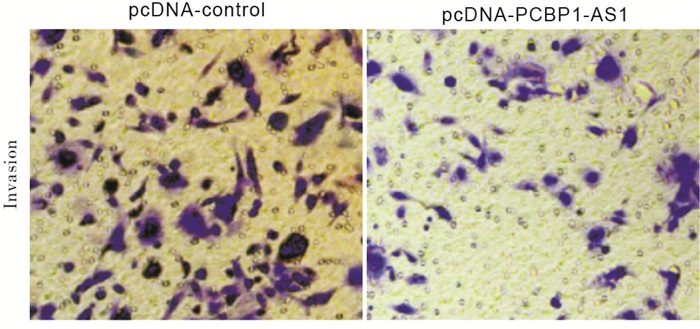
实验结果显示,与pcDNA-control组相比,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞侵袭数显著减少(P < 0.01)(见图 1、表 3)。
分组 细胞侵袭数/个 pcDNA-control 115.67±12.36 pcDNA-PCBP1-AS1 61.53±6.59 t 6.69 P < 0.01 表 3 PCBP1-AS1过表达对CAL-27细胞侵袭的影响(x±s;ni=3)
-
实验结果显示,相较于pcDNA-control组,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞凋亡率显著增加(P < 0.01)(见图 2、表 4)。
分组 凋亡率 pcDNA-control 3.15±0.29 pcDNA-PCBP1-AS1 38.62±3.57 t 17.15 P < 0.01 表 4 PCBP1-AS1过表达对CAL-27细胞凋亡的影响(x±s;ni=3)
-
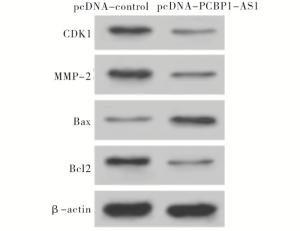
与pcDNA-control组相比,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞中CDK1、MMP-2、Bcl2蛋白表达水平显著降低(P < 0.01),Bax蛋白表达水平显著升高(P < 0.01)(见图 3、表 5)。
分组 CDK1 MMP-2 Bax Bcl2 pcDNA-control 1.00±0.12 1.00±0.15 1.00±0.11 1.00±0.16 pcDNA-PCBP1-AS1 0.31±0.05 0.28±0.03 3.56±0.38 0.30±0.03 t 9.19 8.15 11.21 7.45 P < 0.01 < 0.01 < 0.01 < 0.01 表 5 PCBP1-AS1过表达对CAL-27细胞增殖、侵袭和凋亡相关蛋白表达的影(x±s;ni=3)
-
实验结果显示,相比于pcDNA-control组,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞中p-JAK2、p-STAT3蛋白表达水平显著降低(P < 0.01),JAK2、STAT3蛋白表达水平无明显变化(P>0.05)(见图 4、表 6)。
分组 p-JAK2 JAK2 p-STAT3 STAT3 pcDNA-control 1.00±0.13 1.00±0.15 1.00±0.12 1.00±0.18 pcDNA-PCBP1-AS1 0.31±0.04 0.96±0.12 0.28±0.03 1.04±0.11 t 8.79 0.36 10.08 0.33 P < 0.01 >0.05 < 0.01 >0.05 表 6 PCBP1-AS1对CAL-27细胞JAK2/STAT3信号通路相关蛋白表达的影响(x±s;ni=3)
-
OSCC具有恶性程度高、浸润性强等特点, 导致病人极易出现复发及转移,病人生存期较短且预后较差[8]。既往研究[9-10]显示LncRNA表达异常与OSCC发生发展密切相关。因此从LncRNA角度分析OSCC发病机制对早期诊断OSCC及评估病人预后均具有重要意义。
PCBP1-AS1在神经胶质瘤细胞中呈低表达,并可能参与肿瘤发生发展过程,PCBP1-AS1还可能在癌症等相关疾病发生发展过程中发挥重要作用[11-12]。为探究其表达水平及作用机制,本研究检测口腔鳞癌细胞系中PCBP1-AS1的表达量,结果显示PCBP1-AS1在口腔鳞癌细胞中的表达水平显著低于正常口腔上皮细胞,提示PCBP1-AS表达水平降低可能促进OSCC的发生。本研究通过上调PCBP1-AS1表达分析其对口腔鳞癌CAL-27细胞增殖、侵袭及凋亡的影响,结果显示PCBP1-AS1过表达可抑制CAL-27细胞增殖、侵袭,并可促进细胞凋亡,提示PCBP1-AS1过表达可降低OSCC细胞增殖及侵袭能力,诱导细胞凋亡。同时本研究进一步检测细胞增殖、侵袭及凋亡相关蛋白表达,结果显示PCBP1-AS1过表达后细胞中CDK1、MMP-2、Bcl2蛋白表达水平显著降低,Bax蛋白表达水平显著升高。CDK1可促进细胞周期由G2期进入M期从而促进细胞增殖,MMP-2可通过降解细胞外基质从而促进肿瘤细胞转移,Bcl2与Bax在细胞凋亡过程中发挥重要作用,Bax蛋白表达升高可促进细胞凋亡,Bcl2可抑制Bax表达从而发挥抗细胞凋亡作用[13-15]。因此,PCBP1-AS1过表达可通过上调Bax表达及下调CDK1、MMP-2、Bcl2表达从而减弱OSCC细胞增殖及侵袭能力,提高细胞凋亡水平。
JAK2/STAT3信号通路中STAT3经磷酸化的方式活化后可参与肿瘤细胞增殖、迁移及血管生成等多种生物学过程,研究表明通过JAK2/STAT3信号通路可参与结肠癌细胞增殖、凋亡、迁移及侵袭过程[16]。JAK2/STAT3信号通路还可参与肝细胞癌发生发展过程[17]。研究[18]报道指出抑制JAK2/STAT3信号通路可抑制多发性骨髓瘤生长并促进细胞凋亡。本研究结果显示PCBP1-AS1过表达后CAL-27细胞中p-JAK2、p-STAT3蛋白表达水平显著降低,说明PCBP1-AS1过表达抑制JAK2/STAT3信号通路激活。提示PCBP1-AS1过表达可能通过抑制JAK2/STAT3信号通路而影响OSCC细胞增殖、侵袭及凋亡行为。
综上所述,PCBP1-AS1过表达能够抑制OSCC细胞增殖、侵袭,促进细胞凋亡,其作用机制可能与抑制JAK2/STAT3信号通路激活有关,可为靶向治疗OSCC提供潜在靶点。但关于PCBP1-AS1如何调控下游miRNA/靶基因表达尚未可知,本研究仅从体外细胞实验探讨PCBP1-AS1对OSCC的作用,仍需进行体内实验及临床研究进一步明确PCBP1-AS1在OSCC发生发展中的重要作用。
LncRNA PCBP1-AS1对口腔鳞癌细胞增殖、侵袭和凋亡的影响
Effect of LncRNA PCBP1-AS1 on the proliferation, invasion and apoptosis of oral squamous carcinoma cells
-
摘要:
目的探讨长链非编码RNA PCBP1-AS1(LncRNA PCBP1-AS1)对口腔鳞状细胞癌(OSCC)细胞增殖、侵袭及凋亡的影响及其可能机制。 方法采用实时荧光定量聚合酶链反应检测OSCC细胞中PCBP1-AS1的表达水平;采用Lipofectamine 2000将pcDNA-PCBP1-AS1及pcDNA-control转染入口腔鳞癌CAL-27细胞;甲基噻唑基四唑实验检测CAL-27细胞的增殖能力;Transwell实验检测细胞的侵袭能力;流式细胞术检测细胞的凋亡率;蛋白免疫印迹法检测细胞周期依赖蛋白激酶1(CDK1)、基质金属蛋白酶-2(MMP-2)、B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关蛋白(Bax)、Janus激酶2(JAK2)/信号转导与转录激活因子3(STAT3)信号通路相关蛋白表达。 结果与正常口腔上皮细胞比较,OSCC细胞CAL-27、Tca8113、KB中PCBP1-AS1的表达水平显著降低(P < 0.01);PCBP1-AS1过表达可显著抑制CAL-27细胞的增殖、侵袭(P < 0.01),促进细胞凋亡(P < 0.01);PCBP1-AS1过表达可显著抑制CDK1、MMP-2、Bcl2、p-JAK2、p-STAT3的蛋白表达(P < 0.01),而促进Bax的蛋白表达(P < 0.01)。 结论PCBP1-AS1过表达可抑制OSCC细胞增殖、侵袭,诱导细胞凋亡,其作用可能与抑制JAK2/STAT3信号通路激活有关。 -
关键词:
- 口腔鳞状细胞癌 /
- LncRNA PCBP1-AS1 /
- 增殖 /
- 侵袭 /
- 凋亡 /
- JAK2/STAT3信号通路
Abstract:ObjectiveTo investigate the effects of long-chain non-coding RNA PCBP1-AS1(LncRNA PCBP1-AS1)on the proliferation, invasion and apoptosis of oral squamous carcinoma cells(OSCC)cells, and its possible mechanism. MethodsThe expression level of PCBP1-AS1 in OSCC cells was detected using Real-time quantitative polymerase chain reaction(qRT-PCR).The pcDNA-PCBP1-AS and pcDNA-control were transfected into the luminal squamous cell carcinoma CAL-27 cells using Lipofectamine 2000.The proliferation ability, invasive ability and apoptotic rate of CAL-27 cells were detected using MTT assay, Transwell experiments and flow cytometry, respectively. ResultsCompared with the normal oral epithelial cells, the expression levels of PCBP1-AS1 in oral squamous cell carcinoma cells CAL-27, Tca8113, and KB significantly decreased(P < 0.01).The overexpression of PCBP1-AS1 could significantly inhibit the proliferation and invasion of CAL-27 cells(P < 0.01), and promote apoptosis of cells(P < 0.01).The overexpression of PCBP1-AS1 could significantly inhibit the protein expression levels of CDK1, MMP-2, Bcl2, p-JAK2 and p-STAT3(P < 0.01), and promote the protein expression of Bax(P < 0.01). ConclusionsThe overexpression of PCBP1-AS1 can inhibit the proliferation and invasion of OSCC cells, and induce its apoptosis, and the mechanism of which may be related to the inhibition of JAK2/STAT3 signaling pathway activation. -
表 1 qRT-PCR检测口腔鳞癌细胞株中PCBP1-AS1的表达(x±s;ni=3)
分组 PCBP1-AS1表达量 HOK 1.00±0.15 CAL-27 0.28±0.04** Tca8113 0.31±0.05** KB 0.33±0.03** F 52.63 P < 0.01 MS组内 0.007 LSD-t检验:与正常口腔上皮细胞HOK比较**P < 0.01 表 2 PCBP1-AS1过表达对CAL-27细胞增殖的影响(x±s;ni=3)
分组 PCBP1-AS1表达量 细胞增殖(OD值) F P MS组内 24 h 48 h 72 h pcDNA-control 1.00±0.13 0.50±0.06 0.74±0.07 1.05±0.12 19.51 < 0.01 0.010 pcDNA-PCBP1-AS1 3.05±0.38 0.36±0.04** 0.42±0.06** 0.53±0.05** 135.10 < 0.01 0.038 t 8.84 3.36 6.01 6.93 — — — P < 0.01 < 0.05 < 0.01 < 0.01 — — — LSD-t检验:与PCBP1-AS1表达量比较**P < 0.01 表 3 PCBP1-AS1过表达对CAL-27细胞侵袭的影响(x±s;ni=3)
分组 细胞侵袭数/个 pcDNA-control 115.67±12.36 pcDNA-PCBP1-AS1 61.53±6.59 t 6.69 P < 0.01 表 4 PCBP1-AS1过表达对CAL-27细胞凋亡的影响(x±s;ni=3)
分组 凋亡率 pcDNA-control 3.15±0.29 pcDNA-PCBP1-AS1 38.62±3.57 t 17.15 P < 0.01 表 5 PCBP1-AS1过表达对CAL-27细胞增殖、侵袭和凋亡相关蛋白表达的影(x±s;ni=3)
分组 CDK1 MMP-2 Bax Bcl2 pcDNA-control 1.00±0.12 1.00±0.15 1.00±0.11 1.00±0.16 pcDNA-PCBP1-AS1 0.31±0.05 0.28±0.03 3.56±0.38 0.30±0.03 t 9.19 8.15 11.21 7.45 P < 0.01 < 0.01 < 0.01 < 0.01 表 6 PCBP1-AS1对CAL-27细胞JAK2/STAT3信号通路相关蛋白表达的影响(x±s;ni=3)
分组 p-JAK2 JAK2 p-STAT3 STAT3 pcDNA-control 1.00±0.13 1.00±0.15 1.00±0.12 1.00±0.18 pcDNA-PCBP1-AS1 0.31±0.04 0.96±0.12 0.28±0.03 1.04±0.11 t 8.79 0.36 10.08 0.33 P < 0.01 >0.05 < 0.01 >0.05 -
[1] CHI AC, DAY TA, NEVILLE BW.Oral cavity and oropharyngeal squamous cell carcinoma-an update[J]. CA Cancer J Clin, 2015, 65(5): 401. doi: 10.3322/caac.21293 [2] HANNON GJ, RIVAS FV, MURCHISON EP, et al. The expanding universe of noncoding RNAs[J]. Cold Spring Harb Symp Quant Biol, 2006, 71(1): 551. [3] HUNG T, CHANG HY.Long noncoding RNA in genome regulation[J]. RNA Biol, 2010, 7(5): 582. doi: 10.4161/rna.7.5.13216 [4] 王洪雨. PCBP1-AS1通过TRAF5介导的NF-κB信号通路调控外阴鳞癌细胞生物学行为的机制研究[D]. 沈阳: 中国医科大学, 2018. [5] FENG L, HOUCK JR, LOHAVANICHBUTR P, et al. Transcriptome analysis reveals differentially expressed lncRNAs between oral squamous cell carcinoma and healthy oral mucosa[J]. Oncotarget, 2017, 8(19): 31521. doi: 10.18632/oncotarget.16358 [6] LOU L, ZHOU J, LIU Y, et al. Chlorogenic acid induces apoptosis to inhibit inflammatory proliferation of IL-6-induced fibroblast-like synoviocytes through modulating the activation of JAK/STAT and NF-κB signaling pathways[J]. Exp Ther Med, 2016, 11(5): 2054. doi: 10.3892/etm.2016.3136 [7] GUO W, LI W, YUAN L, et al. MicroRNA-106a-3p induces apatinib resistance and activates janus-activated kinase 2(JAK2)/signal transducer and activator of transcription 3(STAT3)by targeting the SOCS system in gastric cancer[J]. Med Sci Monit, 2019, 25(1): 10122. [8] CHEN F, QI S, ZHANG X, et al. lncRNA PLAC2 activated by H3K27 acetylation promotes cell proliferation and invasion via the activation of Wnt/β catenin pathway in oral squamous cell carcinoma[J]. Int J Oncol, 2019, 54(4): 1183. [9] MA WQ, CHEN J, FANG W, et al. LncRNA INHBA-AS1 promotes cell growth, migration, and invasion of oral squamous cell carcinoma by sponging miR-143-3p[J]. Eur Rev Med Pharmacol Sci, 2020, 24(4): 1821. [10] WANG F, JI X, WANG J, et al. LncRNA PVT1 enhances proliferation and cisplatin resistance via regulating miR-194-5p/HIF1a axis in oral squamous cell carcinoma[J]. Onco Targets Ther, 2020, 13(1): 243. [11] LUAN F, CHEN W, CHEN M, et al. An autophagy-related long non-coding RNA signature for glioma[J]. FEBS Open Bio, 2019, 30(14): 1. [12] MO XB, WU LF, ZHU XW, et al. Identification and evaluation of lncRNA and mRNA integrative modules in human peripheral blood mononuclear cells[J]. Epigenomics, 2017, 9(7): 943. doi: 10.2217/epi-2016-0178 [13] JIN J, XU H, LI W, et al. LINC00346 Acts as a Competing endogenous RNA regulating development of hepatocellular carcinoma via modulating CDK1/CCNB1 axis[J]. Front Bioeng Biotechnol, 2020, 8(1): 54. [14] MA TT, WANG L, WANG JL, et al. Hypoxia-Induced cleavage of soluble ephrinA1 from cancer cells Is mediated by MMP-2 and associates with angiogenesis In oral squamous cell carcinoma[J]. Onco Targets Ther, 2019, 12(1): 8491. [15] PAN LN, SUN YR.LINC00961 suppresses cell proliferation and induces cell apoptosis in oral squamous cell carcinoma[J]. Eur Rev Med Pharmacol Sci, 2019, 23(8): 3358. [16] LI N, MAO D, CAO Y, et al. Downregulation of SIRT6 by miR-34c-5p is associated with poor prognosis and promotes colon cancer proliferation through inhibiting apoptosis via the JAK2/STAT3 signaling pathway[J]. Int J Oncol, 2018, 52(5): 1515. [17] WU Y, YUAN T, WANG WW, et al. Long noncoding RNA HOST2 promotes epithelial-mesenchymal transition, proliferation, invasion and migration of hepatocellular carcinoma cells by activating the JAK2-STAT3 signaling pathway[J]. Cell Physiol Biochem, 2018, 51(1): 301. doi: 10.1159/000495231 [18] TANG S, CHENG B, ZHE N, et al. Histone deacetylase inhibitor BG45-mediated HO-1 expression induces apoptosis of multiple myeloma cells by the JAK2/STAT3 pathway[J]. Anticancer Drugs, 2018, 29(1): 61. doi: 10.1097/CAD.0000000000000568 -




 下载:
下载: