-
病理性瘢痕是临床上的常见病、多发病,发病机制尚未完全明了[1]。增生性瘢痕形成是多种细胞及细胞因子相互作用、调控的结果,而且与细胞外基质代谢异常、缺氧、高自由基、过度脂质过氧化反应、过度炎性反应及免疫有关。因此,良好有效的瘢痕动物模型对进一步研究增生性瘢痕的生物学机制显得尤为重要。MORRIS等[2]证实在兔耳急性及慢性创面上有明显的真皮过度增生。李荟元等[3]从1998年起, 在兔耳进行建立增生性瘢痕模型研究的基础上, 作了进一步的探索。本文就无水乙醇皮下注射后建立兔增生性瘢痕动物模型的有效性作一探讨。
-
新西兰大白兔27只,体质量均为1.5 kg,雌雄不限;注射器(规格为5 mL),剃毛器,无水乙醇(浓度为99.5%),15 cm钢尺。将27只新西兰大白兔按照注射无水乙醇1、2、3 mL/kg,随机分为甲、乙、丙3组,每组9只。
-
将实验兔子麻醉后固定于兔台,用剃毛器将注射部位相应的兔毛剔至长2 mm左右。用注射器将相应剂量的无水乙醇分别注入甲、乙、丙3组兔子背部皮肤真皮层。将所有兔子放在相同且适宜的环境下饲养,连续观察并记录注射部位的变化。
-
注射后7、30、90 d观察创面上皮化时间、瘢痕的色泽、厚度、表面粗糙程度等。选取最优实验组兔子注射位点区域中稳定增生时期的皮肤组织以及正常兔子皮肤组织,进行HE染色和Ⅰ型胶原。观察记录有无类似人增生性瘢痕组织的病理变化。
-
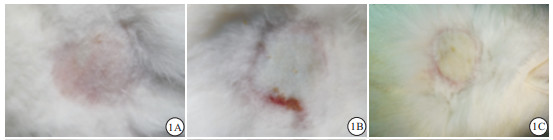
注射无水乙醇第7天,注射位点肉眼可见,甲组有一直径为0.5 cm乳白色点状区域;乙组有一直径约为1.5 cm的乳白色近圆形区域,边界与周围正常皮肤界限清楚,较正常皮肤变厚,质地变硬;丙组有直径3.5 cm的近圆形乳白色区域,注射区域与周围正常皮肤分界清楚,红肿明显,较正常皮肤明显变厚,质地变硬(见图 1)。
注射无水乙醇30 d后,甲组注射区皮肤愈合良好,未观察到明显的增生组织,质地柔软,颜色粉红,较正常组织无明显厚度变化;乙组皮肤增生变厚,质地变硬,充血肿胀, 表皮颜色为绛紫色;丙组上皮已坏死剥脱,见皮下肌肉及脂肪组织(见图 2)。
注射无水乙醇90 d后,甲组注射区域已完全愈合,颜色、厚度、质地与正常皮肤无异;乙组大部分增生组织软化变扁平, 增生组织逐渐退化消失;丙组皮肤增生明显,皮肤溃烂面积较大,感染率较高,实验中有3只兔子死亡(见图 3)。
-
人正常皮肤组织上皮由多层细胞紧密排列而成,上皮基底侧有纤维结缔组织呈乳头状突入上皮,胶原纤维丰富,并有少量的皮肤附属器。兔正常皮肤组织上皮层以及上皮层的角化层较薄,皮肤附属器较多,且距离表皮较近,胶原纤维丰富(见图 4)。人类增生性瘢痕表皮层明显增厚,真皮层内胶原蛋白大量增生,纤维细胞数量增多,体积变大。实验兔子背部增生性组织,镜下可见创面真皮层中有大量成纤维细胞及排列致密的胶原纤维,纤维细胞增大,周围有灶性淋巴细胞浸润,浅层胶原纤维粗大,排列紊乱,皮肤附属器减少,类似人增生性瘢痕的镜下表现(见图 5)。
-
兔正常皮肤组织镜下可见组织内局灶分布的Ⅰ型胶原纤维染成淡黄色,Ⅰ型胶原纤维数量较少。兔背部增生组织镜下可见Ⅰ型胶原蛋白染成棕黄色,细胞质内可见棕黄色颗粒,Ⅰ型胶原纤维数量明显增多(见图 6)。
-
伤口愈合过程中,各种原因导致胶原的合成代谢与降解代谢之间的平衡被破坏,即可形成病理性瘢痕。瘢痕从外观和机体功能方面均可给病人带来心理和生理上的痛苦,严重者会影响病人自信心,使其产生自卑心理[4]。因此,建立良好的瘢痕动物模型是深入研究的基础,对研究结果的可靠性有重要影响。
但目前对于病理性瘢痕形成的具体发病机制仍不清楚, 由于动物与人皮肤结构的差异性, 以及类瘢痕样增生组织来源尚存在争议等原因, 目前尚无公认的比较理想的病理性瘢痕动物模型。建立稳定而有效的动物瘢痕模型成为瘢痕研究领域面临的重要任务,该模型应符合以下要求:(1)瘢痕体积尽可能大,由于模型建立后要进行瘢痕治疗研究,体积越大,越有利于后期的体积变化观察,且误差越小,而且能满足后续多项检测的需要;(2)稳定时间足够长,瘢痕的发展及治疗是一个长期的过程,短期维持的模型不仅治疗效果不明显,而且治疗效果也易与模型退化萎缩相混淆;(3)造模动物无其他特殊要求。考虑到经济成本,一般选择清洁级动物、SPF级动物。目前国内一般选用清洁级或SPF级的兔、豚鼠、小鼠、大鼠等作为皮肤瘢痕造模的动物[5-6]。
本研究显示,乙组中注射区皮肤组织增生明显,皮肤较厚,表面粗糙,质地较硬,持续时间约为60 d,且死亡率为0。HE染色镜下,兔背部增生组织的病理变化与人增生性瘢痕的病理变化基本一致;人类瘢痕的病理变化特点之一为Ⅰ型胶原为主的细胞外基质的过度沉积[7],而本实验中亦观察到乙组兔背部增生组织Ⅰ型胶原的数量较正常兔皮肤组织明显增多。综上,2 mL/kg无水乙醇注射组为3个实验组中结果最优的一组,可作为人增生性瘢痕组织动物模型,可一定程度上模拟人增生性瘢痕组织的病理生理特点。
本实验的优点主要有:(1)与本实验的造模方法操作简便,定量明确,容易掌握和重复。(2)兔的背部面积较大,操作空间较大,瘢痕形成稳定,利于进行深入的实验研究。(3)无水乙醇价格较低,实验成本低。本实验也存在一些局限性:(1)瘢痕组织持续时间与人类增生性瘢痕相比较短;(2)与其他实验动物如小鼠和豚鼠相比,兔子的成本较高。
兔背部皮下注射法建立增生性瘢痕动物模型
Establishment of a novel hypertrophic scar animal model by subcutaneous injection on the back of rabbits
-
摘要:
目的探索无水乙醇皮下注射后对皮肤外形及形态的影响,建立简便易重复的瘢痕动物模型。 方法选取体质量均为1.5 kg的新西兰大白兔27只,雌雄不限,随机分为甲、乙、丙3组。将浓度为99.5%的乙醇按照1、2、3 mL/kg 3种剂量分别注入甲、乙、丙3组兔子背部皮肤真皮层,观察注射后7、30、90 d注射位点的变化,得出最佳造模方法。 结果乙组兔子30 d后肉眼可见类似人增生性瘢痕样组织形成,HE染色镜下可观察到表皮层增厚明显,真皮层中胶原纤维排列紊乱,Ⅰ型胶原纤维免疫组织化学染色,可见组织内Ⅰ型胶原蛋白染成棕黄色,细胞质内可见棕黄色颗粒,Ⅰ型胶原纤维数量明显增多。 结论2 mL/kg无水乙醇兔子背部皮下注射,经自然愈合后形成的增生性瘢痕与人体增生性瘢痕相似, 可作为研究增生性瘢痕的发生机制及评估其治疗方法的动物模型之一。 Abstract:ObjectiveTo explore the effects of anhydrous alcohol by subcutaneous injection on the appearance and morphology of skin, and establish a simple and repeatable animal model of scar. MethodsTwenty-seven New Zealand white rabbits, weighing 1.5 kg, were randomly divided into the A group, B group and C group.The 99.5% alcohol was injected into the dorsal dermis of rabbits in A, B and C groups at the doses of 1, 2 and 3 mL/kg, respectively.The changes of injection sites at 7, 30 and 90 d were observed according to the POSAS scoring standard and microscopic appearance for finding out the best dose. ResultsThe tissue similar to human hypertrophic scar in B group was found at 30 d of injection.The HE staining showed the epidermal layer significantly thickened, and the collagen fiber arrangement disorderedin the dermis.The results of type Ⅰ collagen fiber IHC staining showed that the type Ⅰ collagen was stained for brown, and the brown granules were found in the cytoplasm, and the number of type Ⅰ collagen fibers increased significantly under the microscope. ConclusionsThe hypertrophic scar formed by 2 mL/kg anhydrous alcoholic by subcutaneous injection is similar to the human hypertrophic scar, and can be used as one of the animal models in studying the mechanism of hypertrophic scar and evaluating the treatment. -
Key words:
- scar /
- model, animal /
- anhydrous alcohol /
- rabbit
-
[1] HAVERSTOCK BD.Hypertrophic scars and keloids[J]. Clin Podiatr Med Surg, 2001, 18(1): 147. [2] MORRIS DE, WU L, ZHAO LL, et al. Acute and chronic animal models for excessive dermal scarring: quantitative studies[J]. Plastic Reconstr Surg, 1997, 100(3): 674. doi: 10.1097/00006534-199709000-00021 [3] 李荟元, 刘建波, 兰海. 建立增生性瘢痕动物实验模型[J]. 第四军医大学学报, 1998, 19(6): 655. doi: 10.3321/j.issn:1000-2790.1998.06.018 [4] 中国临床瘢痕防治专家共识制定小组. 中国临床瘢痕防治专家共识[J/CD]. 中华损伤与修复杂志: 电子版, 2017, 12(6): 401. [5] 晋小荣, 李文文, 任志英, 等. 皮肤瘢痕造模的研究概况[J]. 湖南中医杂志, 2016, 32(8): 231. [6] 周思政, 李青峰. 皮肤创伤愈合和增生性瘢痕动物模型的研究进展[J]. 组织工程与重建外科, 2018, 14(1): 48. doi: 10.3969/j.issn.1673-0364.2018.01.013 [7] 王少华, 曹广信, 王燕华, 等. 病理性瘢痕中结缔组织生长因子的免疫组化研究[J]. 中国美容医学, 2007, 16(8): 1032. doi: 10.3969/j.issn.1008-6455.2007.08.004 -





 下载:
下载: