-
纺锤体组装检查点(spindle assembly checkpoint,SAC)是细胞周期调控中的众多检查点之一,有助于维持细胞有丝分裂期间基因组稳定性,SAC结构功能异常是导致染色体不稳定性与非整倍体的重要原因之一,Mad2、Bub1、BubR1是SAC中的关键组分。
叶酸是一碳代谢循环中重要的甲基供体,在DNA合成、稳定性及修复中起关键作用。其缺乏会导致DNA损伤、染色体和基因组不稳定等。叶酸缺乏会对损坏SAC网络,从而致使细胞发生有丝分裂异常与非整倍性[1],但是非整倍体发生的机制尚不明确且叶酸缺乏对SAC影响的报道较少。本研究通过探索不同浓度叶酸对L02细胞增殖、凋亡及Mad2、Bub1、BubR1 mRNA及蛋白水平的影响,并讨论可能的作用机制。
-
L02细胞(武汉普诺赛细胞库);无叶酸RPMI-1640培养基、胎牛血清(Gibco公司);叶酸粉末(Sigma公司);Annexin V-FITC/PI试剂盒、细胞周期试剂盒、BCA蛋白定量试剂盒、RIPA裂解液、PMSF(江苏碧云天生物有限公司);Mad2、Bub1、BubR1抗体(美国Bethyl公司);β-actin抗体(Cell Signaling Technology公司);辣根过氧化物酶标记的山羊抗兔IgG抗体、辣根过氧化物酶标记的山羊抗鼠IgG抗体(武汉博士德生物工程有限公司);荧光定量PCR试剂盒(Takara公司);Mad2、Bub1、BubR1引物(上海生工生物有限公司)。
-
将L02细胞培养于含5%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2的细胞培养箱中。将细胞分为正常对照组和不同浓度叶酸组(分别给予200 nmol/L、20 nmol/L和0 nmol/L叶酸处理2周)。
-
倒置显微镜下观察不同浓度叶酸培养2周后的L02细胞形态。
-
将培养第12天的L02细胞按3.0×103个/孔接种于96孔板,各组3孔,过夜贴壁后,每孔加入10 μL CCK8试剂后置于培养箱中培养2 h,并于450 mm处检测吸光度(OD)值。
-
将培养2周的L02细胞以5×105个/mL接种于6孔板中,收集细胞;按照说明书进行PI染色,流式细胞仪上机检测。
-
将培养2周的L02细胞以5×105个/mL接种于6孔板中,收集细胞;按照说明书进行Annexin V-FITC/PI进行染色,流式细胞仪上机检测。
-
收集各组细胞,TRIzol法提取细胞总RNA,按照Takara的反转录试剂盒合成cDNA,PCR扩增Mad2、Bub1、BubR1。根据GenBank上公布的人类Mad2、Bub1、BubR1序列,应用Primer Primer5软件设计引物,由上海生工生物工程公司合成(见表 1)。同一标本β-actin作为内参照,采用2-ΔΔCT法进行相对定量分析。qRT-PCR的反应条件: 95 ℃ 15 s,60 ℃ 34 s,72 ℃ 30 s,40个循环。
名称 引物序列 β-actin Forward: AAT CTG GCA CCA CAC CT TCT A Reverse: ATA GCA CAG CCT GGA TAG CAA Mad2 Forward: CGT GCT GCG TCG TTA CTT TT Reverse: GCC GAA TGA GAA GAA CTC GG Bub1 Forward: TGT CCT TCA ATA CAT ACA GTG GGT Reverse: AGG TCA CTG TTG TAC TCA GCA A BubR1 Forward: TCA GCG GCT TTC GGA CTG Reverse: ACA ATT CAC CAT CTT TTA GCT CAG 表 1 引物序列
-
收集各组细胞,用RIPA裂解液进行裂解,BCA蛋白定量后调整蛋白浓度,取适量蛋白进行SDS-PAGE电泳。电转到PVDF膜,用5%脱脂牛奶封闭室温封闭2 h。室温孵育一抗Mad2、Bub1和BubR1(1∶ 1 000稀释)1 h,洗膜3次,室温孵育相应二抗1 h,细洗膜3次。ECL显色后置于凝胶成像仪中曝光,Image J进行灰度值分析。
-
采用方差分析和q检验。
-
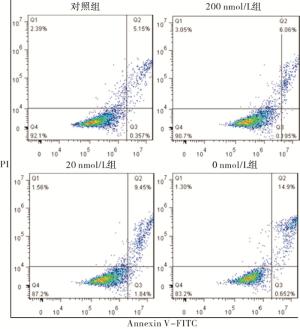
与正常对照组相比,20 nmol/L与0 nmol/L叶酸培养2周后,细胞体积增大、形态不规则,0 nmol/L叶酸组现象更加显著(见图 1)。
-
与正常对照组相比,200 nmol/L、20 nmol/L组与0 nmol/L细胞活性明显降低(P < 0.01);与200 nmol/L相比,20 nmol/L与0 nmol/L组细胞活性明显降低(P < 0.01)(见表 2)。
分组 n 第13天OD值 第14天OD值 第15天OD值 F P MS组内 对照组 3 0.26±0.01 0.42±0.04 1.22±0.06 449.439 < 0.01 0.000 200 nmol/L组 3 0.23±0.01* 0.40±0.04 0.85±0.04** 272.126 < 0.01 0.000 20 nmol/L组 3 0.21±0.01**## 0.36±0.01* 0.68±0.07**## 96.650 < 0.01 0.002 0 nmol/L组 3 0.19±0.01**##Δ 0.28±0.01**##Δ 0.50±0.03**##ΔΔ 242.502 < 0.01 0.000 F — 31.77 11.96 104.21 — — — P — < 0.01 < 0.01 < 0.01 — — — MS组内 — 0.000 0.001 0.003 — — — q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较##P < 0.01;与20 nmol/L组比较ΔP < 0.05,ΔΔP < 0.01 表 2 不同浓度叶酸培养2周后对细胞增殖能力(OD450值)的影响(x±s)
-
与正常对照组相比,200 nmol/L组细胞G1/G0期、S期均值差异无统计学意义(P>0.05);20 nmol/L组和0 nmol/L组细胞G1/G0期明显降低(P < 0.01)、S期明显升高(P < 0.01)。与200 nmol/L相比,20 nmol/L组和0 nmol/L组细胞G1/G0期明显降低(P < 0.01)、S期明显升高(P < 0.01)。与20 nmol/L组相比,0 nmol/L组S期明显增加、G1/G0期明显减少(P < 0.01)(见表 3)。
分组 n G0/G1期 S期 对照组 3 65.13±2.25 31.39±0.84 200 nmol/L组 3 63.23±2.56 34.29±2.50 20 nmol/L组 3 57.50±0.79**## 39.01±0.16**## 0 nmol/L组 3 50.03±1.39**##ΔΔ 48.52±1.70**##ΔΔ F — 39.07 68.55 P — < 0.01 < 0.01 MS组内 — 3.539 2.464 q检验:与对照组比较**P < 0.01;与200 nmol/L组比较##P < 0.01;与20 nmol/L组比较ΔΔP < 0.01 表 3 不同浓度叶酸培养2周后对细胞周期的影响(x±s; %)
-
与正常对照组相比,200 nmol/L组细胞凋亡率差异无统计学意义(P>0.05);20 nmol/L组细胞发生凋亡(P < 0.05),0 nmol/L组细胞明显发生凋亡(P < 0.01)。与200 nmol/L相比,20 nmol/L组细胞凋亡率差异无统计学意义(P>0.05),0 nmol/L组凋亡率明显增加(P < 0.01)。与20 nmol/L组相比,0 nmol/L组凋亡率明显增加(P < 0.01)(见图 2、表 4)。
分组 n 细胞凋亡率 对照组 3 6.34±0.72 200 nmol/L组 3 7.78±1.39 20 nmol/L组 3 10.25±1.44* 0 nmol/L组 3 16.16±4.13**##ΔΔ F — 23.64 P — < 0.01 MS组内 — 2.382 q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较##P < 0.01;与20 nmol/L组比较ΔΔP < 0.01 表 4 不同浓度叶酸培养2周后对细胞凋亡的影响(x±s; %)
-
与正常对照组相比,叶酸浓度为200 nmol/L时,Bub1 mRNA的表达量增加(P < 0.05), Mad2和BubR1 mRNA的表达量明显增加(P < 0.01);叶酸浓度为20 nmol/L及0 nmol/L时,Mad2、Bub1、BubR1 mRNA的表达量均明显增加(P < 0.01)(见表 5)。
分组 n Mad2 Bub1 BubR1 对照组 3 1.00±0.01 1.00±0.01 1.02±0.03 200 nmol/L组 3 1.54±0.13** 1.48±0.09* 3.5±0.84** 20 nmol/L组 3 2.59±0.23**## 2.10±0.42**# 4.02±0.53** 0 nmol/L组 3 3.28±0.26**## 2.22±0.23**## 4.62±0.41**# F — 91.23 16.32 26.01 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.034 0.059 0.289 q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较#P < 0.05,##P < 0.01 表 5 不同浓度叶酸培养2周后对SAC相关基因表达的影响(x±s)
-
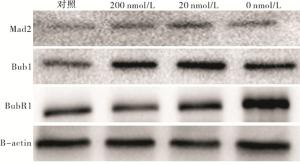
与正常对照组相比,200 nmol/L组Bub1蛋白表达量增加(P < 0.05),20 nmol/L、0 nmol/L组Bub1蛋白表达量明显增加(P < 0.01);200 nmol/L、20 nmol/L和0 nmol/L组Mad2和BubR1蛋白表达量均明显增加(P < 0.01)(见图 3、表 6)。
分组 n Mad2 Bub1 BubR1 对照组 3 0.54±0.03 0.77±0.06 0.54±0.03 200 nmol/L组 3 0.90±0.07** 1.23±0.09* 1.06±0.07** 20 nmol/L组 3 1.05±0.06**# 1.37±0.17** 1.13±0.11** 0 nmol/L组 3 0.97±0.06** 1.38±0.30** 1.35±0.16**#Δ F — 48.80 7.44 31.99 P — < 0.01 < 0.05 < 0.01 MS组内 — 0.003 0.033 0.011 q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较#P < 0.05;与20 nmol/L组比较ΔP < 0.05 表 6 不同浓度叶酸培养2周后对SAC相关蛋白表达的影响(x±s)
-
相关实验研究显示[2]叶酸浓度为120 nmol/L时便可维持人淋巴细胞基因组结构稳定,因此本实验选取略高于基因组稳定的叶酸浓度即200 nmol/L、20 nmol/L、0 nmol/L作为实验组。CCK8结果显示叶酸浓度为200 nmol/L、20 nmol/L、0 nmol/L时叶酸增殖受到了明显抑制,细胞周期与凋亡结果显示,叶酸浓度为200 nmol/L时,L02细胞G1/G0期、S期及凋亡率均值与正常对照组差异无统计学意义。叶酸浓度为20 nmol/L、0 nmol/L细胞发生S期阻滞,凋亡数量增多,且叶酸浓度越低S期阻滞越明显、细胞凋亡数量越多。COURTEMANCHE等[3]的研究显示叶酸缺乏可以降低细胞增殖,诱导凋亡和细胞周期阻滞,本研究与上述研究结果相符合。LIANG等[4-5]研究表明叶酸缺乏诱导细胞发生G1/G0期阻滞,从而导致细胞发生凋亡,在G1/G0期阻滞与凋亡之间建立了联系。HUANG等[6]研究结果显示在叶酸缺乏的培养基中HepG2细胞叶酸浓度较低,细胞在S期积累随后发生G2/M期阻滞,进而诱导细胞发生凋亡。低叶酸缺诱导的DNA的损伤程度具有凋亡反应,这是叶酸缺乏引起细胞凋亡的原因之一。本研究中,当叶酸浓度为20 nmol/L、0 nmol/L时细胞发生S期阻滞,进而诱导细胞发生凋亡。本研究与上述研究结果有所不同,本研究结果显示叶酸缺乏时细胞发生S期阻滞,我们认为差生差异的原因可能是由于所用细胞系、培养细胞时间不同造成的。
SAC作为细胞周期检查点对于维持细胞周期正常进行至关重要,Bub1参与染色体排列,Mad2和BubR1通过结合底物CDC20,阻止CDC20激活APC/C以达到抑制APC/C的效果,防止细胞提前进入后期。SAC作为细胞周期的监控机制,其某些成分的异常表达会使SAC功能发生改变,导致染色体不稳定和非整倍体。对果蝇和小鼠的研究均证实了SAC在维持染色体稳定方面的重要性[7-11],在SAC发生突变的细胞中,有丝分裂错误的发生率很高,导致非整倍体细胞的比例急剧增加[11-12]。在一项宫颈癌研究中[13]发现,下调Mad2和BubR1可以促进SiHa细胞增长,增强细胞侵袭和迁移能力,抑制细胞凋亡,降低药物治疗作用[13]。并且下调Mad2可以通过调控磷酸化survivin的活化,调控胃癌细胞周期,增加增殖,提高胃癌细胞的耐药性[14]。另一项对乳腺癌研究[15]中,与KrasG12D或Her2同时在成年小鼠乳腺中过表达有丝分裂检查点蛋白Mad2,会导致有丝分裂检查点过度激活,过早的Mad2表达会导致强烈的有丝分裂停止和细胞死亡增加。用特异性的小干扰RNA敲低纺锤体检查点蛋白BubR1或Mad2,可显著减少6, 7-二甲氧基-3-(3-甲氧基苯基)异喹啉-1-胺(CWJ-082)诱导的有丝分裂细胞积累和凋亡[16]。印度的一项药物研究[17]也显示,过表达的Mad2通过恢复适当的后期启动和维持更多的细胞存活,部分地挽救了药物的有害作用。在肝细胞性癌组织和细胞中,miR-490-5p的过表达或Bub1的过表达抑制了肝细胞性癌细胞的增殖、迁移、侵袭,增加了凋亡率[18]。缺少Bub1的小鼠胚胎成纤维细胞不能使其染色体对齐或维持SAC功能[19]。本研究结果显示,叶酸浓度为200 nmol/L、20 nmol/L和0 nmol/L时Mad2、Bub1、BubR1 mRNA的表达量明显增加,Western blotting检测也显示在蛋白水平上Mad2、Bub1、BubR1表达量明显增加。
结合上述研究和实验结果我们得出这样一个结论:对于SAC来说叶酸浓度为200 nmol/L已经达到一种缺乏状态,Mad2、Bub1、BubR1的高表达用于增加SAC的活性,可以维持细胞有丝分裂进行,避免细胞发生凋亡。当叶酸极度缺乏时(20 nmol/L和0 nmol/L),SAC功能活性受到了严重损害,Mad2、Bub1、BubR1的高表达不足以维持其正常活性,有丝分裂出现异常,可能导致非整倍体及染色体不稳定的发生,使得细胞增殖受到抑制,细胞周期发生阻滞,诱导细胞发生凋亡。综上所述,本研究结果显示,对于L02细胞来说叶酸浓度为200 nmol/L时已经达到一种缺乏状态,叶酸缺乏时SAC功能异常,可能是阻碍细胞增殖、诱导凋亡的原因。
叶酸缺乏对L02细胞增殖、凋亡及纺锤体组装检查点相关蛋白表达的影响
Effects of folate deficiency on proliferation, apoptosis and expression of spindle assembly checkpoint-related proteins in L02 cells
-
摘要:
目的探讨叶酸缺乏对L02细胞增殖、凋亡以及纺锤体组装检查点相关蛋白基因表达的影响及其机制。 方法用不同浓度的叶酸(200 nmol/L、20 nmol/L、0 nmol/L)培养L02细胞2周后,用倒置显微镜观察L02细胞形态;流式细胞术检测细胞周期与凋亡;CCK8测定细胞增殖情况;qRT-PCR检测Mad2、Bub1、BubR1 mRNA的表达;Western blotting检测相关蛋白Mad2、Bub1、BubR1的表达。 结果与正常对照组相比,叶酸缺乏使L02细胞出现细胞体积变大、形态不规则现象;叶酸缺乏可降低L02细胞活性(P < 0.01),诱导细胞发生S期阻滞(P < 0.05),促进细胞凋亡(P < 0.05),上调Mad2、Bub1、BubR1 mRNA及蛋白水平(P < 0.01)。 结论在L02细胞培养中,叶酸浓度为200 nmol/L时导致叶酸缺乏,SAC功能受损,细胞增殖异常,严重缺乏时导致细胞发生凋亡。 Abstract:ObjectiveTo investigate the effect of folate deficiency on the proliferation, apoptosis, expression of spindle assembly checkpoint-related proteins, and its mechanism in L02 cells. MethodsL02 cells were cultured with different concentrations of folate(2 000, 200, 20, 0 nmol/L) for 2 weeks.Then the morphology of L02 cells was observed by inverted microscope, the cell cycle and apoptosis were detected by flow cytometry, cell proliferation was measured by CCK8, the expressions of Mad2, Bub1, BubR1 mRNA were detected by fluorescence quantitative PCR, and the expressions of Mad2, Bub1, BubR1 protein were analyzed by Western blotting. ResultsCompared with the normal control group, folate deficiency made L02 cells to become larger and irregular in shape, reduced the cell viability(P < 0.01), induced S-phase block(P < 0.05), promoted apoptosis(P < 0.05), and upregulated the mRNA and protein expressions of Mad2, Bub1, BubR1 in L02 cells(P < 0.01). ConclusionsIn the culture L02 cells, it induces folate deficiency at 200 nmol/L folate, which causes impaired spindle assembly checkpoint function, abnormal cell proliferation, and even apoptosis in severe deficiency. -
Key words:
- cell cycle /
- folate /
- spindle assembly checkpoint /
- aneuploidy
-
表 1 引物序列
名称 引物序列 β-actin Forward: AAT CTG GCA CCA CAC CT TCT A Reverse: ATA GCA CAG CCT GGA TAG CAA Mad2 Forward: CGT GCT GCG TCG TTA CTT TT Reverse: GCC GAA TGA GAA GAA CTC GG Bub1 Forward: TGT CCT TCA ATA CAT ACA GTG GGT Reverse: AGG TCA CTG TTG TAC TCA GCA A BubR1 Forward: TCA GCG GCT TTC GGA CTG Reverse: ACA ATT CAC CAT CTT TTA GCT CAG 表 2 不同浓度叶酸培养2周后对细胞增殖能力(OD450值)的影响(x±s)
分组 n 第13天OD值 第14天OD值 第15天OD值 F P MS组内 对照组 3 0.26±0.01 0.42±0.04 1.22±0.06 449.439 < 0.01 0.000 200 nmol/L组 3 0.23±0.01* 0.40±0.04 0.85±0.04** 272.126 < 0.01 0.000 20 nmol/L组 3 0.21±0.01**## 0.36±0.01* 0.68±0.07**## 96.650 < 0.01 0.002 0 nmol/L组 3 0.19±0.01**##Δ 0.28±0.01**##Δ 0.50±0.03**##ΔΔ 242.502 < 0.01 0.000 F — 31.77 11.96 104.21 — — — P — < 0.01 < 0.01 < 0.01 — — — MS组内 — 0.000 0.001 0.003 — — — q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较##P < 0.01;与20 nmol/L组比较ΔP < 0.05,ΔΔP < 0.01 表 3 不同浓度叶酸培养2周后对细胞周期的影响(x±s; %)
分组 n G0/G1期 S期 对照组 3 65.13±2.25 31.39±0.84 200 nmol/L组 3 63.23±2.56 34.29±2.50 20 nmol/L组 3 57.50±0.79**## 39.01±0.16**## 0 nmol/L组 3 50.03±1.39**##ΔΔ 48.52±1.70**##ΔΔ F — 39.07 68.55 P — < 0.01 < 0.01 MS组内 — 3.539 2.464 q检验:与对照组比较**P < 0.01;与200 nmol/L组比较##P < 0.01;与20 nmol/L组比较ΔΔP < 0.01 表 4 不同浓度叶酸培养2周后对细胞凋亡的影响(x±s; %)
分组 n 细胞凋亡率 对照组 3 6.34±0.72 200 nmol/L组 3 7.78±1.39 20 nmol/L组 3 10.25±1.44* 0 nmol/L组 3 16.16±4.13**##ΔΔ F — 23.64 P — < 0.01 MS组内 — 2.382 q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较##P < 0.01;与20 nmol/L组比较ΔΔP < 0.01 表 5 不同浓度叶酸培养2周后对SAC相关基因表达的影响(x±s)
分组 n Mad2 Bub1 BubR1 对照组 3 1.00±0.01 1.00±0.01 1.02±0.03 200 nmol/L组 3 1.54±0.13** 1.48±0.09* 3.5±0.84** 20 nmol/L组 3 2.59±0.23**## 2.10±0.42**# 4.02±0.53** 0 nmol/L组 3 3.28±0.26**## 2.22±0.23**## 4.62±0.41**# F — 91.23 16.32 26.01 P — < 0.01 < 0.01 < 0.01 MS组内 — 0.034 0.059 0.289 q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较#P < 0.05,##P < 0.01 表 6 不同浓度叶酸培养2周后对SAC相关蛋白表达的影响(x±s)
分组 n Mad2 Bub1 BubR1 对照组 3 0.54±0.03 0.77±0.06 0.54±0.03 200 nmol/L组 3 0.90±0.07** 1.23±0.09* 1.06±0.07** 20 nmol/L组 3 1.05±0.06**# 1.37±0.17** 1.13±0.11** 0 nmol/L组 3 0.97±0.06** 1.38±0.30** 1.35±0.16**#Δ F — 48.80 7.44 31.99 P — < 0.01 < 0.05 < 0.01 MS组内 — 0.003 0.033 0.011 q检验:与对照组比较*P < 0.05,**P < 0.01;与200 nmol/L组比较#P < 0.05;与20 nmol/L组比较ΔP < 0.05 -
[1] GUO X, NI J, ZHU Y, et al. Folate deficiency induces mitotic aberrations and chromosomal instability by compromising the spindle assembly checkpoint in cultured human colon cells[J]. Mutagenesis, 2017, 32(6): 547. doi: 10.1093/mutage/gex030 [2] WANG X, FENECH M. A comparison of folic acid and 5-methyltetrahydrofolate for prevention of DNA damage and cell death in human lymphocytes in vitro[J]. Mutagenesis, 2003, 18(1): 81. doi: 10.1093/mutage/18.1.81 [3] COURTEMANCHE C, HUANG A, ELSON-SCHWAB I, et al. Folate deficiency and ionizing radiation cause DNA breaks in primary human lymphocytes: a comparison[J]. FASEB J, 2004, 18(1): 209. doi: 10.1096/fj.03-0382fje [4] LIANG Y, LI Y, LI Z, et al. Mechanism of folate deficiency-induced apoptosis in mouse embryonic stem cells: Cell cycle arrest/apoptosis in G1/G0 mediated by microRNA-302a and tumor suppressor gene Lats2[J]. Int J Biochem Cell Biol, 2012, 44(11): 1750. doi: 10.1016/j.biocel.2012.07.014 [5] YANG Y, LI X, SUN Q, et al. Folate deprivation induces cell cycle arrest at G0/G1 phase and apoptosis in hippocampal neuron cells through down-regulation of IGF-1 signaling pathway[J]. Int J Biochem Cell Biol, 2016, 79: 222. doi: 10.1016/j.biocel.2016.08.040 [6] ALARCON-VARGAS D, RONAI Z. P53-Mdm2-the affair that never ends[J]. Carcinogenesis, 2002, 23(4): 541. doi: 10.1093/carcin/23.4.541 [7] MICHEL L, LIBERAL V, CHATTERJEE A, et al. MAD2 haplo insufficiency causes premature anaphase and chromosome instability in mammalian cell[J]. Nature, 2001, 409(6818): 355. doi: 10.1038/35053094 [8] BABU JR, JEGANATHAN KB, BAKER DJ, et al. Rae1 is an essential mitotic checkpoint regulator that cooperates with Bub3 to prevent chromosome missegregation[J]. J Cell Biol, 2003, 160(3): 341. doi: 10.1083/jcb.200211048 [9] BASU J, BOUSBAA H, LOGARINHO E, et al. Mutations in the essential spindle checkpoint gene bub1 cause chromosome missegregation and fail to block apoptosis in Drosophlia[J]. Cell Biol, 1999, 146(1): 13. doi: 10.1083/jcb.146.1.13 [10] DOBLES M, LIBERAL V, SCOTT M, et al. Chromosome missegregation and apoptosis in mice lacking the mitotic checkpoint protein mad2[J]. Cell, 2000, 101(6): 635. doi: 10.1016/S0092-8674(00)80875-2 [11] BAKER DJ, JEGANATHAN KB, CAMERON JD, et al. BubR1 insufficiency causes early onset of aging-associated phenotypes and infertility in mice[J]. Nat Genet, 2004, 36(7): 744. doi: 10.1038/ng1382 [12] SCHLIEKELMAN M, COWLEY DO, O'QUINN R, et al. Impaired Bub1 function in vivo compromises tension-dependent checkpoint function leading to aneuploidy and tumorigenesis[J]. Cancer Res, 2009, 69(1): 45. doi: 10.1158/0008-5472.CAN-07-6330 [13] WANG L, WANG J, JIN Y, et al. Downregulation of Mad2 and BubR1 increase the malignant potential and nocodazole resistance by compromising spindle assembly checkpoint signaling pathway in cervical carcinogenesis[J]. J Obstet Gynaecol Res, 2019, 45(12): 2407. doi: 10.1111/jog.14120 [14] WANG L, YIN F, DU Y, et al. Depression of MAD2 inhibits apoptosis and increases proliferation and multidrug resistance in gastric cancer cells by regulating the activation of phosphorylated survivin[J]. Tumour Biol, 2010, 31(3): 225. doi: 10.1007/s13277-010-0036-6 [15] ROWALD K, MANTOVAN M, PASSOS J, et al. Negative selection and chromosome instability induced by mad2 overexpression delay breast cancer but facilitate oncogene-independent outgrowth[J]. Cell Rep, 2016, 15(12): 2679. doi: 10.1016/j.celrep.2016.05.048 [16] CHUNG K, CHOI H, SHIN J, et al. 6, 7-Dimethoxy-3-(3-methoxyphenyl) isoquinolin-1-amine induces mitotic arrest and apoptotic cell death through the activation of spindle assembly checkpoint in human cervical cancer cells[J]. Carcinogenesis, 2013, 34(8): 1852. doi: 10.1093/carcin/bgt133 [17] DAS T, ROY KS, CHAKRABARTI T, et al. Withaferin A modulates the Spindle assembly checkpoint by degradation of Mad2-Cdc20 complex in colorectal cancer cell lines[J]. Biochem Pharmacol, 2014, 91(1): 31. doi: 10.1016/j.bcp.2014.06.022 [18] XU B, XU T, LIU H, et al. MiR-490-5p suppresses cell proliferation and invasion by targeting bub1 in hepatocellular carcinoma cells[J]. Pharmacology, 2017, 100(5/6): 269. [19] TILSTON V, TAYLOR SS, PERERA D. Inactivating the spindle checkpoint kinase Bub1 during embryonic development results in a global shutdown of proliferation[J]. BMC Res Notes, 2009, 2: 190. doi: 10.1186/1756-0500-2-190 -





 下载:
下载: