-
当前我国有15%左右的育龄夫妇面临不孕不育症的问题,而其中约一半因素由男性不育引起[1-2]。原发性无精子症(idiopathic azoospermia,IA)是指男性精液中表现出不明原因的无精子,而细胞遗传学和激素内分泌检查均正常[3-4]。IA是男性不育的最严重形式之一,发病率占男性不育的30%~40%[5]。尽管研究者在男性不育家族病例及动物模型中发现一些基因异常表达与IA密切相关,但IA的潜在机制仍不清楚。微小RNA(miRNA)是一类小的非编码RNA分子,通常由19~23个核苷酸构成,通过与目的基因信使RNA(mRNA)互补结合来降解或抑制目的基因翻译[6]。miRNA在生理和病理过程中具有广泛的功能,并已阐明其在调节精子发生方面亦发挥着重要作用[7]。一些miRNA可参与减数分裂中关键基因的沉默,当这些miRNA表达发生改变时则导致男性不育[8]。ZHUANG等[9]通过芯片发现51个miRNA在IA病人睾丸组织中表达上调,而42个miRNA表达下调,其中miR-186表达上调超过4倍。目前,关于miR-186与IA的相关性研究尚未见报道。本研究收集IA病人140例和正常生育的男性140名的外周血标本,旨在检测miR-186在2组外周中的表达水平,分析其与无精子症因子(AZF)微缺失的相关性,并评估其在IA诊断中的价值。
-
人外周血DNA及RNA提取试剂购于日本Takara公司,PCR引物购于美国Thermo Scientific公司,逆转录试剂购于德国Qiagen公司,实时荧光定量PCR试剂购于瑞士Roche公司,多重PCR试剂购于上海碧云天生物技术有限公司,琼脂糖凝胶购于美国Sigma-Aldrich公司。
-
收集2015-2017年在中国人民解放军第983医院泌尿外科就诊的IA病人(IA组)140例和正常生育的男性(对照组)140名的外周血标本5 mL。IA病人诊断标准:(1)连续三次精液样本中均未检测到精子; (2)无内分泌缺陷; (3)无生殖系统炎症、损伤及梗阻; (4)无核型异常。正常生育的男性诊断标准:至少育有一孩,且未行人类辅助生殖技术(ARTs)。IA组病人年龄20~51岁;对照组年龄18~56岁。本研究已获得所有参与者的书面知情同意,并已得到本单位医学伦理委员会批准。
-
根据DNA及RNA提取试剂说明书提取受试者外周血标本中的DNA和RNA。采用NanoDrop2000C型超微分光光度计测定各样本中DNA和RNA浓度,并用无RNA酶去离子水将各样本RNA浓度调定为1 μg/μL,随后放置-80 ℃超低温冰箱保存备用。
-
采用多重PCR试验检测样本中AZF微缺失。反应体系:基因组DNA 100 ng,10×缓冲液2.5 μL,上游和下游引物各1 μL,DNA聚合酶1 U,去离子补至25 μL。扩增条件:95 ℃ 3 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环,最后72 ℃延伸10 min。PCR扩增产物采用1.5%的琼脂糖凝胶电泳在60 V恒压下电泳20 min,随后利用凝胶成像系统观察结果。
-
取1 μg RNA进行逆转录合成cDNA。反应体系:RNA 1 μL,逆转录试剂5 μL和无RNA酶去离子水4 μL,反应总体积为10 μL。合成条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃ 30 min。随后将cDNA用无RNA酶去离子水稀释10倍后放置于-80 ℃冰箱中保存备用。
-
以cDNA为模版在ABI 7500型定量PCR仪上进行实时荧光定量PCR。反应体系:cDNA 1 μL,荧光定量PCR试剂10 μL,上游和下游引物各0.5 μL,去离子水8 μL,反应总体积为20 μL。反应条件:98 ℃ 10 min,随后98 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。miR-186引物:5′-TGC TTG TAA CTT TCC AA-3′和5′-AGC TCA AAC TTC CCA A-3′;小核RNA U6引物:5′-CCA TGC TCT TCT ACT CCT-3′和5′-CAC TGA TGT CGG TTA GTT-3′。以U6为内参,待PCR反应结束后,采用2-ΔΔCt法[10]计算各样本中miR-186的表达量。
-
采用t检验、χ2检验、Spearman相关分析和ROC分析。
-
2组年龄、体质量指数、睾酮水平及吸烟情况差异均无统计学意义(P>0.05)。IA组中8例病人存在AZF微缺失,微缺失率为5.71 %(8/140),而对照组未检测出AZF微缺失(P <0.05)(见表 1)。
分组 n 年龄/岁 体质量指数/
(kg/m2)睾酮水平/
(ng/dL)吸烟
情况AZF
微缺失对照组 140 30.42±4.89 23.66±2.30 364.92±63.78 48 0 IA组 140 31.06±5.17 23.48±2.65 377.16±55.41 52 8 t — 0.95 0.42 1.71 0.25△ 6.31* P — > 0.05 > 0.05 > 0.05 > 0.05 < 0.05 △示χ2值;*示校正χ2值 表 1 2组一般资料比较(x±s)
-
miR-186在对照组外周血中的表达量为0.28±0.21,而在IA组外周血中的表达量为0.75±0.42,2组间miR-186表达量差异有统计学意义(t=11.84,P <0.01)。
-
根据IA组中病人AZF微缺失情况,将其分为AZF微缺失组(n=8)和非AZF微缺失组(n=132)。miR-186在AZF微缺失组中的表达量为0.76±0.24,而在非AZF微缺失组中的表达量为0.72±0.40,2组间miR-186表达差异无统计学意义(t=0.28,P>0.05)。Spearman相关分析显示,外周血中miR-186的表达与AZF微缺失无相关性(P>0.05)。
-
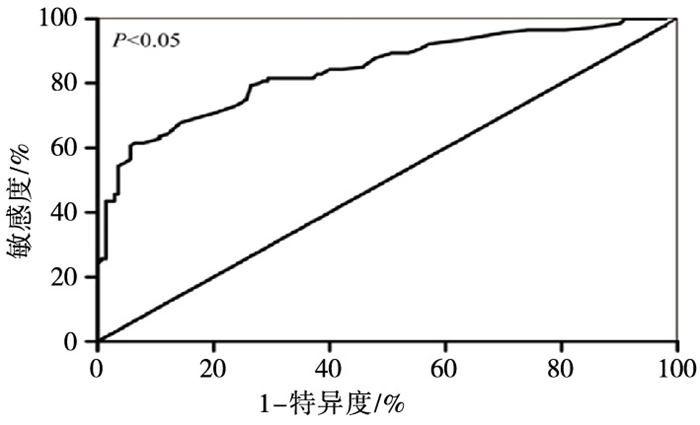
采用ROC曲线评价外周血中miR-186表达对IA的诊断价值。miR-186的ROC曲线下面积为0.84(95% CI: 0.794~0.886)。当miR-186表达量为0.52时为最佳诊断分界点,敏感度为71.86 %,特异度为80.39 %(见图 1)。
-
临床大部分男性不育病人表现为无精子症,包括IA和梗阻性无精子症[3-4]。近几十年来,尽管ARTs在治疗IA方面取得了巨大的进展,但ARTs过程中引起的遗传异常可能对受精卵产生严重影响。因此,完全有必要阐明IA发生的遗传机制,并开发IA表型筛选新的分子标志物。miRNA是一类小的非编码RNA分子,它通过碱基配对方式结合mRNA在调节转录后基因沉默中发挥关键作用[6]。一些miRNA在小鼠睾丸中特定或高表达,提示这些miRNA可能在精子发生中起重要作用[7]。例如,LIAN等[11]利用miRNA芯片发现IA病人睾丸组织中有154个miRNA呈差异性下调,而19个miRNA呈差异性上调,包括miR-302a、miR-491-3p、miR-520d-3p和miR-383等。WU等[12]通过全基因组miRNA表达谱分析发现miR-141、miR-429和miR-7-1-3p在IA病人精浆中的表达较正常男性显著增加。TANG等[13]报道隐睾病人睾丸组织和正常睾丸组织之间呈差异表达的miRNA,其中297个下调和175个上调的miRNA。鉴于上述研究,我们推测miRNA在IA病人外周血中亦存在差异表达。本研究发现,miR-186在IA病人外周血中呈高表达。
miR-186位于人染色体1p31.1区域,既然研究表明miR-186在肿瘤、慢性阻塞性肺疾病、关节炎、缺血性卒中及阿尔茨海默氏病中异常表达并发挥重要作用[14-15]。例如,miR-186在皮肤鳞状细胞癌中表达上调并促进肿瘤生长[16]。miR-186在氧糖剥夺/再灌注模型中显著上调并诱导细胞凋亡[17]。目前关于miR-186在生殖方面的报道较少。CHEN等[18]发现91个miRNA在猪精子中表达上调,而108个miRNA表达下调,其中miR-10a-5p、miR-125b、let-7f和miR-186分别在精原细胞、粗线期精母细胞、圆形精子细胞和精子中高表达。ZHUANG等[9]报道miR-186在IA病人睾丸组织中表达较对照组显著升高。鉴于上述二种不同的研究结果,本研究收集IA病人140例和正常生育的男性140名的外周血标本,采用实时荧光定量PCR分析miR-186在2组外周血中的表达水平,发现miR-186在IA组外周血中的表达量较对照组显著升高。该结果与ZHUANG等[9]报道的一致,证实miR-186在IA病人外周血中呈高表达。
Y染色体上的遗传构成对男性性别决定和正常的精子发生十分关键。Y染色体q11.23区域因控制许多参与精子发生的基因,故该区域又称为AZF。研究发现,AZF微缺失导致的精子发生障碍是IA的一个重要因素[19]。本研究通过多重PCR试验发现,140例IA病人中8例存在AZF微缺失,微缺失率为5.71%(8/140)。该结果与文献报道的结论基本一致,提示AZF微缺失是IA的一个重要因素[20]。为了分析miR-186的表达与AZF微缺失的关系。本研究将IA病人分为AZF微缺失组和非AZF微缺失组。实时荧光定量PCR显示,miR-186在AZF微缺失组和非AZF微缺失组中的表达量无统计学差异,且Spearman相关分析发现外周血中miR-186的表达与AZF微缺失无相关性。该结果表明miR-186表达与AZF微缺失无关,但考虑到本次AZF微缺失标本偏少,故该结论仍有待进一步的验证。近年来,研究发现miRNA在多种疾病中具有一定的诊断价值,并可作为新的分子靶点[21]。DUAN等[22]发现高表达的miR-210可作为隐睾诊断的新标志物。TSATSANIS等[23]报道外周血中miR-155可作为男性不育诊断的一种潜在生物标志物。本研究采用ROC曲线评价外周血中miR-186表达对IA的诊断价值,发现miR-186对IA具有较高的诊断价值,ROC曲线下面积为0.84,敏感度为71.86 %,特异度为80.39 %。
综上所述,本研究发现miR-186在IA病人外周血中呈高表达。外周血中miR-186的表达与AZF微缺失无相关性。外周血中高表达的miR-186对IA具有较高的诊断价值,表明miR-186可能作为一种新的IA诊断标志物。
微小RNA-186在原发性无精子症病人外周血中的表达及诊断价值
Expression and diagnostic value of microRNA-186 in peripheral blood of patients with idiopathic azoospermia
-
摘要:
目的检测微小RNA-186(miR-186)在原发性无精子症(IA)病人外周血中的表达量,并探讨其对IA的诊断价值。 方法收集2015-2017年在泌尿外科就诊的IA病人(IA组)140例和正常生育的男性(对照组)140名的外周血标本。常规提取外周血DNA和RNA,采用多重PCR试验检测无精子症因子(AZF)在2组间的微缺失情况。采用实时荧光定量PCR试验检测miR-186在2组间的表达差异。分析外周血中miR-186的表达与AZF微缺失的相关性。采用ROC分析评价外周血中miR-186表达对IA的诊断价值。 结果2组年龄、体质量指数、睾酮水平及吸烟情况差异均无统计学意义(P>0.05)。IA组中8例病人存在AZF微缺失(P < 0.05),微缺失率为5.71%(8/140),而对照组中未检测出AZF微缺失(P < 0.05)。miR-186在IA组外周血中的表达量较对照组明显升高(P < 0.01)。外周血中miR-186的表达与AZF微缺失无相关性(P>0.05)。miR-186对IA具有较高的诊断价值,ROC曲线下面积为0.84(95% CI:0.794~0.886),当miR-186表达量为0.52时为最佳诊断分界点,敏感度为71.86%,特异度为80.39%。 结论miR-186在IA病人外周血中高表达,但与AZF微缺失无相关性。外周血中高表达的miR-186可能作为IA的一种新的诊断标志物。 Abstract:ObjectiveTo detect the expression levels of microRNA-186(miR-186) in the peripheral blood of patients with idiopathic azoospermia(IA), and investiagte its diagnostic value for IA. MethodsThe peripheral blood samples from 140 IA patients from 2015 to 2017 in urology department and 140 normal fertile men were divided into the IA group and control group, respectively.The DNA and RNA in two groups were routinely extracted from peripheral blood, and the microdeletion of azoospermia factor(AZF) in two groups were detected using multiplex PCR.The expression levels of miR-186 in two groups were detected using quantitative real-time PCR.The correlation between miR-186 expression and AZF microdeletion in peripheral blood was analyzed.The diagnostic value of miR-186 for IA in peripheral blood was evaluated by ROC analysis. ResultsThe differences of the age, body mass index, testosterone level and smoking status were not statistically significant between two groups(P>0.05).Eight patients with AZF microdeletion in the IA group were found, and the microdeletion rate of which was 5.71%(8/140), while no AZF microdeletion was detected in the control group(P>0.05).The expression level of miR-186 in IA group was significantly higher than that in control group(P < 0.01).The miR-186 expression in peripheral blood was not correlated with AZF microdeletion(P>0.05).The miR-186 had a higher diagnosis value for IA, and the area under the ROC curve was 0.84(95% CI: 0.79 to 0.87).The expression level of miR-186 at 0.52 was the best diagnostic cut-off point, and the sensitivity and specificity were 71.86% and 80.39%, respectively. ConclusionsThe expression level of miR-186 is high in the peripheral blood of IA patients, but its expression is not correlated with AZF microdeletion.High expression of miR-186 in peripheral blood may serve as a new diagnostic biomarker for IA. -
Key words:
- idiopathic azoospermia /
- microRNA-186 /
- microdeletion /
- peripheral blood /
- biomarker
-
表 1 2组一般资料比较(x±s)
分组 n 年龄/岁 体质量指数/
(kg/m2)睾酮水平/
(ng/dL)吸烟
情况AZF
微缺失对照组 140 30.42±4.89 23.66±2.30 364.92±63.78 48 0 IA组 140 31.06±5.17 23.48±2.65 377.16±55.41 52 8 t — 0.95 0.42 1.71 0.25△ 6.31* P — > 0.05 > 0.05 > 0.05 > 0.05 < 0.05 △示χ2值;*示校正χ2值 -
[1] AGHAREZAEE N, HASHEMI M, SHAHANI M, et al. Male infertility, precision medicine and systems proteomics[J]. J Reprod Infertil, 2018, 19(4): 185. [2] KRAUSZ C, RIERA-ESCAMILLA A. Genetics of male infertility[J]. Nat Rev Urol, 2018, 15(6): 369. [3] MOU L, WANG Y, LI H, et al. A dominant-negative mutation of HSF2 associated with idiopathic azoospermia[J]. Hum Genet, 2013, 132(2): 159. doi: 10.1007/s00439-012-1234-7 [4] MATZUK MM, LAMB DJ. The biology of infertility: research advances and clinical challenges[J]. Nat Med, 2008, 14(11): 1197. [5] WOSNITZER M, GOLDSTEIN M, HARDY MP. Review of azoospermia[J]. Spermatogenesis, 2014, 4: e28218. doi: 10.4161/spmg.28218 [6] MOHR AM, MOTT JL. Overview of microRNA biology[J]. Semin Liver Dis, 2015, 35(1): 3. [7] PROCOPIO MS, DE AVELAR GF, COSTA GMJ, et al. MicroRNAs in Sertoli cells: implications for spermatogenesis and fertility[J]. Cell Tissue Res, 2017, 370(3): 335. [8] HAYASHI K, CHUVA DE SOUSA LOPES SM, KANEDA M, et al. MicroRNA biogenesis is required for mouse primordial germ cell development and spermatogenesis[J]. PLoS One, 2008, 3(3): e1738. [9] ZHUANG X, LI Z, LIN H, et al. Integrated miRNA and mRNA expression profiling to identify mRNA targets of dysregulated miRNAs in non-obstructive azoospermia[J]. Sci Rep, 2015, 5: 7922. [10] SCHMITTGEN TD, LIVAK KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6): 1101. [11] LIAN J, ZHANG X, TIAN H, et al. Altered microRNA expression in patients with non-obstructive azoospermia[J]. Reprod Biol Endocrinol, 2009, 7: 13. [12] WU W, QIN Y, LI Z, et al. Genome-wide microRNA expression profiling in idiopathic non-obstructive azoospermia: significant up-regulation of miR-141, miR-429 and miR-7-1-3p[J]. Hum Reprod, 2013, 28(7): 1827. [13] TANG D, HUANG Z, HE X, et al. Altered miRNA profile in testis of post-cryptorchidopexy patients with non-obstructive azoospermia[J]. Reprod Biol Endocrinol, 2018, 16(1): 78. [14] BEN HALIMA S, SIEGEL G, RAJENDRAN L. miR-186 in Alzheimer's disease: a big hope for a small RNA?[J]. J Neurochem, 2016, 137(3): 308. [15] LIN Z, TIAN XY, HUANG XX, et al. microRNA-186 inhibition of PI3K-AKT pathway via SPP1 inhibits chondrocyte apoptosis in mice with osteoarthritis[J]. J Cell Physiol, 2019, 234(5): 6042. [16] TIAN J, SHEN R, YAN Y, et al. miR-186 promotes tumor growth in cutaneous squamous cell carcinoma by inhibiting apoptotic protease activating factor-1[J]. Exp Ther Med, 2018, 16(5): 4010. [17] WANG R, BAO H, ZHANG S, et al. miR-186-5p promotes apoptosis by targeting IGF-1 in SH-SY5Y OGD/R model[J]. Int J Biol Sci, 2018, 14(13): 1791. [18] CHEN X, CHE D, ZHANG P, et al. Profiling of miRNAs in porcine germ cells during spermatogenesis[J]. Reproduction, 2017, 154(6): 789. [19] NAILWAL M, CHAUHAN JB. Azoospermia factor C subregion of the Y chromosome[J]. J Hum Reprod Sci, 2017, 10(4): 256. [20] KRAUSZ C, CASAMONTI E. Spermatogenic failure and the Y chromosome[J]. Hum Genet, 2017, 136(5): 637. [21] BACKES C, MEESE E, KELLER A. Specific miRNA disease biomarkers in slood, serum and plasma: challenges and prospects[J]. Mol Diagn Ther, 2016, 20(6): 509. [22] DUAN Z, HUANG H, SUN F. The functional and predictive roles of miR-210 in cryptorchidism[J]. Sci Rep, 2016, 6: 32265. [23] TSATSANIS C, BOBJER J, RASTKHANI H, et al. Serum miR-155 as a potential biomarker of male fertility[J]. Hum Reprod, 2015, 30(4): 853. -





 下载:
下载: