-
肺癌为高发病率、高致死率的恶性肿瘤,严重威胁着人类健康,在我国每年新检出病人人数约占世界总检出病人数的1/2[1]。非小细胞肺癌(NSCLC)占据所有肺癌病理类型的主导地位,近年来随着分子生物学的飞速发展,NSCLC的分子靶向治疗领域得到极大的推进,新型靶向药物不断涌现,但当前对NSCLC发生发展分子机制仍不完全清楚,有待我们进一步的研究,寻找新的基因治疗靶点、判断及影响预后的分子标志物有着重要意义。B细胞易位基因1(B-cell translocation gene 1, BTG1)是BTG/TOB基因家族之一,参与调控细胞周期进程,是新型肿瘤抑制基因[2-3]。在本实验中,我们应用免疫组织化学法检测NSCLC中BTG1的表达,旨在探讨NSCLC预后与BTG1表达之间的关系。现作报道。
-
选择2012年6-12月,在我院行手术切除的73例NSCLC病人资料进行本项研究。纳入病例均由病理学确诊为NSCLC,随访和临床资料完整,在手术前未施行化疗、放疗,其中,男40例,女33例;年龄38~74岁,中位年龄59岁。待术后即从标本肿瘤组织取材,用4%甲醛固定后再应用石蜡包埋,拟行免疫组织化学检测。依据2017年国际抗癌联盟(UICC)颁布第八版肺癌分期,Ⅰ+Ⅱ期31例,Ⅲ期42例;肺癌组织学分级Ⅰ级26例,Ⅱ+Ⅲ级47例。术后以电话、门诊复诊和再次住院治疗相结合方式随访病人≥5年或至病人死亡。
-
DAB显色试剂盒与SP免疫组织化学染色试剂盒均购买来自北京中杉金桥生物公司。
-
制作4 μm标本石蜡切片,将其脱蜡至水,内源性过氧化物酶由3%过氧化氢阻断10 min,20 min修复胰酶,山羊血清10%室温20 min封闭,4 ℃冰箱湿盒加入BTG1抗体(1∶100)过夜。滴入二抗、三抗,湿盒内室温下20 min孵育,DAB显色,苏木精复染,然后脱水,封片。2名高年资病理科医生在双盲情况下进行判定染色结果。高倍显微镜(×400)下计数细胞,每标本取3张切片每切片随机计数5个视野。BTG1蛋白的表达以阳性细胞百分率与染色强度得分之和进行综合判读:阴性(-),阳性细胞数百分比 < 5%,细胞未染色或染色极弱;阳性(+),阳性细胞数百分比≥5%,细胞被染成淡黄色、黄色乃至棕黄色。用PBS取代一抗为阴性对照。
-
采用χ2检验、log-rank检验,采用Kaplan-Meier法绘制生存曲线。
-
在73例NSCLC中BTG1蛋白阳性表达病人28例,阳性率为38.4%,BTG1表达阳性组与阴性组病人肿瘤直径、病理类型、性别、年龄差异均无统计学意义(P>0.05);BTG1蛋白表达阳性组与阴性组淋巴结转移率、病理分期、组织学分级差异均有统计学意义(P < 0.05~P < 0.01)(见表 1)。
参数 n BTG1蛋白表达情况 χ2 P 阴性 阳性 性别 男 40 24(60.0) 16(40.0) 0.10 >0.05 女 33 21(63.6) 12(36.4) 年龄/岁 ≤60 50 32(64.0) 18(36.0) 0.37 >0.05 >60 23 13(56.5) 10(43.5) 病理类型 鳞癌 24 17(70.8) 7(29.2) 1.27 >0.05 腺癌 49 28(57.1) 21(42.9) 肿瘤直径/cm ≤3 29 17(58.6) 12(41.4) 0.19 >0.05 >3 44 28(63.6) 16(36.4) 淋巴结转移 N0 27 12(44.4) 15(55.6) 5.36 < 0.05 N+ 46 33(71.7) 13(28.3) 分期 Ⅰ~Ⅱ 31 15(48.4) 16(51.6) 4.01 < 0.05 Ⅲ 42 30(71.4) 12(28.6) 组织学分级 Ⅰ 26 10(38.5) 16(61.5) 9.18 < 0.01 Ⅱ~Ⅲ 47 35(74.5) 12(25.5) 表 1 BTG1表达与NSCLC病人临床病理参数之间关系[n; 百分率(%)]
-
病人5年生存20例,生存率27.4%,BTG1表达阳性组5年生存率高于表达阴性组(P < 0.05)(见表 2)。
BTG1表达 n 死亡 生存 χ2 P 阴性 45 37(82.2) 8(17.8) 阳性 28 16(57.1) 12(42.9) 5.46 < 0.05 合计 73 53(72.6) 20(27.4) 表 2 BTG1表达与NSCLC病人5年生存之间关系[n; 百分率(%)]
-
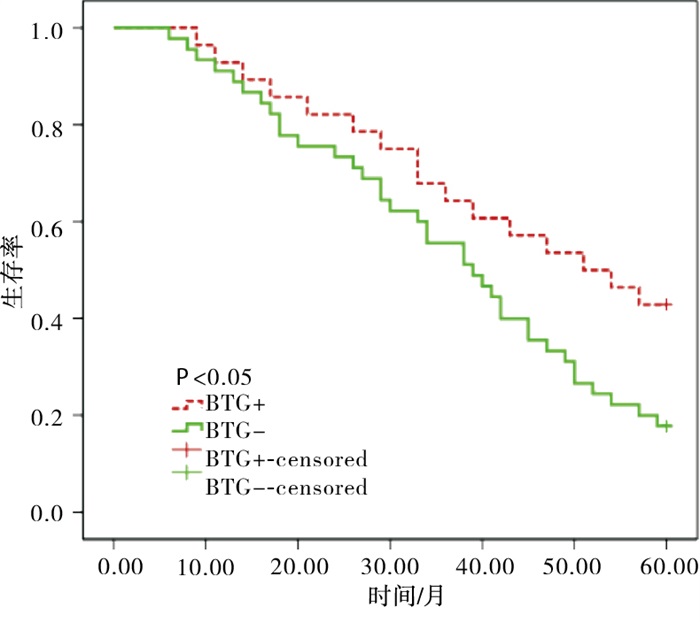
Kaplan-Meier法分析显示BTG1表达阴性病人的生存曲线较BTG1阳性病人下降更为陡峭,log-rank检验显示BTG1阳性与阴性病人生存曲线的差异存在统计学意义(χ2=4.50,P < 0.05)(见图 1)。
-
NSCLC发病率约占所有肺癌的80%[4],并且NSCLC发病程逐年上升趋势,具体的发病因素并不完全清楚,一般情况认为肺癌的发生发展有着众多因素参与及调控,其中包括癌症抑制基因失活、癌基因突变、修复DNA基因及调节凋亡基因改变等,是一个长时期的恶变过程。当抑癌基因出现突变或缺失等异常改变时,其会发生非正常的表达,从而对某些细胞增殖的调控作用常常会减弱或消失,这一作用机制的异常往往是导致恶性肿瘤发生发展的重要原因。NSCLC恶性程度高、侵袭力强,并且容易发生转移,对病人的预后产生严重影响。外科学、放射治疗学技术不断更新,化疗、生物治疗、分子靶向治疗等多种治疗方法及药物不断出现,NSCLC病人生存质量得到了一定提高,预后有所改善,但其治疗效果并不十分理想[5],局部复发及远处转移是影响病人预后的决定性因素,本研究中发现73例NSCLC病人中5年内死亡53例,死亡率为72.6%,所以寻求能够预示NSCLC预后的生物学指标相当重要。
BTG1基因的发现最初源于慢性B淋巴细胞白血病病人的易位基因之中,BTG1是髓系白血病治疗缓解的重要标志物[6]。众多研究[7-11]结果显示,BTG1表达量在喉癌、乳腺癌和卵巢癌组织中要显著低于正常对照组织,并且病人的肿瘤临床分期、组织学分级越差,BTG1蛋白的表达程度越低,BTG1在抗细胞增殖、诱导细胞凋亡、细胞周期演进的调节中扮演了重要的角色,在研究其分子机制体外实验中,通过调高BTG1在肿瘤细胞中的表达水平从而能够降低CyclinD1、CyclinB1、CyclinE1等细胞周期调节蛋白的表达,使抗凋亡蛋白Bcl-2、Bcl-xL、PI3K、survivin、AKT的表达减少、凋亡促进蛋白Bax、caspase-3表达增加,下调MMP-2、MMP-9、VEGF等的表达。BTG1高表达可以阻止或延缓肿瘤的发生及发展,其异常表达与恶性肿瘤发生和演进关系密切。精氨酸N-甲基转移酶1(PRMT1)能够通过结合BTG1而导致自身的激活[12],激活后的PRMT1能够调控基因的甲基化,使相关基因的表达受到显著影响,与肿瘤的发生存在关联[13]。BTG1还参与脂多糖和γ-干扰素作用,通过JAK/STAT1通路诱导的细胞凋亡[14]。
本实验分析显示,病人BTG1蛋白表达水平与NSCLC的肿瘤直径、病理类型及该病人的性别、年龄无关,而与肿瘤病理分期、组织学分级、区域淋巴结转移情况呈负相关,提示BTG1可能在降低NSCLC细胞的恶性侵袭能力发挥着重要作用,从而延缓NSCLC的发生和发展。有体外实验研究[15]显示,经转染而明显提高了BTG1表达量的肺癌H1299细胞株抗凋亡蛋白Bcl-2、基质金属蛋白酶MMP-9表达显著减少,从而使得转基因的H1299细胞增殖受到抑制,生长增殖显著受抑制,凋亡明显增多,侵袭及转移能力减弱。综合以上的研究显示BTG1是NSCLC的抑制基因。本研究显示NSCLC病人5年生存率与BTG1表达状态明显相关,在BTG1阳性表达的病人中其5年生存率达到42.9%,明显优于BTG1阴性表达病人,其差异存在统计学意义,遂可以将其用作指示病人预后的指标。
综上所述,本研究显示BTG1表达高低差异与病人预后紧密相关,BTG1低表达或不表达可以作病人预后的不良指标,可考虑对高危病人密切随访,从而及时给予干预,有助于延长病人总生存期。
B细胞易位基因1在非小细胞肺癌中的表达及与预后的关系
Expression of BTG1 in non-small cell lung cancer and its relationship with prognosis
-
摘要:
目的探讨B细胞易位基因1(BTG1)在非小细胞肺癌(NSCLC)组织中的表达情况及与预后的相关性。 方法采用免疫组织化学法检测不同临床病理参数NSCLC病人BTG1蛋白表达水平,绘制生存曲线分析BTG1与病人5年生存率之间的关系。 结果NSCLC组织中BTG1蛋白的阳性表达率为38.4%,BTG1蛋白表达阳性组与阴性组淋巴结转移率、病理分期、组织学分级差异均有统计学意义(P < 0.05~P < 0.01);BTG1表达阳性组5年生存率高于阴性组(P < 0.05);BTG1阳性与阴性病人生存曲线的差异有统计学意义(P < 0.05)。 结论检测BTG1的表达情况对判断NSCLC的预后存在一定的参考价值,BTG1阳性病人预后较好。 Abstract:ObjectiveTo investigate the expression of B-cell translocation gene 1 (BTG1) in non-small cell lung cancer(NSCLC) tissue and its correlation with prognosis. MethodsImmunohistochemical method was applied to detect the level of BTG1 protein expression in patients with different clinical pathological parameters of NSCLC.The survival curve was plotted to analyze the relationship between BTG1 and the patient's 5-year survival rate. ResultsThe positive rate of BTG1 protein expression was 38.4% in NSCLC tissues, the lymph node metastasis, clinic stage and histological grade in positive and negative group of BTG1 protein expression were statistically significant(P < 0.05 to P < 0.01).The 5-year survival rate in BTG1 positive group was higher than that in BTG1 negative group, the difference of survival curves in BIG1 positive and negative patients were statistically significant(P < 0.05). ConclusionsDetection of BTG1 expression may be useful in predicting prognosis of NSCLC.BTG1-positive patients have a better prognosis. -
表 1 BTG1表达与NSCLC病人临床病理参数之间关系[n; 百分率(%)]
参数 n BTG1蛋白表达情况 χ2 P 阴性 阳性 性别 男 40 24(60.0) 16(40.0) 0.10 >0.05 女 33 21(63.6) 12(36.4) 年龄/岁 ≤60 50 32(64.0) 18(36.0) 0.37 >0.05 >60 23 13(56.5) 10(43.5) 病理类型 鳞癌 24 17(70.8) 7(29.2) 1.27 >0.05 腺癌 49 28(57.1) 21(42.9) 肿瘤直径/cm ≤3 29 17(58.6) 12(41.4) 0.19 >0.05 >3 44 28(63.6) 16(36.4) 淋巴结转移 N0 27 12(44.4) 15(55.6) 5.36 < 0.05 N+ 46 33(71.7) 13(28.3) 分期 Ⅰ~Ⅱ 31 15(48.4) 16(51.6) 4.01 < 0.05 Ⅲ 42 30(71.4) 12(28.6) 组织学分级 Ⅰ 26 10(38.5) 16(61.5) 9.18 < 0.01 Ⅱ~Ⅲ 47 35(74.5) 12(25.5) 表 2 BTG1表达与NSCLC病人5年生存之间关系[n; 百分率(%)]
BTG1表达 n 死亡 生存 χ2 P 阴性 45 37(82.2) 8(17.8) 阳性 28 16(57.1) 12(42.9) 5.46 < 0.05 合计 73 53(72.6) 20(27.4) -
[1] CHEN W, ZHANG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115. doi: 10.3322/caac.21338 [2] MAO B, ZHANG Z, WANG G. BTG2: a rising star of tumor suppressors[J]. Int J Oncol, 2015, 46(2): 459. doi: 10.3892/ijo.2014.2765 [3] WINKLER GS. The mammalian antiproliferative BTG/Tob protein family[J]. Cell Physiol, 2009, 222(1): 66. [4] LI H, JIANG Z, LENG Q, et al. A prediction model for distinguishing lung squamous cell carcinoma from adenocarcinoma[J]. Oncotarget, 2017, 8(31): 50704. doi: 10.18632/oncotarget.17038 [5] RIOS J, GOSAIN R, GOULART BH, et al. Treatment and outcomes of non-small-cell lung cancer patients with high cmorbidity[J]. Cancer Manag Res, 2018, 10: 167. doi: 10.2147/CMAR.S151935 [6] ZHAO S, CHEN SR, YANG XF, et al. BTG1 might be employed as a biomarker for carcinogenesis and a target for gene therapy in colorectal cancers[J]. Oncotarget, 2017, 8(5): 7502. doi: 10.18632/oncotarget.10649 [7] 姜润学, 胡万宁, 孙国贵, 等. BTG1在喉鳞状细胞癌组织中的表达及其临床意义[J]. 临床耳鼻咽喉头颈外科杂志, 2015, 29(16): 1447. [8] 姜润学, 胡万宁, 孙国贵, 等. BTG1对喉癌细胞增殖和凋亡的影响及其机制研究[J]. 中国癌症杂志, 2015, 25(12): 959. [9] ZHU R, ZOU ST, WAN JM, et al. BTG1 inhibits breast cancer cell growth through induction of cell cycle arrest and apoptosis[J]. Oncol Rep, 2013, 30(5): 2137. doi: 10.3892/or.2013.2697 [10] SHENG SH, ZHAO CM, SUN GG. BTG1 expression correlates with the pathogenesis and progression of breast carcinomas[J]. Tumour Biol, 2014, 35(4): 3317. doi: 10.1007/s13277-013-1437-0 [11] ZHAO Y, GOU WF, CHEN S, et al. BTG1 Expression correlates with the pathogenesis and progression of ovarian carcinomas[J]. Int J Mol Sci, 2013, 14(10): 19670. doi: 10.3390/ijms141019670 [12] HATA K, NISHIJIMA K, MIZUGUCHI J. Role for Btg1 and BTG2 in growth arrest of WEHI-231 cells through arginine methylation following membrane immunoglobulin engagement[J]. Exp Cell Res, 2007, 313(11): 2356. doi: 10.1016/j.yexcr.2007.03.021 [13] GUENDEL I, CARPIO L, PEDATI C, et al. Methylation of the tumor suppressor protein, BRCA1, influences its transcriptional cofactor function[J]. PLoS One, 2010, 5(6): e11379. doi: 10.1371/journal.pone.0011379 [14] LEE H, CHA S, LEE MS, et al. Role of antiproliferative B-cell translocation gene-1 as an apoptotic sensitizer in activation-induced cell death of brain microglia[J]. J Immunol, 2003, 171(11): 5802. doi: 10.4049/jimmunol.171.11.5802 [15] 孙国贵, 张洁, 崔大为, 等. BTG1在非小细胞肺癌中的表达及其对肺癌细胞增殖、凋亡和侵袭转移的作用[J]. 临床肿瘤学杂志, 2014, 19(11): 972. -





 下载:
下载: