-
银屑病是一种常见的慢性皮肤病,除了累及皮肤外,合并症的风险也很高,包括银屑病关节炎、克罗恩病、恶性肿瘤、肥胖症和心血管疾病,对病人的生活质量造成重大影响[1]。虽然银屑病的发病机制仍未完全阐明,但Th17细胞已被认为在银屑病免疫炎症中起关键作用[2];相反,调节性T细胞(regulatory T cell, Treg)主要负责抑制免疫炎症反应,其数量和功能缺陷也参与银屑病的发病[3-4]。双氢青蒿素(dihydroartemisinin, DHA)近年来备受关注,具有强大的药用价值,其对自身免疫性疾病和肿瘤的治疗具有强效作用,且无明显不良反应[5]。DHA抑制MRL/lpr狼疮小鼠脾细胞中Toll样受体4信号转导通路的激活和Ⅰ型干扰素和抗ds-DNA的产生,以改善狼疮性肾炎的病理损伤[6]。DHA通过调节哺乳动物雷帕霉素靶点(mammalian marget of rapamycin, mTOR)途径下调Th17细胞,上调Treg细胞,从而抑制实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE) 的发生[7]。此外,DHA衍生物DC32通过抑制IL-6恢复Th17/Treg平衡,从而抑制类风湿性关节炎(rheumatoid arthritis, RA) 滑膜炎中的免疫系统失衡和淋巴细胞浸润[8]。然而,DHA对银屑病的作用鲜有报道。基于以上研究,我们推测DHA对银屑病具有治疗作用,并基于Th17/Treg平衡角度初步探讨DHA调控银屑病的作用机制,为银屑病提供新的治疗药物。
-
BALB/c小鼠(雌性,18~20 g,6~8周龄)购自河南斯克贝斯生物科技股份有限公司;咪喹莫特(imiquimod, IMQ)乳膏(H20030129)购自四川明欣药业有限公司;DHA(71939-50-9)、羧甲基纤维素钠(Sodium carboxymethyl cellulos,CMC-Na)(9004-32-4)购自MCE公司,PMA/Ionomycin Mixture(CS1001)、BFA/Monensin Mixture(CS1002)购自联科生物技术有限公司;RPMI1640培养基购自Hyclone公司;流氏细胞术所需抗体PE/Cyanine7 anti-mouse CD3 Antibody(100220)、FITC anti-mouse CD4 Antibody(100406)、APC anti-mouse CD25 Antibody(101910)、PE anti-mouse FOXP3 Antibody(126404)、PE anti-mouse IL-17A Antibody(506904)购于美国Biolegend公司;anti-Ki67 Antibody (ab16667)购自ABcam公司;小鼠淋巴细胞分离液及ELISA试剂盒购自于深圳达科为生物工程有限公司。
-
将24只雌性BALB/c小鼠随机分为4组,每组6只:空白对照组(Control组)、模型组(Model组)、25 mg/kg DHA治疗组(DHA-L组)、50 mg/kg DHA治疗组(DHA-H组)。所有小鼠用剃须刀剔除背部毛发(2 cm×3 cm),然后用脱毛膏进一步去除残余毛发,饲养1 d后开始造模,Model组和DHA治疗组每天脱毛区域给予62.5 mgIMQ外涂,Control组给予等量的白凡士林外涂。DHA溶解于0.5%羧甲基纤维素钠溶液中,分别配成终浓度为2.5 mg/mL和5 mg/mL,现配现用,以防沉淀。各组小鼠均灌胃给药,外涂IMQ或凡士林前1 h给药,每只小鼠灌胃体积为10 mL·kg-1·d-1,Control组和Model组灌胃相应体积的0.5%CMC-Na溶液,连续给药6 d。参照银屑病面积严重程度指数(psoriasis area severity index, PASI)对鳞屑、红斑和皮肤厚度进行评分[9],计算PASI累积评分,以反映皮损的严重程度,评分范围为0~12分。在连续6 d DHA治疗后的第7天实验结束时,对所有动物腹腔注射巴比妥麻醉,眼眶采血后脱颈椎处死。
-
用眼科剪小心获取小鼠皮肤,制成石蜡切片,常规HE染色。使用Olympus显微镜观察拍照,测量表皮厚度,并采用银屑病病理(Baker)评分系统进行评分[10]。
-
首先用乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)缓冲液修复皮肤组织石蜡切片,并在3%过氧化氢溶液中孵育;切片与一抗anti-Ki67 Antibody在4 ℃的潮湿室中孵育过夜;冲洗后,切片与二抗(HRP-山羊抗兔IgG)孵育1 h,然后二氨基联苯胺显色。为了定量分析Ki67阳性细胞,每张切片在光学显微镜视野下使用Olympus显微镜随机取每个样品的3个区域进行拍照,使用ImagePro Plus 6软件计数表皮基底层Ki67阳性细胞的数量(不计数毛囊中的Ki67阳性细胞)。
-
采用小鼠淋巴细胞分离液分离获取脾淋巴细胞。取1×106个脾淋巴细胞用于Treg细胞检测;另取1×106个脾淋巴细胞加入24孔版中,每孔体积约1 mL,分别加入PMA/Ionomycin Mixture和BFA/Monensin Mixture各4 μL,置于37 ℃、5%CO2的培养箱培养6 h,用于Th17细胞检测。之后进行小鼠脾淋巴细胞染色,按照说明书先加入PE/Cyanine7 anti-mouse CD3、FITC anti-mouse CD4和APC anti-mouse CD25抗体进行表面染色,固定破膜后加入PE anti-mouse IL-17A或PE anti-mouse FOXP3抗体进行细胞内染色,上机检测后使用FlowJo 10软件分析数据。
-
小鼠麻醉后摘取眼球取血,室温静置30 min后,4 ℃、2 000 r/min离心获取血清。血清IL-17A和TNF-α通过商品化ELISA试剂盒测定。
-
采用方差分析和q检验。
-
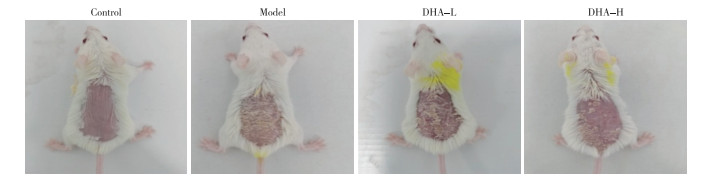
Control组小鼠皮肤外观正常,Model组小鼠出现红斑、鳞屑和皮肤增厚,DHA治疗后皮损改善(见图 1);治疗6 d后,DHA-L和DHA-H组的评分均明显低于未用DHA的Model组(P < 0.05)(见表 1)。
分组 n PASI评分 F P MS组内 Model组 6 8.83±1.47 11.45 < 0.01 1.761 DHA-L组 6 6.83±1.47* DHA-H组 6 5.17±0.98*# q检验:与Model组比较*P < 0.05;与DHA-L组比较#P < 0.05 表 1 各组小鼠6d后PASI评分比较(x±s)
-
组织病理学分析显示,与Control组相比,Model组小鼠的表皮增厚、角化过度、表皮突延长、毛细血管扩张和充血以及细胞浸润明显增多。与Model组小鼠相比,接受DHA治疗的小鼠皮肤病理逐渐恢复,表皮厚度和Baker评分下降(P < 0.05);此外,免疫组织化学染色显示,与Model组小鼠相比,DHA-L组和DHA-H组表皮Ki67阳性细胞均减少(P < 0.05)(见图 2、表 2)。
分组 n 表皮厚度/μm Baker评分/分 Ki67阳性细胞数/个 Control组 6 20.17±3.54 0.17±0.26 40.33±8.19 Model组 6 103.17±10.72* 6.58±0.58* 277.00±37.17* DHA-L组 6 62.17±9.49*# 4.50±0.84*# 182.17±17.80*# DHA-H组 6 50.17±7.65*#▲ 3.83±0.82*# 158.00±17.03*# F — 102.79 96.61 110.61 P — < 0.01 < 0.01 < 0.01 MS组内 — 69.067 0.444 514.008 q检验:与Control组比较*P < 0.05;与Model组比较#P < 0.05;与DHA-L组比较▲P < 0.05 表 2 各组小鼠表皮厚度、Baker评分及表皮Ki67阳性细胞数比较(x±s)
-
与Control组相比,Model组小鼠脾Th17细胞比例升高(P < 0.05),DHA治疗降低了Th17细胞比例,DHA-L和DHA-H组均较Model组降低(P < 0.05);与Model组相比,DHA-L组和DHA-H组小鼠脾Treg细胞比例升高(P < 0.05)(见表 3)。
分组 n Th17细胞/% Treg细胞/% Control组 6 0.67±0.25 5.15±1.62 Model组 6 1.64±0.60* 7.02±3.02 DHA-L组 6 1.24±0.49*# 9.48±0.98*# DHA-H组 6 0.91±0.18*# 10.78±2.14*# F — 6.07 8.78 P — < 0.05 < 0.01 MS组内 — 0.175 4.321 q检验:与Control组比较*P < 0.05;与Model组比较#P < 0.05 表 3 各组小鼠脾Th17细胞和Treg细胞比例比较(x±s)
-
与Control组相比,Model组血清IL-17A和TNF-α水平均升高(P < 0.05);与Model组相比,DHA-L组和DHA-H组血清IL-17A水平均降低(P < 0.05),而DHA-H组血清TNF-α水平降低(P < 0.05)(见表 4)。
分组 n IL-17A/(pg/mL) TNF-α/(pg/mL) Control组 6 9.59±1.39 52.76±16.45 Model组 6 30.89±3.45* 207.63±36.95* DHA-L组 6 15.34±2.16*# 180.64±23.66* DHA-H组 6 12.87±1.42*# 155.78±21.02*# F — 107.50 41.70 P — < 0.01 < 0.01 MS组内 — 4.978 659.264 q检验:与Control组比较*P < 0.05;与Model组比较#P < 0.05 表 4 各组小鼠血清IL-17A和TNF-α水平比较(x±s)
-
银屑病是一种常见的慢性皮肤病,确切病因仍未完全了解,但有证据表明它是一种自身免疫性疾病[11]。银屑病的传统治疗主要包括免疫抑制剂,如甲氨蝶呤和环孢素。然而,传统的免疫抑制药物可能会引起各种不良反应,包括肾毒性、肿瘤和感染[12]。最近,生物治疗包括抑制IL-17和其他促炎细胞因子的抗体,已被证明比传统的免疫抑制剂更有效[13]。不幸的是,它们也比传统药物贵得多, 而且也存在较高的感染风险[14-15]。因此,需要寻求一种有效、安全且廉价的药物来治疗这种慢性皮肤炎症。青蒿素是一种从中草药青蒿中分离出的活性成分,几十年来一直用于治疗疟疾。由于青蒿素的溶解性差和半衰期短,研究人员开发了其具有更好生物利用度的衍生物。DHA是青蒿素的衍生物,比青蒿素具有更好的生物利用度[16],在实验动物模型中已证实对脑脊髓炎、甲状腺炎、系统性红斑狼疮等炎症性疾病具有免疫抑制作用[7, 17-18]。尽管DHA改善自身免疫性疾病的机制在很大程度上仍然未知,但现有的研究表明其作用机制主要包括抑制氧化应激和NF-κB炎症通路以及通过调控mTOR信号转导调节Th17/Treg平衡[7, 16, 19]。本研究首次证明DHA可以通过调节Th17/Treg平衡改善IMQ诱导的银屑病小鼠皮损。
本研究中,为了确定DHA是否会改善银屑病小鼠皮肤炎症,我们建立了IMQ诱导的银屑病小鼠模型。未涂抹IMQ的对照小鼠皮肤正常,没有任何炎症或病变迹象,而模型组小鼠皮肤表现出与银屑病外观高度相似的红斑、鳞屑和皮肤增厚迹象,皮肤组织病理也与银屑病组织病理学特征相一致,而这些特征在正常对照组小鼠中没有出现。用低剂量或高剂量DHA治疗均可减轻皮肤病变的严重程度,减少红斑、鳞屑和皮肤厚度,组织病理角化过度和角化不全减少,表皮厚度变薄,与CHEN等报道结果一致[20]。角质形成细胞的增生和分化异常是银屑病的重要病理改变。因为Ki67在细胞周期进展的所有活跃阶段都表达,但在静息阶段(G0)不表达,它经常被用作细胞增殖的标志。为了确定DHA是否可以改善角质形成细胞的过度增殖,采用免疫组织化学染色的方法检测小鼠表皮Ki67蛋白表达水平。结果表明,DHA治疗可以明显减少小鼠表皮中Ki67阳性细胞数,证明DHA确实可以通过抑制角质形成细胞的增殖达到治疗银屑病的作用。
已经证实DHA可以通过调节Th17细胞及其相关细胞因子的产生从而防止EAE的发生[9]。Th17细胞参与了IMQ诱导的银屑病小鼠皮损的形成,为了评估DHA治疗是否影响银屑病中的Th17细胞,本研究检测了DHA治疗前后银屑病小鼠脾Th17细胞比例,发现DHA治疗能降低银屑病小鼠脾脏中Th17细胞的比例。这些发现表明DHA确实抑制了银屑病小鼠Th17细胞的生成,与LIU等的研究结果相一致[21]。与Th17细胞的促炎作用不同,Treg细胞具有抗炎作用,其数量或功能异常导致不能有效抑制炎症[22], 通过恢复其数量或功能有望发挥抗银屑病的作用,常见的免疫抑制剂甲氨蝶呤已被证明有此作用[23]。Treg细胞在IMQ诱导的银屑病小鼠模型中同样发挥重要的作用,其可以通过抑制γδT细胞以及IL-17A和TNF-α来发挥抗银屑病的作用,去除Treg细胞明显加重了银屑病小鼠的症状[24]。因此,我们探讨了DHA是否会通过上调Treg细胞来发挥其对银屑病的治疗作用。我们通过流式细胞术分析检测了小鼠脾脏中Treg细胞比例,发现DHA增加脾脏中Treg细胞的比例。研究[25]发现,DHA在炎症性肠病小鼠模型中可以通过上调Treg细胞发挥抗炎作用。因此,在我们的研究中,DHA通过增加Treg细胞数量来减轻银屑病皮肤损伤和炎症也很正常。DHA促进Treg细胞生成的确切机制仍有待未来研究确定, 先前的研究表明,DHA可能通过抑制mTOR信号转导诱导Treg细胞的表达[7];DHA也有可能通过抑制促炎细胞因子的表达来维持Treg细胞的数量,因为一些促炎细胞因子,如IL-6,会影响FOXP3的表达[8]。本研究没有对其机制做进一步的研究,这也是笔者未来将要研究的内容。总之,我们的研究结果首次证明,DHA不仅可以抑制Th17细胞,也可以通过上调Treg细胞的途径,达到治疗银屑病皮损的目的。
IL-23/Th17通路是银屑病发病机制的关键轴,IL-17A是该通路的主要效应物,IL-17A的过度表达会导致表皮过度增生和强烈的炎症反应,从而导致银屑病皮疹和全身炎症,靶向抗IL-17A疗法已证明可有效治疗银屑病[26]。LIU等[21]研究发现,DHA可以降低银屑病小鼠皮肤炎症因子IL-17A、IL-23的表达,也可以降低小鼠脾脏Th17细胞的数量,认为DHA可以通过调控IL-23/TH17轴减轻银屑病小鼠的皮损。本研究在此基础上,进一步检测DHA治疗后银屑病小鼠血清IL-17A的表达,发现血清中的IL-17A也是降低的。TNF-α也是银屑病发病机制中重要的炎症因子,针对TNF-α的生物制剂在银屑病的治疗中取得了非常好的疗效[27]。本研究发现,DHA也可以通过抑制血清中的TNF-α的水平来发挥治疗银屑病的作用。
综上所述,本研究发现DHA通过改善银屑病小鼠皮损、抑制表皮增生、抑制促炎细胞因子如IL-17A和TNF-α的表达,对银屑病发挥有效的抗炎和治疗作用。本研究还发现DHA可以增加IMQ诱导的银屑病小鼠脾脏Treg细胞的数量,同时降低银屑病小鼠脾脏Th17细胞的数量。本研究为DHA治疗银屑病提供了实验依据。
双氢青蒿素通过调节Th17/Treg平衡改善银屑病小鼠皮损机制研究
Dihydroartemisinin alleviates skin lesions in mouse of psoriasis by regulating Th17/Treg balance
-
摘要:
目的验证双氢青蒿素(DHA)是否能改善咪喹莫特(IMQ)诱导的银屑病小鼠皮损, 并探讨其可能的机制。 方法24只雌性BALB/c小鼠随机分为4组:空白对照组(Control组)、模型组(Model组)、25 mg/kg DHA治疗组(DHA-L组)、50 mg/kg DHA治疗组(DHA-H组),每组6只。每天观测小鼠皮肤变化并进行PASI评分。连续给药6 d,取小鼠皮肤进行HE染色和Ki67免疫组织化学染色;流式细胞仪检测小鼠脾Th17细胞和调节性T细胞(Treg);ELISA检测小鼠血清白细胞介素17A(IL-17A)和肿瘤坏死因子-α(TNF-α)水平。 结果IMQ成功诱导银屑病小鼠模型,DHA治疗后小鼠皮损改善,组织病理学改善,DHA-L和DHA-H组PASI评分及Ki67阳性细胞数量均低于Model组(P < 0.05);Model组脾Th17细胞比例较Control组升高(P < 0.05),DHA-L组和DHA-H组均较Model组降低(P < 0.05);DHA-L组和DHA-H组脾Treg细胞比例较Model组升高(P < 0.05);Model组血清IL-17A和TNF-α水平均较Control组升高(P < 0.05),与Model组相比,血清IL-17A水平在DHA-L和DHA-H组均降低(P < 0.05),而血清TNF-α水平仅DHA-H组降低(P < 0.05)。 结论DHA可以改善IMQ诱导的银屑病小鼠皮损,其机制可能和调节Th17/Treg细胞平衡有关。 Abstract:ObjectiveTo evaluate whether dihydroartemisinin (DHA) can improve the skin lesions in mouse model of psoriasis induced by imiquimod (IMQ) and to further explore its mechanism. MethodsA total of 24 female BALB/c mice were randomly divided into control group, model group, DHA-L group (treated with 25 mg/kg DHA), and DHA-H group (treated with 50 mg/kg DHA), with 6 mice in each group.The skin lesions were observed every day and eavaluated by PASI score.After 6 days of continuous DHA therapy, the skin morphology was examined by HE staining and subjected to immunohistochemical staining with Ki67.The Th17 cells and Treg cells in spleen were investigated by flow cytometry, and interleukin-17A(IL-17A) and tumor necrosis factor-α (TNF-α) in serum were detected by ELISA. ResultsThe psoriatic mouse model was successfully induced by IMQ.After DHA treatment, both the skin lesions and pathological changes were improved, and the PASI score and Ki67 positive cells in the DHA-L and DHA-H groups were lower than those in the model group (P < 0.05).The proportion of splenic Th17 cells in the model group was higher than that in the control group (P < 0.05), and the proportion of Th17 cells in the DHA-L and DHA-H groups were lower than that in the model group (P < 0.05).The proportion of splenic Treg cells in the DHA-H group was higher than that in the model group (P < 0.05).The levels of IL-17A and TNF-α in the model group were higher than those in the control group (P < 0.05).The levels of IL-17A in the DHA-L and DHA-H groups were lower than those in the model group (P < 0.05), while the levels of TNF-α were lower only in the DHA-H group (P < 0.05). ConclusionsDHA can alleviate IMQ-induced skin lesions in mouse of psoriasis, and its mechanism may be related to regulating Th17/Treg cells balance. -
Key words:
- psoriasis /
- dihydroartemisinin /
- imiquimod /
- Th17 cells /
- regulatory T cells
-
表 1 各组小鼠6d后PASI评分比较(x±s)
分组 n PASI评分 F P MS组内 Model组 6 8.83±1.47 11.45 < 0.01 1.761 DHA-L组 6 6.83±1.47* DHA-H组 6 5.17±0.98*# q检验:与Model组比较*P < 0.05;与DHA-L组比较#P < 0.05 表 2 各组小鼠表皮厚度、Baker评分及表皮Ki67阳性细胞数比较(x±s)
分组 n 表皮厚度/μm Baker评分/分 Ki67阳性细胞数/个 Control组 6 20.17±3.54 0.17±0.26 40.33±8.19 Model组 6 103.17±10.72* 6.58±0.58* 277.00±37.17* DHA-L组 6 62.17±9.49*# 4.50±0.84*# 182.17±17.80*# DHA-H组 6 50.17±7.65*#▲ 3.83±0.82*# 158.00±17.03*# F — 102.79 96.61 110.61 P — < 0.01 < 0.01 < 0.01 MS组内 — 69.067 0.444 514.008 q检验:与Control组比较*P < 0.05;与Model组比较#P < 0.05;与DHA-L组比较▲P < 0.05 表 3 各组小鼠脾Th17细胞和Treg细胞比例比较(x±s)
分组 n Th17细胞/% Treg细胞/% Control组 6 0.67±0.25 5.15±1.62 Model组 6 1.64±0.60* 7.02±3.02 DHA-L组 6 1.24±0.49*# 9.48±0.98*# DHA-H组 6 0.91±0.18*# 10.78±2.14*# F — 6.07 8.78 P — < 0.05 < 0.01 MS组内 — 0.175 4.321 q检验:与Control组比较*P < 0.05;与Model组比较#P < 0.05 表 4 各组小鼠血清IL-17A和TNF-α水平比较(x±s)
分组 n IL-17A/(pg/mL) TNF-α/(pg/mL) Control组 6 9.59±1.39 52.76±16.45 Model组 6 30.89±3.45* 207.63±36.95* DHA-L组 6 15.34±2.16*# 180.64±23.66* DHA-H组 6 12.87±1.42*# 155.78±21.02*# F — 107.50 41.70 P — < 0.01 < 0.01 MS组内 — 4.978 659.264 q检验:与Control组比较*P < 0.05;与Model组比较#P < 0.05 -
[1] KAUSHIK SB, LEBWOHL MG. Psoriasis: Which therapy for which patient: Psoriasis comorbidities andpreferred systemic agents[J]. J Am Acad Dermatol, 2019, 80(1): 27. doi: 10.1016/j.jaad.2018.06.057 [2] LI B, HUANG L, LV P, et al. The role of Th17 cells in psoriasis[J]. Immunol Res, 2020, 68(5): 296. doi: 10.1007/s12026-020-09149-1 [3] NUSSBAUM L, CHEN YL, OGG GS. Role of regulatory T cells in psoriasis pathogenesis and treatment[J]. Br J Dermatol, 2021, 184(1): 14. doi: 10.1111/bjd.19380 [4] 江从军, 金慧玲. CD4+CD25+CD127low/-调节性T细胞在寻常型银屑病发病机制中的作用[J]. 实用医学杂志, 2016, 32(4): 541. doi: 10.3969/j.issn.1006-5725.2016.04.010 [5] DAI X, ZHANG X, CHEN W, et al. Dihydroartemisinin: A potential natural anticancer drug[J]. Int J Biol Sci. 2021, 17(2): 603. doi: 10.7150/ijbs.50364 [6] HUANG X, XIE Z, LIU F, et al. Dihydroartemisinin inhibits activation of the toll-like receptor 4 signalingpathway and production of type Ⅰ interferon in spleen cells from lupus-prone MRL/lpr mice[J]. Int Immunopharmacol, 2014, 22(1): 266. doi: 10.1016/j.intimp.2014.07.001 [7] ZHAO YG, WANG Y, GUO Z, et al. Dihydroartemisinin ameliorates inflammatory disease by its reciprocal effects on Th and regulatory T cell function via modulating the mammalian target of rapamycin pathway[J]. J Immunol, 2012, 189(9): 4417. doi: 10.4049/jimmunol.1200919 [8] FAN M, LI Y, YAO C, et al. Dihydroartemisinin derivative DC32 attenuates collagen-induced arthritis in mice by restoringthe Treg/Th17 balance and inhibiting synovitis through down-regulation of IL-6[J]. Int Immunopharmacol, 2018, 65(12): 233. [9] HAN L, SUNJ, LU CJ et al. Formula PSORI-CM01 inhibits theinflammatory cytokine and chemokine release in keratinocytes via NF-kappaB expression[J]. Int Immunopharmacol, 2017, 44(3): 226. [10] LI Y, ZHANG G, CHEN M, et al. Rutaecarpine inhibited imiquimod-induced psoriasis-like dermatitis via inhibiting the NF-kappaB and TLR7 pathways in mice[J]. Biomed Pharmacother, 2019, 109(1): 1876. [11] FURUE K, ITO T, TSUJI G, et al. Autoimmunity and autoimmune co-morbidities in psoriasis[J]. Immunology, 2018, 154(1): 21. doi: 10.1111/imm.12891 [12] RAJITHA P, BISWAS R, SABITHA M, et al. methotrexate in the treatment of psoriasis and rheumatoid arthritis: mechanistic insights, current issues and novel delivery approaches[J]. Curr Pharm Des, 2017, 23(24): 3550. [13] HONMA M, HAYASHI K. Psoriasis: Recent progress in molecular-targeted therapies[J]. J Dermatol, 2021, 48(6): 761. doi: 10.1111/1346-8138.15727 [14] NOGUEIRA M, WARREN RB, TORRES T. Risk of tuberculosis reactivation with interleukin (IL)-17 and IL-23 inhibitors in psoriasis-time for a paradigm change[J]. J Eur Acad Dermatol Venereol, 2021, 35(4): 824. doi: 10.1111/jdv.16866 [15] LEE MP, WU KK, LEE EB, et al. Risk for deep fungal infections during IL-17 and IL-23 inhibitor therapy for psoriasis[J]. Cutis, 2020, 106(4): 199. [16] MORRIS CA, DUPARC S, BORGHINI-FUHRER I, et al. Review of the clinical pharmacokinetics of artesunate and its active metabolite dihydroartemisinin following intravenous, intramuscular, oral or rectal administration[J]. Malar J, 2011, 10(9): 263. [17] LIU HJ, TIAN Q, AI XY, et al. Dihydroartemisinin attenuates autoimmunethyroiditis by inhibiting the CXCR3/PI3K/AKT/NF-κB signaling pathway[J]. Oncotarget, 2017, 8(70): 115028. doi: 10.18632/oncotarget.22854 [18] CHEN Y, TAO T, WANG W, et al. Dihydroartemisinin attenuated the symptoms of mice model of systemic lupus erythematosus by restoring the Treg/Th17 balance[J]. Clin Exp Pharmacol Physiol, 2021, 48(4): 626. doi: 10.1111/1440-1681.13461 [19] LIU X, LU J, LIAO Y, et al. Dihydroartemisinin attenuates lipopolysaccharide-induced acute kidney injury by inhibiting inflammationand oxidative stress[J]. Biomed Pharmacother, 2019, 117(9): 109070. [20] CHEN Y, YAN Y, LIU H, et al. Dihydroartemisinin ameliorates psoriatic skin inflammation and its relapse by diminishing CD8(+) T-cell memory in wild-type and humanized mice[J]. Theranostics, 2020, 10(23): 10466. doi: 10.7150/thno.45211 [21] LIU JM, JIN QX, FUJIMOTO M, et al. dihydroartemisinin alleviates imiquimod-inducedpsoriasis-like skin lesion in mice involving modulation of IL-23/Th17 axis[J]. Front Pharmacol, 2021, 12(8): 704481. [22] QU T, MEI C, ZENG Y, et al. Correlation analysis of Treg/Th17 cells and related cytokines in patientswith psoriasis vulgaris[J]. J Tradit Chin Med, 2019, 39(5): 700. [23] YAN K, XU W, HUANG Y, et al. Methotrexate restores the function of peripheral blood regulatory T cells in psoriasis vulgaris via the CD73/AMPK/mTOR pathway[J]. Br J Dermatol, 2018, 179(4): 896. doi: 10.1111/bjd.16560 [24] CHOI CW, KIM BR, YANG S, et al. Regulatory T cells suppress skin inflammation in the imiquimod-induced psoriasis-like mouse model[J]. J Dermatol Sci, 2020, 98(3): 199. doi: 10.1016/j.jdermsci.2020.04.008 [25] YAN SC, WANG YJ, LI YJ, et al. Dihydroartemisinin regulates the th/treg balance by inducing activated CD4+T cell apoptosis via heme oxygenase-1 induction in mouse models of inflammatory bowel disease[J]. Molecules, 2019, 24(13): 2475. doi: 10.3390/molecules24132475 [26] LY K, SMITH MP, THIBODEAUX Q, et al. Anti IL-17 inpsoriasis[J]. Expert Rev Clin Immunol, 2019, 15(11): 1185. doi: 10.1080/1744666X.2020.1679625 [27] GISONDI P, GEAT D, CONTI A, et al. TNF-alpha inhibitors biosimilars as first line systemic treatment for moderate-to-severe chronic plaque psoriasis[J]. Expert Rev Clin Immunol, 2020, 16(6): 591. doi: 10.1080/1744666X.2020.1771182 -





 下载:
下载: