-
前列腺癌长期以来一直是美国男性最常见的肿瘤之一,目前是仅次于肺癌的第二大癌症相关死亡类的肿瘤[1]。在评估的世界范围内前列腺癌的死亡数与中国的前列腺癌死亡数分别为位列第五位和第十位[2],亚洲人群中前列腺癌的发病率低于西方人群。但是,近年来中国的发病率和死亡率迅速增长,发病率的急剧上升导致每年25 000人死亡,5年生存率约54%[3-4]。因此,探究新的肿瘤形成的分子机制对前列腺癌的诊断、治疗及预后是十分迫切的。微小RNA(microRNA,miR)是一种非编码基因,它是通过靶向信使RNA进行转录后的互补修饰进而影响基因的表达水平[5]。miR的表达在人类癌症中广泛失调,表明了其在癌症的发生、进展和治疗耐药中发挥着潜在的作用[6]。已经有研究表明miR-107能够促进结肠癌和胃癌细胞增殖并抑制细胞凋亡而发挥着原癌基因的作用[7-8],然而miR-107在宫颈癌、胰腺癌和乳腺癌的形成中却发挥着抑癌基因的角色[9-11]。本研究的目的是探讨miR-107在前列腺癌中的功能和明确其调控的靶基因,为前列腺癌的发生和潜在机制提供新的见解。
-
本研究使用ATCC细胞库(Manassas, VA, USA)的人前列腺癌细胞株(PC3和LNCaP)进行实验。所有细胞培养在含10%胎牛血清和100单位/毫升青霉素-链霉素抗生素的RPMI-1640培养基中并放置在37 ℃含5%二氧化碳和95%空气的加湿的细胞培养箱中培养。本实验使用成熟的miR样本: 由GenePharma公司(中国·上海)合成Hsa-miR-107模拟物(miR-107)和阴性对照(miR-NC),转染过程使用Lipo2000和Opti-MEM培养基,转染效率通过荧光标记的siRNA(FAM-siRNA)检测。
-
将转染后的前列腺癌细胞(500个/孔)种植到6孔板中,3~4 d进行细胞换液,在细胞培养8~12 d后,观察阳性克隆团块形成(>50细胞/团块)后甲醇固定15 min,然后用结晶紫进行染色20 min后拍照。
-
转染细胞接种于6孔板中。当细胞渐渐融合铺满后,使用10 μL的枪头和移液枪在标尺定位后进行细胞划痕。然后用PBS冲洗2次,去除脱落细胞,分别于0 h、24 h在倒置显微镜下拍照(40×),划痕后的细胞培养在含2%胎牛血清的RPMI-1640培养基中。细胞迁移(细胞伤口愈合率)是通过计算伤口边缘距离的变化来评估。侵袭实验是使用Transwell小室在24孔板中进行,在小室的基底膜上层加入均匀的基质胶。将转染后的细胞(5×104个/孔)种植于小室上层,24 h后用棉签轻柔去除上层非侵袭性细胞后,用甲醇固定小室下层侵袭的细胞15 min,然后用结晶紫染色20 min。在活细胞工作站高倍显微镜下(200×),记录每个小室中5个不同区域视野的侵袭染色后的细胞。
-
用TargetScan(http://www.targetscan.org/)预测miR-107的潜在靶基因,最终本研究选择了TPD52作为靶基因。在24孔板中利用Lipofectamine 2000进行前列腺癌细胞LNCaP和PC3的miR-107模拟物及阴性对照片段的转染,共转染含有TPD52野生型和突变型的双荧光素酶报告基因质粒,在生长24 h细胞融合达到80%后获取蛋白质,加入荧光底物,测定荧光素酶的活性。计算相对荧光强度,并比较转染了miR-107模拟物及阴性对照组之间的荧光素酶活性变化。
-
48 h后从转染的LNCaP和PC3细胞中提取蛋白并进行BCA蛋白浓度测定。上样缓冲液(5×)与蛋白按照1∶4进行混匀后在沸水浴中5 min使蛋白质变性。使用碧云天公司生产的SDS-PAGE凝胶配制试剂盒配置10%的分离胶,电泳时的电压设置为80 V运行约30 min后观察彩色蛋白分子量标志物的条带分离后将电压调增至110 V。转PVDF膜时电流设置为200 mA运行90~120 min。封闭使用5%的脱脂奶粉,摇床2~3 h。孵育一抗使用的抗体分为:内参-小鼠来源的β-actin(1-1 000, AA128,碧云天公司),目的-兔来源的TPD52(1∶10 000, EPR14220, Abcam公司)。孵育二抗使用的抗体有:羊抗小鼠(1∶1 000, A0216,碧云天公司),羊抗兔(1∶10 000, BL003A,biosharp公司)。最后使用Bio-Rad公司的曝光仪进行条带发光显影。
-
细胞转染后使用玻片在六孔板内均匀布孔,使细胞密度在50%~70%后按照各试剂厂家说明书进行固定,透膜和封闭。然后轻柔地取出玻片至于载玻片上并进行相应的标记,将目的抗体兔来源的TPD52(EPR14220, Abcam公司)按照合适的比例(1∶200)进行稀释后均匀地滴加到玻片上,轻柔地放入湿盒,过夜保存。次日,水浴锅37℃孵育荧光二抗(羊抗兔-Dylight 594,A23420,Abbkine公司)30 min,使用比例为1∶200。然后用Hoechst 33342(C1022,碧云天公司)室温10 min,进行细胞核染色标记。最后用活细胞工作站在高倍镜头下(200×)进行荧光拍照,每张玻片随机选取5个不同的视野。
-
采用t检验。
-
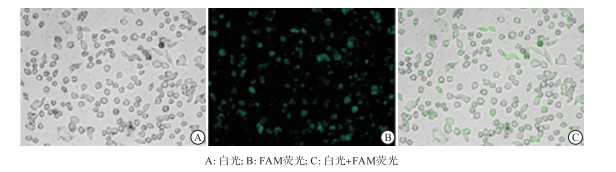
本研究瞬时转染实验结果显示,通过荧光标记的siRNA(FAM-siRNA)检测后显示miR-107的转染效率高于90%(见图 1,绿色荧光细胞占比>90%)。划痕与侵袭实验检测miR-107组与miR-NC组对前列腺癌细胞(LNCaP和PC3)的伤口愈合和侵袭能力的影响显示,miR-107组的伤口愈合率和侵袭细胞数目小于miR-NC组(P < 0.01)(见图 2、3及表 1)。
分组 n 伤口愈合率/% 侵袭细胞数 LNCaP PC3 LNCaP PC3 miR-NC组 3 65.33±4.50 60.33±5.03 363.00±44.71 397.33±20.25 miR-107组 3 45.66±3.78 40.66±5.13 125.00±27.83 182.66±30.35 t — 5.79 4.74 7.83 10.19 P — < 0.01 < 0.01 < 0.01 < 0.01 表 1 miR-107组与miR-NC组对前列腺癌细胞的伤口愈合与侵袭能力比较(x±s)
-
细胞克隆实验显示,miR-107组前列腺癌细胞的增殖能力小于miR-NC组(P < 0.01)(见表 2、图 4)。
分组 n 细胞克隆数 LNCaP PC3 miR-NC组 3 191.66±16.80 201.00±5.03 miR-107组 3 109.33±12.22 107.00±13.22 t — 6.86 7.93 P — < 0.01 < 0.01 表 2 miR-107组与miR-NC组对前列腺癌细胞的增殖能力变化(x±s)
-
利用生物信息学分析软件TargetScan显示miR-107与TPD52的结合位点(见图 5),在TPD52野生型(WT)组中miR-107组的荧光素酶活性明显低于miR-NC组(P < 0.01),而在TPD52突变型(MUT)组中2组之间的差异无统计学意义(P>0.05);蛋白免疫印迹实验和免疫荧光实验检测结果表明,miR-107组的TPD52表达明显小于miR-NC组(P < 0.01)(见表 3及图 6、7)。
分组 n 荧光素酶活性 TPD52蛋白相对表达量 平均光密度比(TPD52/Hoechst) WT MUT LNCaP PC3 LNCaP PC3 miR-NC组 5 0.896±0.085 0.884±0.042 0.482±0.039 0.592±0.031 0.882±0.059 1.543±0.079 miR-107组 5 0.274±0.050 0.866±0.032 0.302±0.034 0.280±0.031 0.393±0.028 0.462±0.051 t — 14.00 0.75 7.62 15.52 16.50 25.41 P — < 0.01 > 0.05 < 0.01 < 0.01 < 0.01 < 0.01 表 3 miR-107组与miR-NC组的荧光素酶活性及TPD52表达量变化(x±s)
-
miR作为研究热点,其在前列腺癌中的调节机制已经被广泛报道,近年来仍有许多高分文献发表,如miR-346和长链非编码RNA NORAD可互相作用来平衡调节前列腺癌中的DNA损伤和修复,在晚期前列腺癌和转录过度活跃的癌细胞中若NORAD显著减少,miR-346可作为特效治疗剂[12];环状RNA 0003258通过与IGF2BP3和海绵吸附miR-653-5p复合物促进前列腺癌转移[13];miR-26a通过靶向SHC4、PFDN4和CHORDC1调控前列腺癌细胞的胞外囊泡分泌[14]。以上研究均表明miR未来有很大的潜力成为前列腺癌的治疗新方向。本研究中为探究miR-107在前列腺癌细胞中发挥的作用,采用脂质体法瞬时转染miR-107模拟物,使其在前列腺癌细胞中高表达,为验证转染效率,转染带FAM荧光的miR-NC,并使用荧光显微镜观察,确保转染效率>90%后进行后续实验。通过细胞功能学实验,本研究发现了miR-107过表达后可抑制前列腺癌细胞的增殖和侵袭,初步考虑其在前列腺癌中发挥抑癌功能。此外,因miRNA并不直接发挥功能,作用方式为靶向结合下游mRNA的3′UTR区,通过靶基因预测软件结合参考文献,考虑TPD52可能为miR-107的靶基因,通过Western blotting及荧光素酶报告基因实验,验证miR-107直接靶向作用TPD52并呈负相关关系,过表达miR-107后显著降低了TPD52在前列腺癌细胞中的表达。
在人类许多肿瘤的发生过程中,都涉及miR-107的异常表达。如miR-107通过靶向HIF-1β抑制尤文氏肉瘤细胞的增殖[15],miR-107在人食管鳞癌中靶向Cdc42起抑癌作用[16],miR-107通过靶向HMGB1抑制乳腺癌细胞的自噬、增殖和迁移[17],miR-107抑制胶质瘤的血管生成和VEGF表达[18]。这些研究均证实了miR-107结合不同的靶基因在不同类型肿瘤中发挥着相应的功能。然而,目前还鲜有研究发现miR-107直接与TPD52结合并抑制前列腺癌细胞的增殖和侵袭。本研究结果则表明了miR-107的上调削弱了TPD52的表达,从而抑制前列腺癌细胞的增殖和侵袭。
综上所述,本研究表明miR-107在前列腺癌中通过靶向TPD52抑制细胞的增殖和侵袭。同时,本研究发现的miR-107与TPD52的负反馈关系,可能成为前列腺癌的新的监测和治疗靶点。此外,进一步利用活体动物实验研究miR-107在体内对前列腺癌细胞生长的影响将是必要的,仍需进一步研究。
miR-107靶向肿瘤蛋白D52抑制前列腺癌细胞的增殖和侵袭
miR-107 suppresses cell proliferation and invasion by targeting tumor protein D52 in prostate cancer
-
摘要:
目的研究microRNA-107(miR-107)对前列腺癌细胞生物学功能的影响和潜在的作用机制。 方法采用瞬时转染、细胞克隆、细胞划痕、侵袭实验检测miR-107组与对照组(miR-NC组)对前列腺癌细胞生物学功能的影响。此外,通过靶基因预测软件TargetscanHuman7.2筛选出肿瘤蛋白D52(TPD52)作为miR-107的潜在下游靶基因并采用双荧光素酶报告基因实验进行了特异性结合的验证。同时,进一步通过蛋白免疫印迹和免疫荧光实验进行靶基因的表达检测。 结果miR-107组的细胞划痕愈合率、侵袭率、增殖率均低于miR-NC组(P < 0.01)。miR-107组对靶基因TPD52表达量小于miR-NC组(P < 0.01)。 结论miR-107通过靶向TPD52抑制前列腺癌的增殖和侵袭。 Abstract:ObjectiveTo investigate the effects and potential mechanism of miR-107 in prostate cancer. MethodsTransient transfection, cell cloning, cell scratching and invasion experiments were used to detect the effects of miR-107 group and control group(miR-NC) on the biological functions of prostate cancer cells.In addition, we selected tumor protein D52(TPD52) as a potential downstream target gene of miR-107 by TargetscanHuman7.2, and used dual-luciferase reporter assay for verifing the specific binding.Meanwhile, Western blotting and immunofluorescence assays were performed to detected the expression of target gene. ResultsThe healing rate, invasion rate and proliferation rate of cell scratch in miR-107 group were lower than those in miR-NC group(P < 0.01).The expression of target gene TPD52 in miR-107 group was less than that in miR-NC group(P < 0.01). ConclusionsmiR-107 inhibits the proliferation and invasion of prostate cancer by targeting TPD52. -
Key words:
- prostate neoplasms /
- miR-107 /
- tumor protein D52 /
- proliferation /
- invasion
-
表 1 miR-107组与miR-NC组对前列腺癌细胞的伤口愈合与侵袭能力比较(x±s)
分组 n 伤口愈合率/% 侵袭细胞数 LNCaP PC3 LNCaP PC3 miR-NC组 3 65.33±4.50 60.33±5.03 363.00±44.71 397.33±20.25 miR-107组 3 45.66±3.78 40.66±5.13 125.00±27.83 182.66±30.35 t — 5.79 4.74 7.83 10.19 P — < 0.01 < 0.01 < 0.01 < 0.01 表 2 miR-107组与miR-NC组对前列腺癌细胞的增殖能力变化(x±s)
分组 n 细胞克隆数 LNCaP PC3 miR-NC组 3 191.66±16.80 201.00±5.03 miR-107组 3 109.33±12.22 107.00±13.22 t — 6.86 7.93 P — < 0.01 < 0.01 表 3 miR-107组与miR-NC组的荧光素酶活性及TPD52表达量变化(x±s)
分组 n 荧光素酶活性 TPD52蛋白相对表达量 平均光密度比(TPD52/Hoechst) WT MUT LNCaP PC3 LNCaP PC3 miR-NC组 5 0.896±0.085 0.884±0.042 0.482±0.039 0.592±0.031 0.882±0.059 1.543±0.079 miR-107组 5 0.274±0.050 0.866±0.032 0.302±0.034 0.280±0.031 0.393±0.028 0.462±0.051 t — 14.00 0.75 7.62 15.52 16.50 25.41 P — < 0.01 > 0.05 < 0.01 < 0.01 < 0.01 < 0.01 -
[1] SIEGEL RL, MILLER KD, FUCHS HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7. doi: 10.3322/caac.21708 [2] TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87. doi: 10.3322/caac.21262 [3] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115. doi: 10.3322/caac.21338 [4] HAN S, ZHANG S, CHEN W, et al. Analysis of the status and trends of prostate cancer incidence in China[J]. Chin Clin Oncol, 2013, 18(4): 330. [5] LEWIS BP, BURGE CB, BARTEL DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15. doi: 10.1016/j.cell.2004.12.035 [6] IORIO MV, CROCE CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review[J]. EMBO Mol Med, 2012, 4(3): 143. doi: 10.1002/emmm.201100209 [7] FEN L, SHAOJUN L, FEIYAN A, et al. miR-107 promotes proliferation and inhibits apoptosis of colon cancer cells by targeting prostate apoptosis response-4(Par4)[J]. Oncol Res, 2017, 25(6): 967. doi: 10.3727/096504016X14803476672380 [8] SONG YQ, MA XH, MA GL, et al. MicroRNA-107 promotes proliferation of gastric cancer cells by targeting cyclin dependent kinase 8[J]. Diagn Pathol, 2014, 9(1): 164. doi: 10.1186/s13000-014-0164-1 [9] ZHOU C, LI G, ZHOU J, et al. MiR-107 activates ATR/Chk1 pathway and suppress cervical cancer invasion by targeting MCL1[J]. PLoS One, 2014, 9(11): e111860. doi: 10.1371/journal.pone.0111860 [10] IMAMURA T, KOMATSU S, ICHIKAWA D, et al. Depleted tumor suppressor miR-107 in plasma relates to tumor progression and is a novel therapeutic target in pancreatic cancer[J]. J Am Coll Surg, 2017, 225(4): e120. [11] GAO B, HAO S, TIAN W, et al. MicroRNA-107 is downregulated and having tumor suppressive effect in breastcancer by negatively regulating brain-derived neurotrophic factor[J]. J Gene Med, 2017, 19(12). doi: 10.1002/jgm.2923 [12] FLETCHER CE, DENG L, ORAFIDIYA F, et al. A non-coding RNA balancing act: miR-346-induced DNA damage is limited by the long non-coding RNA NORAD in prostate cancer[J]. Mol Cancer, 2022, 21(1): 82. doi: 10.1186/s12943-022-01540-w [13] YU YZ, LV DJ, WANG C, et al. Hsa_circ_0003258 promotes prostate cancer metastasis by complexing with IGF2BP3 and sponging miR-653-5p[J]. Mol Cancer, 2022, 21(1): 12. doi: 10.1186/s12943-021-01480-x [14] URABE F, KOSAKA N, SAWA Y, et al. miR-26a regulates extracellular vesicle secretion from prostate cancer cells via targeting SHC4, PFDN4, and CHORDC1[J]. Sci Adv, 2020, 6(18): eaay3051. doi: 10.1126/sciadv.aay3051 [15] CHEN J, ZHOU X, XIAO Q, et al. MiR-107 suppresses cell proliferation and tube formation of Ewing sarcoma cells partly by targeting HIF-1β[J]. Hum Cell, 2018, 31(1): 42. doi: 10.1007/s13577-017-0183-9 [16] SHARMA P, SAININ, SHARMA R. miR-107 functions as a tumor suppressor in human esophageal squamous cell carcinoma and targets Cdc42[J]. Oncol Rep, 2017, 37(5): 3116. doi: 10.3892/or.2017.5546 [17] AI H, ZHOU W, WANG Z, et al. microRNAs-107 inhibited autophagy, proliferation, and migration of breast cancer cells by targeting HMGB1[J]. J Cell Biochem, 2018. doi: 10.1002/jcb.28157. [18] CHEN L, LI Z Y, XU S Y, et al. Upregulation of miR-107 inhibits glioma angiogenesis and VEGF expression[J]. Cell Mol Neurobiol, 2016, 36(1): 113. doi: 10.1007/s10571-015-0225-3 -





 下载:
下载: