-
急危重症胰腺炎(SAP)是临床常见的急腹症,其病情发展迅猛,病死率极高,且SAP常常会并发肠屏障功能受损,引起肠道菌群或内毒素移位,造成胰腺外感染, 启动全身炎症反应,引起机体多器官功能障碍[1-2]。有学者[3]认为,SAP的最重要的治疗干预措施就是预防其并发症的发生,尤其是并发的肠功能障碍。腺苷作为遍布人体细胞的内源性核苷,对全身多个系统都具有调节作用,腺苷及其类似物能够扩张肠道血管,增加肠血流量,腺苷可通过受体介导参与肠道血管的扩张[4]。SAP并发肠屏障功能障碍主要与肠道缺血再灌注损伤有关,SAP发生时,会引起肠道血管强烈收缩,导致肠道血流量减少,从而导致肠黏膜的缺血-再灌注损伤(IRI)[5]。本研究观察大鼠SAP肠屏障损伤时小肠组织的形态学变化,并给予腺苷干预以研究其对大鼠SAP肠屏障损伤的保护作用,进一步探讨其相关的线粒体保护机制。现作报道。
-
实验用成年健康雄性SD大鼠64只(250~280 g),购于北京大学动物实验中心,饲养于华北理工大学动物实验中心屏障实验室。腺苷(南京春秋生物工程有限公司),环孢素A(CsA)注射液(美国诺华公司),牛磺胆酸钠(美国Sigma公司),糖原合成酶激酶3β(GSK-3β)(Ser9) 抗体、Total-GSK-3β抗体(美国cell signaling公司),辣根过氧化物酶标记山羊抗兔IgG、BCA蛋白浓度测定试剂盒、ECL发光检测试剂盒(江苏碧云天生物技术研究所)。电泳仪(Invitrogen公司);生物图像采集系统(美国UVP公司);电镜(日本日立公司)。
-
64只健康雄性Wistar大鼠,随机分为假手术组8只、SAP组40只(分为0、3、6、12、24 h不同时间点处理组,每组8只)、腺苷处理组(Ade-Ⅳ组)8只、线粒体膜通透性转移孔(mPTP)抑制剂CsA组8只。
所有大鼠术前12 h禁食,饮水不受限。SAP组模型制备:采用腹腔内注射戊巴比妥溶液麻醉、固定,选择上腹正中切口入腹,找到十二指肠,轻柔地提起,用小号动脉夹分别夹在十二指肠段和肝门部胰胆管部,用一次性静脉留置针经十二指肠大乳头处逆行穿刺胰胆管,穿刺成功后接注射器,缓慢注射牛黄胆酸钠0.5 g/100 g, 持续约1 min,后停留5 min,然后拔出留置针,去除动脉夹,可以观察到,大鼠胰腺组织充血、水肿,然后将肠组织放回腹腔,分层缝合腹壁并消毒,整个手术过程要做到迅速且轻柔,然后将大鼠放入笼中,自由进食、饮水。Ade-Ⅳ组于造模成功后5 min将10 g/ L腺苷溶液(20 mg/kg)通过阴茎背静脉给药,CsA组于术前经腹腔注射CsA注射液(3 mg/kg)(我们既往研究[6]发现,大鼠SAP在12 h时间点损伤最为严重,下文实验结果中也会有提及,所以Ade-Ⅳ及CsA组只针对12 h时间点,在这里稍加说明,以便于理解)。假手术组仅打开腹腔, 翻动胰腺组织后关腹。SAP组所有大鼠在术后相应时间点打开腹腔,找到下腔静脉,真空负压抽取血液并离心取血清送检胰淀粉酶。
-
取胰腺及回肠末端组织,多聚甲醛溶液固定,然后作HE染色及电镜下观察肠道组织的病理改变。
-
本实验利用Ca2+诱导的线粒体肿胀试验测定各组mPTP的开放程度,CsA作为mPTP的抑制剂,只出现在了线粒体肿胀实验中,进行此项实验包含SAP、Ade-Ⅳ及CsA三个组。首先分离大鼠肠组织细胞,用差速离心法提取肠组织细胞线粒体,采用BCA蛋白定量试剂盒分析线粒体浓度,纯净的线粒体悬浮于肿胀缓冲液中(KCl 120 mmol/L,Tris-HCl 10 mmol/L,KH2PO4 5 mmol/L,MOPS 20 mmol/L,4 ℃)使线粒体终浓度达到0.3 mg/mL, 并接种于96孔板中,加入200 μmol/L CaC12诱导mPTP的开放,线粒体的肿胀程度的判定采用分光光度法测量520 nm吸光度降低的百分率来评价。
-
采用液氮研磨大鼠小肠组织,并经过一系列匀浆、离心、裂解等步骤提取肠组织蛋白,用BCA蛋白定量试剂盒进行蛋白浓度测定,电泳并转膜,脱脂牛奶封闭,并加一抗(磷酸化-GSK-3β)4 ℃孵育过夜,然后二抗室温孵育1 h后进行ECL荧光显色。用总蛋白(Total-GSK-3β) 进行内参检测。所有胶片用扫描仪采集图像,保存好后用Image J分析灰度值。
-
采用t检验、方差分析和q检验。
-
SAP组造模成功后,抽血送检血清胰腺淀粉酶,发现0~12 h随时间延长,SAP组40只大鼠胰淀粉酶逐渐升高,且12 h达到高峰,24 h下降至最低,差异均有统计学意义(P < 0.01)(见表 1)。
时间点 n 血清胰淀粉酶/(U/L) 0 h 8 100±1.36 3 h 8 242±2.27** 6 h 8 264±2.7**△△ 12 h 8 496±4.99**△△## 24 h 8 151±1.54**△△##◇◇ F — 22 860.40 P — < 0.01 MS组内 — 8.142 q检验:与0 h比较**P < 0.01;与3 h比较△△P < 0.01;与6 h比较##P < 0.01;与12 h比较◇◇P < 0.01 表 1 血清胰淀粉酶在不同时间点的水平变化(x±s)
-
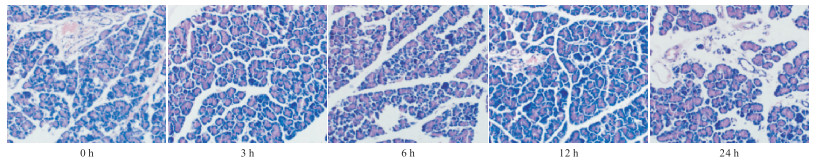
肉眼观察:假手术组胰腺组织无明显变化,SAP组胰腺可见片状坏死,胰周及网膜出现点状、块状皂化斑,并伴有大量血性腹水。
光镜下观察:SAP组3、6 h可见胰腺间质扩张充血,伴有少量的炎细胞浸润,12 h胰腺小叶、胰管大面积出血坏死,分叶结构模糊,伴有大量的炎细胞浸润及纤维素渗出。24 h胰腺出血坏死区明显减少,小叶纤维组织及小胰管增生明显,表现出明显的修复作用,且血清胰淀粉酶在12 h升高最为显著,这些也都间接提示12 h损伤最为严重,所以我们选取12 h组给药后进行后续观察。与SAP组比较,Ade-Ⅳ组肉眼可见血性腹水明显减少,胰腺充血、水肿等较SAP组减轻,有少量血性腹水,未发现钙化斑。小肠蠕动良好。光镜下观察SAP组可见小肠黏膜固有层充血、水肿,柱状上皮细胞坏死脱落,绒毛增粗水肿,排列紊乱,部分绒毛出现断裂、缺损; 与SAP组比较,Ade-Ⅳ组光镜下肠黏膜上皮及绒毛形态基本完整,绒毛排列基本整齐(见图 1~3)。
-
大鼠SAP造成了小肠组织的线粒体损伤,主要为线粒体肿胀,部分出现空泡变性,而腺苷组可见线粒体肿胀减轻,空泡变性减少,线粒体损伤较前者明显减轻(见图 4)。
-
线粒体520 nm处的吸光度为CsA组 < Ade-Ⅳ组 < SAP组,差异有统计学意义(P < 0.01)(见表 2)。
分组 n 线粒体吸光度值减少的百分比 SAP组 8 37.15±2.18 CsA组 8 10.00±1.31** Ade- Ⅳ组 8 19.63±1.41**△△ F — 537.71 P — < 0.01 MS组内 — 2.819 q检验:与SAP组比较**P < 0.01;与CsA组比较△△P < 0.01 表 2 腺苷对mPTP开放的影响(x±s)
-
与SAP组(4637.75±193.42)比较,Ade-Ⅳ组P-GSK-3β(10 128.88±591.82)的表达明显增加(t=24.95,P < 0.01)。
-
肠屏障指的是肠道上皮具有分隔肠腔内物质,防止致病性物质,如细菌和毒素等侵入的功能。研究[7]发现,在大鼠肠道缺血早期,肠黏膜缺血、缺氧会引起大量酸性代谢产物堆积,导致细胞代谢障碍。SAP常常会导致肠屏障功能受损,从而启动全身炎症反应,诱发多器官功能障碍综合征的发生。
一些中药制剂等能够明显减轻SAP并发的肠黏膜损伤[8-10],不仅如此,腺苷作为人体细胞普遍存在的内源性核苷,可通过扩张肠黏膜血管从而发挥肠道保护作用[11]。但是这些药物发挥肠道保护作用的具体细胞信号转导机制仍不是很清楚,尤其是关于线粒体保护途径的研究更是甚少。本研究发现,在给予腺苷预处理后,肉眼观察,大鼠血性腹水减少,小肠组织充血水肿明显减轻,肠蠕动良好,光镜下,小肠黏膜上皮及绒毛形态相对完整,排列基本整齐,与假手术组比较有明显差别,说明腺苷能够改善肠屏障功能,减轻SAP并发的肠损伤。
在正常生理条件下,mPTP呈关闭状态,但是当机体处于应激条件下(如缺血缺氧、钙超载、氧化应激损伤等),mPTP会开放,这时某些离子和代谢产物就会进入线粒体内,从而破坏线粒体的结构而引起线粒体的坏死或凋亡,最终导致细胞的功能障碍。本研究电镜结果显示,腺苷能够减轻肠黏膜线粒体的肿胀、空泡化,证实腺苷的肠黏膜保护作用与线粒体有关。不仅如此,腺苷还能够模拟mPTP抑制剂CsA,显著抑制Ca2+诱导的线粒体肿胀,进一步说明腺苷可通过抑制mPTP开放,从而发挥肠屏障的保护作用。
GSK-3β是一种多功能的丝/苏氨酸类激酶,该酶参与了多条细胞信号通路,对细胞增殖、分化及凋亡,肿瘤的发生、转移等过程发挥重要作用[12-13]。与大多数蛋白激酶不同的是,GSK-3β受两个不同位点磷酸化的调节,Tyr216磷酸化使GSK-3β活性增高,相反,Ser9磷酸化使GSK-3β活性降低[14]。GSK-3β Ser9位点的磷酸化表达增加,能够阻止mPTP的开放,从而发挥线粒体的保护作用[15]。本研究结果显示,与对照组相比,腺苷能够使GSK-3β Ser9的磷酸化表达明显增加,提示抑制GSK-3β活性,阻止mPTP开放,是腺苷发挥肠道保护作用的机制之一。
腺苷抑制GSK-3β活性对大鼠急危重症胰腺炎肠屏障功能障碍的影响
Effect of adenosine inhibition of GSK-3β activity on intestinal barrier dysfunction in rats with severe acute pancreatitis
-
摘要:
目的研究腺苷对大鼠急危重症胰腺炎(SAP)肠屏障功能障碍(IBD)的保护途径。 方法将64只健康雄性SD大鼠随机分为假手术组8只、SAP组40只(分为0、3、6、12、24 h不同时间点处理组,每组8只)、腺苷处理组(Ade-Ⅳ组)8只、线粒体膜通透性转移孔(mPTP)抑制剂环孢素A(CsA)组8只。大鼠SAP造模完成后,血清胰淀粉酶升高及镜下胰腺组织病理学改变提示造模成功,HE染色观察大鼠小肠组织损伤情况,Western blotting法检测大鼠小肠组织P-GSK-3β表达水平,应用电镜观察小肠线粒体超微结构的变化,采用差速离心法分离线粒体,并在Ca2+诱导下完成线粒体肿胀实验。 结果大鼠SAP造模成功后,SAP组40只大鼠血清胰腺淀粉酶水平随着0~12 h时间点的延长逐渐升高,且12 h达到高峰,24 h下降至最低点,差异均有统计学意义(P < 0.01);切片染色观察,SAP组小肠黏膜充血、水肿,并伴有柱状上皮细胞坏死,甚至出现部分绒毛的断裂、缺损,而Ade-Ⅳ组肠黏膜上皮及绒毛形态基本完整,绒毛排列基本整齐;P-GSK-3β的表达,Ade-Ⅳ组较SAP组显著增加(P < 0.01);小肠线粒体超微结构在SAP组肿胀明显,还出现了空泡变性,而Ade-Ⅳ组肿胀程度减轻,空泡变性减少;线粒体肿胀实验发现520 nm处线粒体吸光度值CsA组 < Ade-Ⅳ组 < SAP组,差异有统计学意义(P < 0.01)。 结论腺苷对SAP并发的IBD有保护作用,其机制可能与抑制GSK-3β活性,进而阻止mPTP的开放有关。 Abstract:ObjectiveTo explore the protection pathway of adenosine against intestinal barrier dysfunction(IBD) in rats with severe acute pancreatitis(SAP). MethodsA total of 64 male SD rats were randomly divided into 4 groups: sham group, adenosine treatment group(adenosine), SAP group and mPTP inhibitor cyclosporin A group.Serum amylase level and pancreatic pathology were tested to confirm the success of SAP model; the damage of small intestine tissue was observed by HE staining; the expression of P-GSK-3β in the small intestine of rats was detected by Western blotting; electronmicroscope was used to observe the changes of mitochondrial ultrastructure; differential centrifugation method was used to separate mitochondria, then, mitochondrial swelling experiments were conducted under Ca2+ induction. ResultsWith the success of SAP model, the serum pancreatic amylase level was gradually increased with the extension of the time point from 0 to 12 h, which reached the peak at 12 h and decreased to the lowest at 24 h.The difference was statistically significant(P < 0.01).Staining of sections showed that SAP group had hyperemia and edema of intestinal mucosa, accompanied by necrosis of columnar epithelial cells, and even fracture and defect of some villi, while the intestinal mucosal epithelium and fluffy form of the Ade-Ⅳ group were basically complete, and the velvet arrangement was basically neat.Compared to the SAP group, the P-GSK-3β expression of the Ade-Ⅳ group increased significantly(P < 0.01).In SAP group, intestinal mitochondrial ultra-micro structure was significantly swollen, even empty bubble degeneration appeared, while in Ade-Ⅳgroup, this significantly reduced.Mitochondrial swelling experiment showed that the mitochondrial absorbance value at 520 nm was the highest in SAP group, secondary was Ade-Ⅳ group and CSA group was the lowest, and the differences were statistically significant(P < 0.01). ConclusionsAdenosine prevents SAP intestinal barrier injury presumably by targeting the mPTP through inactivation of GSK-3β. -
表 1 血清胰淀粉酶在不同时间点的水平变化(x±s)
时间点 n 血清胰淀粉酶/(U/L) 0 h 8 100±1.36 3 h 8 242±2.27** 6 h 8 264±2.7**△△ 12 h 8 496±4.99**△△## 24 h 8 151±1.54**△△##◇◇ F — 22 860.40 P — < 0.01 MS组内 — 8.142 q检验:与0 h比较**P < 0.01;与3 h比较△△P < 0.01;与6 h比较##P < 0.01;与12 h比较◇◇P < 0.01 表 2 腺苷对mPTP开放的影响(x±s)
分组 n 线粒体吸光度值减少的百分比 SAP组 8 37.15±2.18 CsA组 8 10.00±1.31** Ade- Ⅳ组 8 19.63±1.41**△△ F — 537.71 P — < 0.01 MS组内 — 2.819 q检验:与SAP组比较**P < 0.01;与CsA组比较△△P < 0.01 -
[1] ZHANG JW, ZHANG GX, CHEN HL, et al. Therapeutic effect of Qingyi decoction in severe acute pancreatitis-induced intestinal barrier injury[J]. World J Gastroenterol, 2015, 21(12): 3537. doi: 10.3748/wjg.v21.i12.3537 [2] WANG H, JIANG Y, LI H, et al. Carbachol protects the intestinal barrier in severe acute pancreatitisby regulating Cdc42/F-actin cytoskeleton[J]. Exp Ther Med, 2020, 20(3): 2828. [3] ZHANG M, WU YQ, XIE L, et al. Isoliquiritigenin protects against pancreatic injury and intestinal dysfunction after severe acute pancreatitis via Nrf2 signaling[J]. Front Pharmacol, 2018, 9: 936. doi: 10.3389/fphar.2018.00936 [4] BOWSER JL, PHAN LH, ELTZSCHIG HK. The hypoxia-adenosine link during intestinal inflammation[J]. Immunol, 2018, 200(3): 897. [5] 张春, 林建源, 吕桂芳, 等. 地塞米松对重症急性胰腺炎大鼠肠黏膜屏障的保护作用机制研究[J]. 中外医学研究, 2020, 18(34): 6. [6] 袁梅. 大鼠急危重症胰腺炎并发心脏损害的相关机制研究[D]. 唐山: 河北联合大学, 2013. [7] NAKATSUTSUMI K, MORISHITA K, YAGI M, et al. Vagus nerve stimulation modulates arachidonic acid production in the mesenteric lymph following intestinal ischemia-reperfusion injury[J]. Trauma Acute Care Surg, 2021, 91(4): 700. doi: 10.1097/TA.0000000000003345 [8] 李百强, 武之洋, 袁晨晨, 等. 鱼油代谢物保护素D1对重症急性胰腺炎小鼠肠粘膜损伤保护作用的研究[J]. 肠外与肠内营养, 2020, 27(4): 205. [9] PAN LY, CHEN YF, LI HC, et al. Dachengqi decoction attenuates intestinal vascular endothelial injury in severe acute pancreatitis in vitro and in vivo[J]. Cell Physiol Biochem, 2017, 44(6): 2395. doi: 10.1159/000486155 [10] CUI QR, LING YH, WEN SH, et al. Gut barrier dysfunction induced by aggressive fluid resuscitation in severe acute pancreatitis is alleviated by necroptosis inhibition in rats[J]. Shock, 2019, 52(5): e107. doi: 10.1097/SHK.0000000000001304 [11] BOWSER JL, PHAN LH, ELTZSCHIG HK. The hypoxia-adenosine link during intestinal inflammation[J]. Immunol, 2018, 200(3): 897. [12] POTZ BA, SCRIMGEOUR LA, SABE SA, et al. Glycogen synthase kinase 3β inhibition reduces mitochondrial oxidative stress in chronic myocardial ischemia[J]. Thorac Cardiovasc Surg, 2018, 155(6): 2492. doi: 10.1016/j.jtcvs.2017.12.127 [13] POTZ BA, SABE AA, ELMADHUN NY, et al. Calpain inhibition modulates glycogen synthase kinase 3β pathways in ischemic myocardium: a proteomic and mechanistic analysis[J]. Thorac Cardiovasc Surg, 2017, 153(2): 342. doi: 10.1016/j.jtcvs.2016.09.087 [14] ZHU H, DING Y, XU X, et al. Prostaglandin E1 protects coronary microvascular function via the glycogen synthase kinase 3β-mitochondrial permeability transition pore pathway in rat hearts subjected to sodium laurate-induced coronary microembolization[J]. Am J Transl Res, 2017, 9(5): 2520. [15] DING Y, ZHU HY, ZHANG LZ, et al. Shexiang Tongxin dropping pill reduces coronary microembolization in rats via regulation of mitochondrial permeability transition pore opening and AKT-GSK3β phosphorylation[J]. Chin J Integr Med, 2021, 27(7): 527. doi: 10.1007/s11655-019-3176-6 -





 下载:
下载: