-
B族链球菌(group B streptococcus, GBS)是革兰阳性兼性厌氧菌,常存在于胃肠道和泌尿生殖道内,为条件致病菌[1]。围生期孕妇阴道或直肠内GBS的定植率为10%~35%[2-3]。约有50%的GBS携带孕妇会把该菌传播给新生儿,在没有产前抗菌药物预防的情况下,1%~2%的新生儿会出现早发型GBS感染,表现为重症肺炎、败血症及化脓性脑膜炎,如不及时治疗会造成新生儿死亡或神经系统后遗症等严重不良后果[4-5]。美国自20世纪90年代开始对围生期孕妇进行GBS筛查,对携带GBS的孕妇产前应用抗菌药物预防,极大降低了新生儿GBS感染率[6]。细菌培养法是GBS筛查的金标准,目前围生期孕妇阴道/直肠拭子筛查GBS的方法主要为血平板培养法、显色平板培养法。但培养法存在耗时长、灵敏度低、影响因素多等缺点。本研究拟通过比较荧光聚合酶链反应(PCR)法与显色平板培养法筛查围生期孕妇阴道/直肠拭子的阳性率,分析荧光PCR法筛查GBS的可行性。现作报道。
-
收集2020年4-12月产科门诊孕妇标本1 143份,年龄18~45岁,孕35~37周,由产科医生先用一次性棉拭子采集孕妇阴道下1/3处分泌物,再将同一拭子插入肛门内1~3 cm,旋转一圈后取出,1 h内送实验室。
-
VITEK-2型全自动细菌鉴定仪及鉴定卡(法国梅里埃),ABI7500荧光定量PCR仪(美国ABI);GBS增菌肉汤管(江门凯琳),GBS显色平板(郑州安图),GBS核酸检测试剂(深圳优康)。
-
实验室接到样本后,将拭子放入GBS增菌肉汤管,于35 ℃培养箱增菌18~24 h。将增菌管内肉汤混匀,用一次性接种环取10 μL肉汤接种GBS显色平板,三区划线后将平板放入35 ℃、5% CO2培养箱。经24~48 h培养,从显色平板挑取红色或紫红色菌落转种血琼脂平板培养18~24 h,挑取菌落制备菌悬液后用细菌鉴定仪进行细菌鉴定。
-
将接种后的增菌肉汤管放4 ℃冰箱冷藏,显色平板培养为阳性的增菌肉汤管用荧光PCR法单独检测。培养为阴性的增菌肉汤管,各吸取100 μL肉汤到无菌管中,每5个增菌肉汤管组成1组样本,用荧光PCR法检测,对检测为GBS阳性的混合样本,再单独对每个增菌肉汤管进行检测。荧光PCR法具体操作步骤如下:将含有增菌液的无菌管12 000 r/min离心5 min,取沉淀加入50 μL核酸提取液,震荡后3 000 r/min离心10 s,100 ℃孵育10 min,12 000 r/min离心5 min,上清液供PCR扩增用。阴性、阳性对照直接取50 μL,加入50 μL核酸提取液,其余操作步骤同样本。在准备好的PCR反应管中加入GBS反应液35.2 μL、Taq酶0.8 μL,然后分别加入4 μL待测样本和阴性、阳性对照处理液,盖上管盖3 000 r/min离心10 s。荧光PCR扩增程序为95 ℃ 3 min 1个循环,94 ℃ 15 s,60 ℃ 30 s 40个循环。检测结果按照CT值≤38.0判为阳性,CT值>38.0~<40的样本重新上机,重做结果CT值< 40者为阳性,否则为阴性。
-
GBS通常产生CAMP因子,该因子能增强金黄色葡萄球菌的β溶血素溶解红细胞的能力,CAMP试验是指GBS和金黄色葡萄球菌的交界处溶血能力增加,出现箭矢型的透明溶血区。CAMP试验具体操作流程:用ATCC25923金黄色葡萄球菌在血琼脂平板上划一条横线,GBS靠近金黄色葡萄球菌划一条竖线,然后将血琼脂平板放35 ℃温箱中培养18~24 h,观察其协同溶血现象。
-
CAMP试验阴性的GBS菌株送上海派诺森公司进行16SrDNA菌株测序,将测序数据提交到GenBank数据库进行比对分析,并利用MEGA7.0软件对同源相近的链球菌的16SrDNA序列构建进化树。为验证这些菌株是否为编码CAMP因子的cfb基因缺失所致,参照文献[7]中报道的cfb基因设计引物,引物序列为F: 5′-ATG ATG TAT CTA TCT GGA ACT CTA GTG-3′;R: 5′-CGC AAT GAA GTC TTT AAT TTT TC-3′。对分离的CAMP阴性GBS、2株临床分离CAMP阳性GBS、阴性对照、阳性对照进行cfb基因检测,预期目的基因片段大小为260 bp。基因扩增产物采用琼脂糖凝胶电泳,将基因扩增产物送上海派诺森公司进行测序,将测序结果提交到GenBank数据库中进行BLAST比对。
-
采用χ2检验。
-
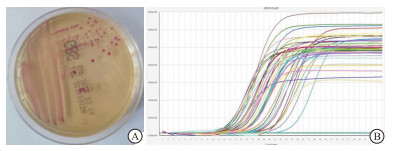
GBS显色平板培养出146株GBS,阳性率为12.77%,荧光PCR法检出191例阳性标本,阳性率为16.71%,2种方法阳性率差异有统计学意义(P<0.01);荧光PCR法与显色平板培养法相比,敏感性为93.15%、特异性为94.48%、符合率为94.31%(见表 1)。显色平板培养法与荧光PCR法检测GBS阳性结果见图 1。
荧光PCR法 显色平板法 合计 χ2 P 敏感性/% 特异性/% 符合率/% 阳性 阴性 阳性 136 55 191 阴性 10 942 952 7.05 < 0.01 93.15 94.48 94.31 合计 146 997 1 143 表 1 荧光PCR法与显色平板培养法检测结果比较(n)
-
显色平板培养法检出146株GBS,其中10株荧光PCR法检测为阴性,将这10份GBS菌株的增菌肉汤管取出重新鉴定,均为GBS。对这10株GBS、阴性对照、阳性对照进行CAMP试验,10株GBS和阴性对照菌株为阴性,阳性对照菌株为阳性。阴性对照选用粪肠球菌ATCC29212,阳性对照选用B族链球菌ATCC13183(见图 2)。
-
进化树分析结果显示,10株CAMP阴性菌株(GBS1-GBS10)与GBS(AB596948)聚为一类(见图 3)。电泳结果显示,2株CAMP阳性GBS和阳性对照有特异性条带,10株CAMP阴性GBS和阴性对照未出现特异性条带。阳性对照测序结果提交到GenBank数据库中进行BLAST比对,与cfb基因符合率为100%(见图 4)。2株CAMP阳性菌株含有cfb基因,10株CAMP阴性GBS未扩增出cfb基因,证实10株GBS表现为CAMP试验阴性是由cfb基因缺失导致。
-
GBS可引起牛乳腺炎,最早为兽医界所关注。1938年首次报道3例病人死于GBS感染,证实该菌也可以感染人类。严重的围生期GBS感染最初被描述于20世纪60年代。20世纪70年代,GBS成为美国新生儿感染和死亡的主要病原菌[8]。围生期孕妇阴道/直肠携带的GBS,通过分娩时传播给新生儿,是新生儿感染GBS的主要途径。美国CDC于1996年发布了“预防围生期B族链球菌病指南”,该指南在2002年和2010年进行了更新,指南中明确指出对围生期孕妇进行阴道/直肠拭子GBS筛查,如为阳性,在产时进行抗菌药物预防,以降低新生儿感染率和死亡率[9]。20世纪90年代,美国通过基于围生期GBS筛查与产时抗菌药物使用来预防新生儿GBS感染,新生儿GBS早发型感染率从20世纪90年代初期的1.8/1 000下降到2010年的0.26/1 000[10]。
已有研究[11]显示,不同地区的孕妇GBS携带率有较大差异,非洲地区为18.1%~26.7%,美洲地区为16.7%~22.7%,欧洲地区为16.1%~22.0%,东南亚地区为6.8%~15.3%,这可能与GBS在不同人群携带率有差异和检测方法的不同有关。另一篇纳入多篇中国研究共44 716例孕妇的荟萃分析显示,中国孕妇GBS定植率为11.3%[12],本次的显色平板培养法12.77%的阳性率与之接近,但是低于荧光PCR法16.71%的阳性率。
细菌培养法虽然是GBS筛查的金标准,但是存在耗时长、操作复杂等特点,分子生物学检测技术具有敏感度高、检测周期短等特点,目前已广泛应用于病原体检测。本次采用的荧光PCR法与显色平板培养法相比,敏感性、特异性及符合率均高于90%,是一种可以代替培养的方法。本次显色平板共分离出146株GBS,低于荧光PCR法检测出191份阳性标本,分析原因有以下两个方面,首先是显色平板培养法受方法学限制,只能取10 μL左右增菌肉汤进行培养,不然不利于单个菌落的分离,这远低于荧光PCR法用100 μL增菌肉汤进行基因扩增;其次是GBS增菌肉汤管只抑制革兰阴性杆菌,对革兰阳性球菌没有抑制作用,当标本中含有大量粪肠球菌和其他链球菌而只有少量GBS时,这些细菌通过竞争抑制GBS的增殖,从而在培养时造成漏检。
CAMP反应是指GBS特异性地增加金黄色葡萄球菌对绵羊红细胞的溶解能力[13]。因CAMP反应具有很高的特异性,很久以来人们一直将是否出现CAMP现象作为实验室诊断GBS的一个重要依据[14]。以往文献[15-16]报道,绝大多数GBS含有编码CAMP因子的cfb基因,因此许多实验室和公司将cfb基因作为靶点设计引物,通过分子生物学技术检测围生期孕妇阴道/直肠拭子中GBS,本次荧光PCR法检测试剂也选用cfb基因设计引物。CAMP试验虽然是GBS的重要鉴别试验,但CAMP阴性的GBS偶尔也有报道,目前认为小于2%的GBS表现为CAMP阴性[17]。本次培养法分离的146株GBS中有10株为CAMP阴性,检出率为6.8%,并且这些菌株是编码CAMP因子的cfb基因缺失导致。GBS编码CAMP因子的cfb基因较高比例的缺失,说明本地区不宜采用cfb基因作为靶点设计引物检测围生期孕妇GBS,也不宜将CAMP试验作为鉴定GBS的特异性试验。
CAMP是一种重要的致病因子,在活体动物试验中发现纯化的CAMP因子可导致兔及小鼠死亡[18]。但HENSLER等[19]通过对cfb基因进行等位基因替换后的体外及体内试验研究认为,CAMP因子在GBS的毒力系统中不是必须的。因此,CAMP因子在感染过程中的作用还存在争议。
综上,荧光PCR法和显色平板培养法相比,可有效提高围生期孕妇GBS筛查的阳性率,有条件的实验室应推广普及。本地区CAMP试验阴性GBS占比较高,应避免将该试验作为GBS的鉴别试验。因存在缺失cfb基因GBS,GBS分子检测试剂不应选择该段基因设计引物。
荧光PCR法在围生期孕妇B族链球菌筛查中的应用及CAMP试验阴性B族链球菌分子特征分析
Application of fluorescent PCR in screening of group B streptococcus in perinatal pregnant women and analysis of molecular characteristics of group B streptococcus with negative CAMP test
-
摘要:
目的探讨荧光聚合酶链反应(PCR)在围生期孕妇B族链球菌(GBS)筛查中的应用价值及CAMP试验阴性GBS的鉴定分析。 方法收集产科门诊孕35~37周孕妇阴道/直肠拭子1 143例,将拭子放入GBS增菌肉汤管增菌,分别用GBS显色平板和荧光PCR法检测GBS。16SrDNA分子鉴定技术对CAMP试验阴性GBS进行种属鉴定,并采用PCR技术检测其cfb基因。 结果显色平板检出146份阳性样本,阳性率为12.77%,荧光PCR法检出191份阳性样本,阳性率为16.71%,2种方法的阳性率差异有统计学意义(P<0.01);荧光PCR法与显色平板培养法相比,敏感性为93.15%、特异性为94.48%、符合率为94.31%。146株GBS中有10株为CAMP试验阴性,检出率为6.85%,均为cfb基因缺失株。 结论荧光PCR法可有效提高围生期孕妇GBS筛查的阳性率;该地区CAMP试验阴性GBS检出率较高,CAMP试验不宜作为GBS的鉴别试验,因存在缺失cfb基因GBS,GBS分子检测试剂不应选择该段基因设计引物。 Abstract:ObjectiveTo explore the application value of fluorescent polymerase chain reaction (PCR) in screening of group B streptococcus (GBS) in perinatal pregnant women and the identification and analysis of GBS with negative CAMP test. MethodsA total of 1 143 vaginal/rectal swabs were collected from pregnant women aged 35-37 weeks in the obstetric clinic.The swabs were placed in a GBS enrichment broth tube to enrich the bacteria, and then GBS chromogenic plate and fluorescent PCR were used to detect GBS.16SrDNA molecular identification technology was used to identify the species of GBS with negative CAMP test, and PCR was used to detect its cfb gene. ResultsThe chromogenic plate detected 146 positive samples, with a positive rate of 12.77%, and the fluorescent PCR detected 191 positive samples, with a positive rate of 16.71%.The difference between the two methods was statistically significant (P<0.01).Compared with the chromogenic plate culture method, the fluorescent PCR method had a sensitivity of 93.15%, a specificity of 94.48%, and a coincidence rate of 94.31%.Among the 146 GBS strains, 10 strains were negative for CAMP test, with a detection rate of 6.85%, and all strains were cfb gene deletion. ConclusionsThe fluorescent PCR can effectively increase the positive rate of GBS screening for pregnant women during the perinatal period.The detection rate of GBS with negative CAMP test is relatively high in this area, and CAMP test should not be used as an identification test for GBS.Due to the deletion of cfb gene, GBS molecular detection reagents should not select this gene to design primers. -
Key words:
- group B streptococcus /
- fluorescent PCR /
- CAMP test /
- cfb gene
-
表 1 荧光PCR法与显色平板培养法检测结果比较(n)
荧光PCR法 显色平板法 合计 χ2 P 敏感性/% 特异性/% 符合率/% 阳性 阴性 阳性 136 55 191 阴性 10 942 952 7.05 < 0.01 93.15 94.48 94.31 合计 146 997 1 143 -
[1] HEATH PT. Status of vaccine research and development of vaccines for GBS[J]. Vaccine, 2016, 34(26): 2876. doi: 10.1016/j.vaccine.2015.12.072 [2] RUSSELL NJ, SEALE AC, O'DRISCOLL M, et al. Maternal colonization with Group B Streptococcus and serotype distribution worldwide: systematic review and meta-analyses[J]. Clin Infect Dis, 2017, 65(suppl 2): S100. [3] GIZACHEW M, TIRUNEH M, MOGES F, et al. Streptococcus agalactiae maternal colonization, antibiotic resistance and serotype profiles in Africa: a meta-analysis[J]. Ann Clin Microbiol Antimicrob, 2019, 18(1): 14. doi: 10.1186/s12941-019-0313-1 [4] PUOPOLO KM, LYNFIELD R, CUMMINGS JJ. Management of infants at risk for Group B Streptococcal disease[J]. Pediatrics, 2019, 144(2): e20191881. doi: 10.1542/peds.2019-1881 [5] HUANG J, LIN XZ, ZHU Y, et al. Epidemiology of group B streptococcal infection in pregnant women and diseased infants in mainland China[J]. Pediatr Neonatol, 2019, 60(5): 487. doi: 10.1016/j.pedneo.2019.07.001 [6] NANDURI SA, PETIT S, SMELSER C, et al. Epidemiology of Invasive early-onset and late-onset Group B Streptococcal disease in the United States, 2006 to 2015: multistate laboratory and population-based surveillance[J]. JAMA Pediatr, 2019, 173(3): 224. doi: 10.1001/jamapediatrics.2018.4826 [7] CEZARINO BN, YAMAMOTO L, DEL NEGRO GM, et al. Diagnosis of neonatal Group B Streptococcus sepsis by nested-PCR of residual urine samples[J]. Braz J Microbiol, 2008, 39(1): 21. doi: 10.1590/S1517-83822008000100005 [8] SHABAYEK S, SPELLERBERG B. Group B Streptococcal colonization, molecular characteristics, and epidemiology[J]. Front Microbiol, 2018, 9: 437. doi: 10.3389/fmicb.2018.00437 [9] VERANI JR, MCGEE L, SCHRAG SJ. Prenvention of perinatal Group B Streptococcal disease-revised guidelines from CDC, 2010[J]. MMWR Recomm Rep, 2010, 59(RR 10): 1. [10] SCHRAG SJ, VERANI JR. Intrapartum antibiotic prophylaxis for the prevention of perinatal group B Streptococcal disease: experience in the United States and implications for a potential group B streptococcal vaccine[J]. Vaccine, 2013, 31(Suppl 4): D20. [11] KWATRA G, CUNNINGTON MC, MERRALL E, et al. Prevalence of maternal raniantion with group B Streptococcus: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2016, 16(9): 1076. doi: 10.1016/S1473-3099(16)30055-X [12] DING Y, WANG Y, HSIA Y, et al. Systematic review and meta-analyses of incidence for group B streptococcus disease in infants and antimicrobial resistance, China[J]. Emerg Infect Dis, 2020, 26(11): 2651. doi: 10.3201/eid2611.181414 [13] LANG S, PALMER M. Characterization of Streptococcus agalactiae CAMP factor as a pore-forming toxin[J]. J Biol Chem, 2003, 278(40): 38167. doi: 10.1074/jbc.M303544200 [14] JIN T, BREFO-MENSAH E, FAN W, et al. Crystal structure of the Streptococcus agalactiae CAMP factor provides insights into its membrane-permeabilizing activity[J]. J Biol Chem, 2018, 293(30): 11867. doi: 10.1074/jbc.RA118.002336 [15] GOUDARZI G, GHAFARZADEH M, SHAKIB P, et al. Culture and real-time PCR based maternal screening and antibiotic susceptibility for group B Streptococcus: an ranian experience[J]. Glob J Health Sci, 2015, 7(6): 233. [16] TANAKA K, IWASHITA M, MATSUSHIMA M, et al. Intrapartum group B Streptococcus screening using real-time polymerase chain reaction in Japanese population[J]. J Matern Fetal Neonatal Med, 2016, 29(1): 130. doi: 10.3109/14767058.2014.989496 [17] HASSAN AA, AKINEDEN O, LAMMLER C, et al. Molecular characterization of phenotypically CAMP-negative Streptococcus agalactiae isolated from bovine mastitis[J]. J Vet Med B Infect Dis Vet Public Health, 2002, 49(5): 257. doi: 10.1046/j.1439-0450.2002.00553.x [18] RAJAGOPAL L. Understanding the regulation of Group B Streptococcal virulence factors[J]. Future Microbiol, 2009, 4(2): 201. [19] HENSLER ME, QUACH D, HSIEH CJ, et al. CAMP factor is not essential for systemic virulence of Group B Streptococcus[J]. Microb Pathog, 2008, 44(1): 84. doi: 10.1016/j.micpath.2007.08.005 -





 下载:
下载: