-
骨质疏松症(OP)是一种骨代谢疾病,其特征在于骨量下降,伴随着骨组织和微结构的恶化以及骨矿物质密度的下降[1]。在OP中,骨形成与吸收之间的不平衡最终导致了骨的变性和易骨折[2]。成骨细胞(osteoblasts, OB)是一类特殊的具有成骨潜能的细胞,在骨重建及骨稳态维持中都发挥着重要的作用[3];OB活性下降是OP的主要原因[4]。Y-box蛋白5(SOX5)是SOX家族SoxD组的成员,编码控制细胞命运的各种转录因子并在许多谱系中进行分化,包括神经元、软骨细胞和B细胞[5-7]。研究[8-9]表明SOX5与类风湿关节炎和软骨形成密切相关,是治疗绝经后OP的有希望的分子靶标。已经在卵巢切除小鼠的骨髓细胞中发现了差异表达的SOX5;且与绝经前健康女性的骨髓样本相比,绝经后OP病人骨髓中SOX5的mRNA和蛋白表达水平显著上调;SOX5过表达可抑制人间充质干细胞的成骨分化[10]。而SOX5对OB增殖的分子功能及作用机制尚不明确;因此,本研究以大鼠OB为对象,探讨SOX5对OB增殖的影响及其潜在的作用机制,为OP的治疗及药物开发提供参考。
-
出生24 h的SPF级SD乳鼠10只,雌雄不限,质量(10±3)g,由北京维通利华实验动物技术有限公司提供,许可证为SCXK(京)2019-0009。饲养温度(20±2)℃,相对湿度为45%~60%。胎牛血清、胰蛋白酶、RPMI 1640培养基均购自美国GIBCO公司;TRIzol RNA分离试剂及SYBRⓇ Premix Ex TaqTM试剂盒均购买于日本TaKaRa公司;LipofectamineTM 2000转染试剂盒购自美国Thermo公司;pcDNA-SOX5和pcDNA3.1载体、siRNA-SOX5和其阴性对照(si-NC)以及PCR引物序列由上海GenePharma公司设计合成;氯化十六烷基吡啶鎓(美国Sigma-Aldrich,货号:C9002);碱性磷酸酶(Alkaline phosphatase, ALP)检测试剂盒(P0321S)、MTT试剂盒(C0009S)购自碧云天生物科技公司;茜素红染色试剂(北京索莱宝科技有限公司,货号:G8550);兔抗大鼠Runt相关转录因子2(runt-related transcription factor 2, Runx2)(ab236639)、Ⅰ型胶原蛋白(Collagen Ⅰ)(ab270993)、核因子-κB p65(nuclear factor kappa-B p65,NF-κB p65)(ab16502)、p-NF-κB p65(ab76302)、肿瘤坏死因子α(TNF-α)(ab205587)、KB抑制蛋白激酶α(KB inhibits protein kinase α, IκBα)(ab109300)、山羊抗兔IgG H & L (HRP)(ab205718)、β-actin(ab8227)均购自英国abcam公司。
细胞培养箱(美国Thermo Fisher Scientific公司);ABI PrismⓇ 7300型荧光定量PCR系统(美国);倒置荧光显微镜(IX73,购自日本Olympus公司);iMark680多功能酶标仪、蛋白转膜装置购自美国Bio-Rad公司。
-
应用酶消化法分离大鼠颅骨成骨细胞[11]。取新生24 h内SD乳鼠,处死后,乙醇浸泡5 min,在无菌条件下,取出头盖骨,PBS冲洗后切成1 mm3的骨颗粒,37 ℃水浴中用0.1%的胶原酶以1∶ 10的比例将骨颗粒消化分离20 min,然后再次用胶原酶分离约1 h。将分离获得的悬浮液以1 200 r/min离心,去上清液,用PBS漂洗3次,并加入含有15%胎牛血清、青霉素(100 U/mL)和链霉素(100 U/mL)的培养液。在37 ℃、5% CO2下孵育,1周换液2次,待细胞融合约80%时传代,换用成骨诱导培养基(基础培养基+50 μg/mL维生素C+10 mmol/L β-甘油磷酸钠+10 nmol/L地塞米松)。取第3代细胞通过ALP染色和形态观察行成骨细胞鉴定,取生长良好的第4代细胞用于实验。
鉴定成骨细胞:
(1) 形态学观察:在倒置相差显微镜下观察原代和继代培养成骨细胞的生长和形态变化,并在随机选择的视野中拍照。(2)ALP染色:将第3代的成骨细胞培养7 d,并参照ALP染色试剂盒的说明进行ALP染色。去除成骨细胞的培养基,PBS清洗细胞2~3次,并用4%多聚甲醛固定10 min。清洗后加入300 μL显色液,避光于37 ℃的培养箱中孵育2 h,显微镜下观察。
-
取生长良好的第4代成骨细胞,按每孔2×106个接种于24孔板,分成5个处理组:(1)空白对照组,不进行任何转染;(2)pcDNA3.1组,用Lipofectamine 2000按照说明书将100 nmol/L pcDNA3.1转染至成骨细胞;(3)pcDNA-SOX5组,用Lipofectamine 2000按照说明书将100 nmol/L pcDNA-SOX5转染至成骨细胞;(4)si-NC组,将si-NC转染至成骨细胞;(5)siRNA-SOX5组,将siRNA-SOX5转染至成骨细胞。转染48 h后收获细胞以进行后续实验。
-
使用TRIzol试剂提取细胞总RNA,使用分光光度计测量总RNA的浓度。按照试剂盒说明书将RNA反转录为cDNA,进行PCR扩增(见表 1)。反应体系(20 μL):cDNA(200 ng/μL) 2 μL,SYBRⓇ Premix Ex TaqTM(2×)10 μL,上下游引物各0.4 μL,ddH2O 7.2 μL。循环条件:94 ℃持续10 min,然后在94 ℃持续10 s,60 ℃持续20 s和72 ℃持续1 min进行40个循环。用β-actin作为对照,相对SOX5 mRNA的表达量采用2-ΔΔCt方法计算。
基因 引物序列 SOX5 F: 5′-CAG CCA GAG TTA GCA CAA TAG G-3′ R: 5′-CTG TTG TTC CCG TCG GAG TT-3′ β-actin F: 5′-TTG CGT TAC ACC CTT TCT TG-3′ R: 5′-TGT CAC CTT CAC CGT TCC A-3′ 表 1 RT-PCR引物序列
-
转染48 h后将成骨细胞以2×103细胞/孔的浓度接种到96孔板中,继续培养24 h,然后每孔中加入20 μL的MTT溶液(5 mg/mL),于培养箱中孵育4 h,吸去上层清液后加入150 μL的DMSO,490 nm波长处测定各孔吸光度值(OD),计算细胞增殖率。细胞增殖率=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。
-
ALP是成骨细胞分化的早期标志。将转染的成骨细胞用成骨培养基培养7 d。然后,除去OM培养基,并使用0.1%TritonX-100裂解细胞获得细胞裂解液,然后12 000 g离心10 min,取上清液为样品。使用ALP活性检测试剂盒测量上清液中ALP活性。于405 nm处测定各组OD值,使用对硝基苯酚绘制标准曲线;另用BCA法测定每个样品的总蛋白浓度。并将每个样品的ALP活性标准化为相应的总蛋白含量。
-
采用茜素红染色观察钙结节的形成数量,评估成骨细胞的矿化能力。成骨细胞按1.3方法进行分组处理,转染后将细胞培养2周,弃去培养液,细胞用PBS洗涤2次,并在室温下用4%多聚甲醛固定30 min。弃去多聚甲醛,PBS洗涤后在37 ℃下用0.1%茜素红染液染色1 h。倒置光学显微镜下观察图像并拍照,并使用Image-Pro Plus 6.0软件统计钙化结节染色阳性区域的面积和数量。
-
使用RIPA裂解液提取细胞中蛋白质。使用BCA试剂盒对蛋白质浓度进行定量。取等量蛋白质样品上样(每泳道30 μg),10% SDS-PAGE分离蛋白质,并通过半干转移将其转移到PVDF膜上。将膜用5%脱脂牛奶封闭,并在4 ℃下与一抗(Runx2、Collagen Ⅰ、NF-κB p65、p-NF-κB p65、TNF-α、IκBα、β-actin,1∶ 1 000)孵育过夜。第2天,将膜与偶联辣根过氧化物酶的二抗孵育(1∶ 2 000)2 h,然后使用化学发光试剂盒(ECL)进行显色。以β-actin为内参,分析结果。
-
以上所有实验均重复3次。采用单因素方差分析(One-way ANOVA),Tukey的事后检验用于单因素方差分析后的成对比较。
-
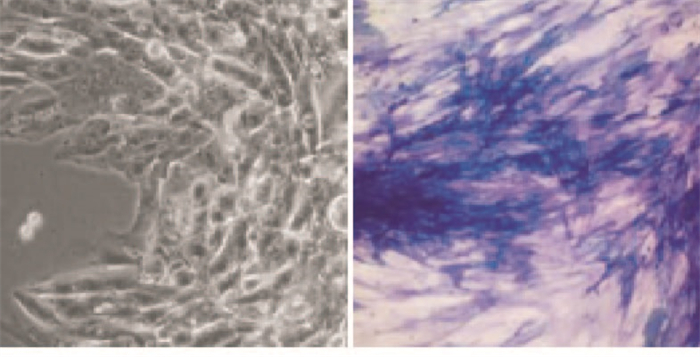
原代培养第3天,倒置相差显微镜下见成骨细胞从碎骨块周围爬出,呈放射状贴壁生长,形态不规则,呈多边形或三角形,有较多突起,单核卵圆形,1~2个核仁,胞质丰富清晰,ALP染色呈阳性,蓝黑色颗粒沉积在细胞质及细胞核ALP活性部位(见图 1)。
-
与空白对照组相比,pcDNA-SOX5组大鼠OB中SOX5 mRNA水平显著升高(P < 0.05),siRNA-SOX5组大鼠OB中SOX5 mRNA水平明显降低(P < 0.05)(见表 2)。
分组 SOX5 mRNA 空白对照组 1.00±0.00 pcDNA3.1组 1.02±0.01 pcDNA-SOX5组 4.65±0.37* si-NC组 1.01±0.01 siRNA-SOX5组 0.41±0.05* F 315.94 P < 0.01 MS组内 0.028 q检验:与空白对照组比较*P < 0.05 表 2 各组大鼠OB中SOX5 mRNA水平比较(x±s;ni=3)
-
与空白对照组相比,pcDNA-SOX5组大鼠OB增殖活力显著降低(P < 0.05),siRNA-SOX5组大鼠OB增殖活力明显升高(P < 0.05)(见表 3)。
分组 增殖率/% 空白对照组 100.00±0.00 pcDNA3.1组 102.13±10.01 pcDNA-SOX5组 64.75±6.16* si-NC组 104.06±9.31 siRNA-SOX5组 137.31±7.42* F 144.83 P < 0.01 MS组内 55.976 q检验:与空白对照组比较*P < 0.05 表 3 各组大鼠OB增殖活力比较(x±s;ni=3)
-
与空白对照组相比,pcDNA-SOX5组大鼠OB中ALP活性显著降低(P < 0.05),siRNA-SOX5组大鼠OB中ALP活性明显升高(P < 0.05)(见表 4)。
分组 ALP活性 空白对照组 1.00±0.00 pcDNA3.1组 1.03±0.08 pcDNA-SOX5组 0.75±0.05* si-NC组 1.02±0.06 siRNA-SOX5组 1.54±0.09* F 60.49 P < 0.01 MS组内 0.004 q检验:与空白对照组比较*P < 0.05 表 4 各组大鼠OB中ALP活性比较(x±s;ni=3)
-
倒置显微镜下观察可见细胞呈多层重叠生长,各组细胞间均可见橘红色钙化结节;与空白对照组相比,pcDNA-SOX5组大鼠OB钙化结节数量和面积显著降低(P < 0.05),siRNA-SOX5组大鼠OB钙化结节数量和面积明显增加(P < 0.05)(见图 2、表 5)。
分组 钙化结节数量 钙化结节面积/mm2 空白对照组 898.62±51.43 60.54±5.71 pcDNA3.1组 901.05±72.61 61.12±5.63 pcDNA-SOX5组 616.47±60.54* 33.28±4.17* si-NC组 895.09±58.30 62.35±4.24 siRNA-SOX5组 1 174.81±73.42* 89.76±6.79* F 28.70 41.08 P < 0.01 < 0.01 MS组内 4 074.347 29.154 q检验:与空白对照组比较*P < 0.05 表 5 各组大鼠OB钙结节形成情况(x±s; ni=3)
-
与空白对照组相比,pcDNA-SOX5组大鼠OB中p-NF-κB p65/NF-κB p65、TNF-α蛋白表达显著升高,Runx2、Collagen Ⅰ、IκBα表达显著降低(P < 0.05),siRNA-SOX5组大鼠OB中p-NF-κB p65/NF-κB p65、TNF-α蛋白表达明显降低,Runx2、Collagen Ⅰ、IκBα表达明显增加(P < 0.05)(见图 3、表 6)。
分组 Runx2 Collagen Ⅰ p-NF-κB p65/NF-κB p65 IκBα TNF-α 空白对照组 0.98±0.10 1.12±0.11 0.49±0.04 0.89±0.08 0.32±0.02 pcDNA3.1组 1.01±0.09 1.10±0.10* 0.51±0.05 0.91±0.07 0.31±0.03 pcDNA-SOX5组 0.66±0.07* 0.74±0.07* 1.28±0.11* 0.40±0.05* 0.87±0.06* si-NC组 0.99±0.06 1.08±0.09 0.52±0.07 0.88±0.04 0.34±0.04 siRNA-SOX5组 1.25±0.08* 1.31±0.12* 0.33±0.04* 1.22±0.06* 0.16±0.03* F 20.03 12.88 92.27 68.09 150.30 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 0.007 0.010 0.005 0.004 0.001 q检验:与空白对照组比较*P < 0.05 表 6 各组大鼠OB分化及NF-κB信号通路相关蛋白的表达(x±s; ni=3)
-
OB是骨形成的主要功能单位,负责骨骼重塑过程中骨骼基质的合成、分泌和矿化。OB在维持骨量和减少骨质流失中起关键作用。刺激OB增殖并促进其分化成熟是调节骨代谢、促进新骨形成、修复骨缺损的重要方法[12]。MTT法是检测细胞增殖的指标,可以反映生活细胞的代谢水平。本研究采用MTT法检测SOX5对OB增殖活性的影响,结果显示SOX5 mRNA过表达后,对体外培养的OB增殖有明显的抑制作用,而采用siRNA技术干扰SOX5的表达后,OB增殖率明显增加;表明沉默SOX5具有促进OB增殖的作用。
OB的增殖通常通过测量细胞总蛋白、ALP活性和Collagen Ⅰ分泌来评估。ALP是OB分泌的一组膜结合糖蛋白,是OB早期分化的特异性标志,ALP活性的高低,能较客观地反映OB分化成熟的程度[13]。Runx2、Collagen Ⅰ是OB相关的蛋白,在成骨分化活动中起重要的促进作用[4],在增殖阶段,OB分泌Collagen I以帮助矿化并减少骨质流失。OB分化成熟后多层重叠生长形成结节样结构,并不断分泌基质和矿物质,形成矿化结节。茜素红染色可以评估成骨分化晚期细胞外基质矿化情况钙化结节的形成情况[14]。本实验中,将转染的OB用成骨培养基培养7 d后,通过ALP活性检测了SOX5对OB分化的影响,结果显示SOX5过表达后,ALP活性值较低,OB钙化结节数量和面积降低,且Runx2、Collagen Ⅰ表达减少,分析可能与细胞增殖、分化受到抑制有关;而SOX5 mRNA表达下调时,ALP活性、细胞钙化程度及Runx2、Collagen Ⅰ表达增加。分析沉默SOX5促进成骨细胞ALP活性的原因可能是:(1)与促进细胞增殖有关,OB数量的增加,分泌的ALP也随之增加;(2)上调ALP mRNA表达水平,促进ALP的分泌,调节OB的分化。
NF-κB控制主要骨骼细胞类型(破骨细胞[15]、成骨细胞[16]和软骨细胞[17])的分化或活性。生理和病理性骨重塑的刺激都会影响NF-κB信号转导[18];NF-κB的启动子活性主要是由核移位和NF-κB磷酸化引起[19]。在静息细胞中,NF-κB以NF?κB/IκBα复合物的形式存在于细胞质;在病理条件下,刺激激活核因子抑制剂IκB激酶(IκB kinases, IKKs),该激酶通过靶向将IκBα蛋白降解,释放NF-κB并允许其核移位和DNA结合,促进TNF-α、IL-1β等炎性因子的表达,减少骨细胞形成,使OB增殖、分化能力降低。研究发现NF-κB的激活下调OB分化[20];抑制IκBα的降解,稳定NF-κB/IκBα复合物,可抑制NF-κB的活化,减少炎性因子的释放[21-22]。HUANG等[23]发现在人牙槽骨OB分化中,三七皂苷R1可通过抑制NF-κB通路,逆转TNF-α诱导的钙结节和ALP活性的降低。杨青坡等[24]发现姜黄素能降低骨组织中NF-κB表达,明显改善OP大鼠骨密度。在本研究中,我们通过pcDNA3.1质粒转染构建SOX5过表达OB,发现大鼠OB中磷酸化NF-κB p65、TNF-α蛋白表达升高,IκBα表达降低,说明NF-κB信号通路被激活;而沉默SOX5的表达后,IκBα表达增加,磷酸化NF-κB p65、TNF-α表达降低,提示NF-κB信号通路被抑制。
综上所述,沉默SOX5具有促进OB增殖的作用,并可调节OB的分化,其作用机制可能与抑制NF-κB信号通路的激活有关,过表达SOX5则发挥相反作用。但本研究尚存在一定不足,未对NF-κB信号通路进行干扰从反面进行验证;此外,由于体内外环境的巨大差异,在体内沉默SOX5是否发挥相同的作用,有待进一步研究。
SOX5对大鼠成骨细胞增殖及核因子-κB信号通路的影响
Effects of SOX5 on rat osteoblast proliferation and NF-κB signaling pathway
-
摘要:
目的探究Y-box蛋白5(SOX5)对大鼠成骨细胞(OB)增殖及核因子-κB(NF-κB)信号通路的影响。 方法取新生24 h SPF级SD乳鼠,应用酶消化法分离大鼠颅骨OB。形态学观察和ALP染色鉴定成骨细胞;取生长良好的第4代OB,分为空白对照组、pcDNA3.1组、pcDNA-SOX5组、si-NC组、siRNA-SOX5组。转染48 h后qRT-PCR检测细胞中SOX5 mRNA的表达;MTT法检测细胞增殖活力;ALP活性检测试剂盒测量ALP活性;茜素红染色观察钙结节的形成情况;Western blotting检测OB分化及NF-κB信号通路相关蛋白Runt相关转录因子2(Runx2)、Ⅰ型胶原蛋白(Collagen Ⅰ)、NF-κB p65及其磷酸化蛋白、KB抑制蛋白激酶α(IκBα)、肿瘤坏死因子α(TNF-α)的表达。 结果与空白对照组相比,pcDNA-SOX5组大鼠OB中SOX5 mRNA水平、p-NF-κB p65/NF-κB p65、TNF-α蛋白表达显著升高(P < 0.05),OB增殖活力、ALP活性、钙化结节数量和面积、Runx2、Collagen Ⅰ、IκBα表达显著降低(P < 0.05);siRNA-SOX5组大鼠OB中SOX5 mRNA水平、p-NF-κB p65/NF-κB p65、TNF-α蛋白表达明显降低(P < 0.05),OB增殖活力、ALP活性、钙化结节数量和面积、Runx2、Collagen Ⅰ、IκBα表达明显升高(P < 0.05)。 结论SOX5具有调控OB增殖、分化的作用,其作用机制可能与调控NF-κB信号通路有关。 Abstract:ObjectiveTo explore the effects of Y-box protein 5 (SOX5) on rat osteoblasts (OB) proliferation and nuclear factor κB (NF-κB) signaling pathway. MethodsThe newborn 24 h SPF grade SD suckling rats were taken, and the OB of the rat skull was separated by enzyme digestion method.Morphological observation and ALP staining were used to identify osteoblasts.The fourth generation OBs with good growth were divided into blank control group, pcDNA3.1 group, pcDNA-SOX5 group, si-NC group, and siRNA-SOX5 group.After 48 h of transfection, qRT-PCR was used to detect the expression of SOX5 mRNA in the cells; MTT method was used to detect cell proliferation viability; ALP activity detection kit was used to measure ALP activity; alizarin red staining was used to observe the formation of calcium nodules; Western blotting was used to detect OB differentiation and the expression of NF-κB signaling pathway-related proteins [Runt-related transcription factor 2 (Runx2), type Ⅰ collagen (collagen Ⅰ), nuclear factor κB p65 (NF-κB p65) and its phosphorylated protein, KB inhibits protein kinase α (IκBα), tumor necrosis factor α (TNF-α)]. ResultsCompared with the blank control group, the SOX5 mRNA level, p-NF-κB p65/NF-κB p65, and TNF-α proteins expression in the OB of rats in the pcDNA-SOX5 group were significantly increased (P < 0.05), the OB proliferation activity, ALP activity, the number and area of calcified nodules, Runx2, collagen Ⅰ, and IκBα expression were significantly reduced (P < 0.05);the SOX5 mRNA level, p-NF-κB p65/NF-κB p65, and TNF-α proteins expression in the OB of rats in the siRNA-SOX5 group were significantly reduced (P < 0.05), the OB proliferation activity, ALP activity, the number and area of calcified nodules, Runx2, collagen Ⅰ, and IκBα expression were significantly increased (P < 0.05). ConclusionsSOX5 can regulate the proliferation and differentiation of OB, and its mechanism may be related to the regulation of NF-κB signaling pathway. -
Key words:
- osteoporosis /
- Y-box protein 5 /
- osteoblasts /
- nuclear factor-κB
-
表 1 RT-PCR引物序列
基因 引物序列 SOX5 F: 5′-CAG CCA GAG TTA GCA CAA TAG G-3′ R: 5′-CTG TTG TTC CCG TCG GAG TT-3′ β-actin F: 5′-TTG CGT TAC ACC CTT TCT TG-3′ R: 5′-TGT CAC CTT CAC CGT TCC A-3′ 表 2 各组大鼠OB中SOX5 mRNA水平比较(x±s;ni=3)
分组 SOX5 mRNA 空白对照组 1.00±0.00 pcDNA3.1组 1.02±0.01 pcDNA-SOX5组 4.65±0.37* si-NC组 1.01±0.01 siRNA-SOX5组 0.41±0.05* F 315.94 P < 0.01 MS组内 0.028 q检验:与空白对照组比较*P < 0.05 表 3 各组大鼠OB增殖活力比较(x±s;ni=3)
分组 增殖率/% 空白对照组 100.00±0.00 pcDNA3.1组 102.13±10.01 pcDNA-SOX5组 64.75±6.16* si-NC组 104.06±9.31 siRNA-SOX5组 137.31±7.42* F 144.83 P < 0.01 MS组内 55.976 q检验:与空白对照组比较*P < 0.05 表 4 各组大鼠OB中ALP活性比较(x±s;ni=3)
分组 ALP活性 空白对照组 1.00±0.00 pcDNA3.1组 1.03±0.08 pcDNA-SOX5组 0.75±0.05* si-NC组 1.02±0.06 siRNA-SOX5组 1.54±0.09* F 60.49 P < 0.01 MS组内 0.004 q检验:与空白对照组比较*P < 0.05 表 5 各组大鼠OB钙结节形成情况(x±s; ni=3)
分组 钙化结节数量 钙化结节面积/mm2 空白对照组 898.62±51.43 60.54±5.71 pcDNA3.1组 901.05±72.61 61.12±5.63 pcDNA-SOX5组 616.47±60.54* 33.28±4.17* si-NC组 895.09±58.30 62.35±4.24 siRNA-SOX5组 1 174.81±73.42* 89.76±6.79* F 28.70 41.08 P < 0.01 < 0.01 MS组内 4 074.347 29.154 q检验:与空白对照组比较*P < 0.05 表 6 各组大鼠OB分化及NF-κB信号通路相关蛋白的表达(x±s; ni=3)
分组 Runx2 Collagen Ⅰ p-NF-κB p65/NF-κB p65 IκBα TNF-α 空白对照组 0.98±0.10 1.12±0.11 0.49±0.04 0.89±0.08 0.32±0.02 pcDNA3.1组 1.01±0.09 1.10±0.10* 0.51±0.05 0.91±0.07 0.31±0.03 pcDNA-SOX5组 0.66±0.07* 0.74±0.07* 1.28±0.11* 0.40±0.05* 0.87±0.06* si-NC组 0.99±0.06 1.08±0.09 0.52±0.07 0.88±0.04 0.34±0.04 siRNA-SOX5组 1.25±0.08* 1.31±0.12* 0.33±0.04* 1.22±0.06* 0.16±0.03* F 20.03 12.88 92.27 68.09 150.30 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 MS组内 0.007 0.010 0.005 0.004 0.001 q检验:与空白对照组比较*P < 0.05 -
[1] MENG YC, LIN T, JIANG H, et al. miR-122 exerts inhibitory effects on osteoblast proliferation/differentiation in osteoporosis by activating the PCP4-Mediated JNK pathway[J]. Mol Ther Nucleic Acids, 2020, 20: 345. doi: 10.1016/j.omtn.2019.11.038 [2] 杨菁, 聂子淮, 滕斌, 等. 基于FRAX风险评估的分层管理在社区老年骨质疏松症病人中的应用研究[J]. 蚌埠医学院学报, 2022, 47(2): 254. [3] CHOTIYARNWONG P, MCCLOSKEY EV. Pathogenesis of glucocorticoid-induced osteoporosis and options for treatment[J]. Nat Rev Endocrinol, 2020, 16(8): 437. doi: 10.1038/s41574-020-0341-0 [4] HUANG M, LI X, ZHOU C, et al. Noncoding RNA miR-205-5p mediates osteoporosis pathogenesis and osteoblast differentiation by regulating RUNX2[J]. J Cell Biochem, 2020, 121(10): 4196. doi: 10.1002/jcb.29599 [5] ZAWERTON A, MIGNOT C, SIGAFOOS A, et al. Widening of the genetic and clinical spectrum of lamb-shaffer syndrome, a neurodevelopmental disorder due to SOX5 haploinsufficiency[J]. Genet Med, 2020, 22(3): 524. doi: 10.1038/s41436-019-0657-0 [6] LIU F, LIU X, YANG Y, et al. NEAT1/miR-193a-3p/SOX5 axis regulates cartilage matrix degradation in human osteoarthritis[J]. Cell Biol Int, 2020, 44(4): 947. doi: 10.1002/cbin.11291 [7] EDWARDS SK, DESAI A, LIU Y, et al. Expression and function of a novel isoform of Sox5 in malignant B cells[J]. Leuk Res, 2014, 38(3): 393. doi: 10.1016/j.leukres.2013.12.016 [8] 吴琴, 石雨濛, 骆爱姝, 等. 转录因子SOX5在类风湿关节炎病人中的表达及意义[J]. 中华风湿病学杂志, 2019, 23(1): 46. doi: 10.3760/cma.j.issn.1007-7480.2019.01.010 [9] 张磊, 宁玉辉, 李国顺, 等. 敲低SOX5对骨关节炎软骨细胞生物学功能的影响[J]. 中国骨与关节杂志, 2017, 6(12): 932. doi: 10.3969/j.issn.2095-252X.2017.12.011 [10] XU L, ZHENG L, WANG Z, et al. TNF-α-induced SOX5 upregulation is involved in the osteogenic differentiation of human bone marrow mesenchymal stem cells through KLF4 signal pathway[J]. Mol Cells, 2018, 41(6): 575. [11] 艾力麦尔旦·艾尼瓦尔, 王玲, 古丽, 等. 转化生长因子β3对成骨细胞增殖和成骨能力的影响[J]. 中国组织工程研究, 2021, 25(17): 2664. doi: 10.3969/j.issn.2095-4344.3156 [12] RAMENZONI LL, BÖSCH A, PROKSCH S, et al. Effect of high glucose levels and lipopolysaccharides-induced inflammation on osteoblast mineralization over sandblasted/ acid-etched titanium surface[J]. Clin Implant Dent Relat Res, 2020, 22(2): 213. doi: 10.1111/cid.12884 [13] VIMALRAJ S. Alkaline phosphatase: structure, expression and its function in bone mineralization[J]. Gene, 2020, 754: 144855. doi: 10.1016/j.gene.2020.144855 [14] FAN Q, LI Y, SUN Q, et al. miR-532-3p inhibits osteogenic differentiation in MC3T3-E1 cells by downregulating ETS1[J]. Biochem Biophys Res Commun, 2020, 525(2): 498. doi: 10.1016/j.bbrc.2020.02.126 [15] TAKAKURA N, MATSUDA M, KHAN M, et al. A novel inhibitor of NF-κB-inducing kinase prevents bone loss by inhibiting osteoclastic bone resorption in ovariectomized mice[J]. Bone, 2020, 135: 115316. doi: 10.1016/j.bone.2020.115316 [16] MISHRA R, SEHRING I, CEDERLUND M, et al. NF-κB signaling negatively regulates osteoblast dedifferentiation during zebrafish bone regeneration[J]. Dev Cell, 2020, 52(2): 167. doi: 10.1016/j.devcel.2019.11.016 [17] SUN PF, KONG WK, LIU L, et al. Osteopontin accelerates chondrocyte proliferation in osteoarthritis rats through the NF-κb signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2020, 24(6): 2836. [18] 邓海林, 陆铭羚, 唐哲明, 等. 成骨细胞经NF-κB通路介导风湿性关节炎的相关机制研究[J]. 中国骨与关节损伤杂志, 2020, 35(7): 779. [19] 侯道荣, 刘振, 崔斯童, 等. 丹参酮Ⅱ-A通过调控TLR4/IκBα/NFκB信号通路抑制LPS诱导的细胞炎症[J]. 中国药理学通报, 2021, 37(2): 210. doi: 10.3969/j.issn.1001-1978.2021.02.012 [20] XU W, LU Y, YUE J, et al. Occlusal trauma inhibits osteoblast differentiation and bone formation through IKK-NF-κB signaling[J]. J Periodontol, 2020, 91(5): 683. doi: 10.1002/JPER.18-0710 [21] VENUGOPAL M, NAMBIAR J, NAIR BG. Anacardic acid-mediated regulation of osteoblast differentiation involves mitigation of inflammasome activation pathways[J]. Mol Cell Biochem, 2021, 476(2): 819. doi: 10.1007/s11010-020-03947-9 [22] SUEISHI T, AKASAKI Y, GOTO N, et al. GRK5 inhibition attenuates cartilage degradation via decreased NF-κB signaling[J]. Arthritis Rheumatol, 2020, 72(4): 620. doi: 10.1002/art.41152 [23] HUANG L, LI Q. Notoginsenoside R1 promotes differentiation of human alveolar osteoblasts in inflammatory microenvironment through inhibiting NF-κB pathway and activating Wnt/β-catenin pathway[J]. Mol Med Rep, 2020, 22(6): 4754. doi: 10.3892/mmr.2020.11537 [24] 杨青坡, 穆合塔尔·买买提热夏提, 王法正, 等. 姜黄素联合有氧运动对骨质疏松大鼠骨密度、氧化应激能力及骨组织NF-κB的影响[J]. 中国骨质疏松杂志, 2021, 27(1): 55. -





 下载:
下载: