-
细胞周期是产生细胞生物学活动的基本过程,主要包括间期1(G1)、DNA合成期(S)、间期2(G2)和有丝分裂期(M)。深入研究细胞周期机制不仅能够辅助体外受精(in vitro fertilization, IVF)进展,还有助于逆转癌症代谢和恢复癌症的免疫监视[1-2],小鼠卵母细胞和受精卵细胞往往作为观察细胞周期的良好模型。近年来,MAHDESSIAN等[3]使用荧光泛素化细胞周期指标(FUCCI)技术,通过在单个细胞水平上对细胞周期中的单个细胞进行精确的人类蛋白质组学综合图谱分析,进一步验证了大多数细胞周期蛋白的翻译后调节是推动细胞周期循环的关键因素。
沉默信息调节蛋白(Sirtuins)是一类烟酰胺腺嘌呤二核甘酸(NAD+)依赖性酶,通过多个下游靶标的去乙酰化和其他翻译后修饰影响不同的细胞发育过程,包括转录沉默、DNA重组和修复、细胞凋亡和细胞代谢[4]。根据蛋白结构和酶活性的差异,人源Sirtuin蛋白可分为1~7种亚型,其中SIRT2是唯一定位于细胞质,且具有强NAD+依赖脱乙酰基酶活性的Sirtuin亚型[5],SIRT2的乙酰化调节是细胞周期进程的重要影响因素。SIRT2是主要的组蛋白去乙酰化酶, 维持核小体结构稳定和正常组装,保证机体代谢稳态和DNA正常转录[6]。在细胞正常分裂过程中,微管蛋白的NAD依赖性乙酰化由SIRT2介导。在小鼠卵母细胞减数分裂成熟过程中,RASSF1A调节SIRT2和HDAC6介导的微管蛋白乙酰化以形成正常形态的纺锤体,确保染色体的正常排列[7]。由此笔者认为SIRT2在细胞周期进程中发挥重要作用。然而关于SIRT2蛋白在小鼠受精卵发育中的表达与定位情况尚鲜见报道,因此本课题组以小鼠1-细胞期受精卵为模型,采用qRT-PCR和Western blotting技术分别从转录水平和蛋白水平检测SIRT2在小鼠1-细胞期受精卵G1、S、G2和M四期中的表达;利用细胞免疫荧光技术检测SIRT2与α微管蛋白(α-tubulin)在小鼠1-细胞期受精卵中的共定位情况,初步阐述SIRT2与小鼠1-细胞期受精卵的关系,探究SIRT2在小鼠早期胚胎有丝分裂中的作用机制。
-
本实验所用昆明系SPF级小鼠购于内蒙古医科大学实验动物中心,均于恒温恒湿(温度25~27 ℃,湿度保持在50%~52%范围)动物房内饲养。其中雌性小鼠,培育时间为4~6周,体质量20~25 g;雄性小鼠,培育时间8周及以上,体质量35~45 g。
-
孕马血清促性腺激素(宁波三生);人绒毛膜促性腺激素(赤峰博恩);透明质酸酶、M16培养液、矿物油(Sigma);RNAfast200-总RNA极速提取试剂盒(上海飞捷生物);One-Step gDNA Removal试剂盒(全式金),qPCR试剂盒(全式金); Anti-SIRT2 antibody, Anti-βactin antibody(SantaCruz biotechnology);HRP-conjugated Goat Anti-Rabbit IgG(北京中杉);ECL化学发光试剂盒(Piece Biotechnology);FITC-Alexa Fluor 594 Affinipure Donkey Anti-Rabbit IgG,FITC-Alexa Fluor 488 Affinipure Donkey Anti-goat IgG(proteintech)。
-
准备4~5周龄昆明系SPF级雌性小鼠40只,在动物房照明条件明暗交替、温度湿度条件适宜的情况下继续培育1周。根据前文所述[8]进行小鼠超数排卵。在以上工作完成后,于当日18:00将完成超排卵的雌性小鼠与在相同条件下培养,8~12周龄的昆明系SPF级雄性小鼠1∶ 1合笼过夜。次日清晨8:00检栓,若雌鼠出现阴栓则视为受精成功。将带有阴栓的雌性小鼠采用脱颈椎法处死,取出两侧输卵管放入0.9%氯化钠溶液液滴中。在体式显微镜下,利用1 mm注射器刺破输卵管壶腹部膨大处,使受精卵-卵丘细胞复合物流出,随后将以上细胞团放入含有0.3%透明质酸酶中的M16培养液中,去除受精卵周围附着的卵丘细胞。将洗净裸卵放入提前加入M16和矿物油的培养皿中,置于恒温恒湿CO2培养箱中培养。据此研究[9]确定各期受精卵的收集时间。
-
分别取200个左右G1、S、G2和M期1-细胞期受精卵放于不同离心管中,密封保存,按照RNAfast200-总RNA极速提取试剂盒说明书提取mRNA;利用紫外分光光度计对提取的mRNA进行吸光度检测,计算260 nm与280 nm波长下吸光度的比值,比值在1.8~2.0范围内,表明提取的mRNA纯度高,可以进行RT-PCR。经实验测得该批次提取的mRNA纯度高,可进行下一步实验处理,准备1 μL提取的mRNA、4 μL 5×TransScript All-in-One SuperMix、1 μL gDNA Remove、14 μL Free-RNAse水,依次加入到反应试管中混合均匀,反应条件为42 ℃ 15 min,85 ℃ 5 s完成体外反转录。按照TransScript试剂说明书进行q-PCR来检测SIRT2 mRNA的含量, 引物序列见表 1,反应体系见表 2。反应条件: 94 ℃预变性30 s,94 ℃5 s,60 ℃ 15 s,45个循环;95 ℃ 15 s,56 ℃ 30 s,95 ℃ 15 s,1个循环。
引物名称 序列 SIRT2-F 5′-GGA ACC CTT CTT TGC CCT TG-3 SIRT2-R 5′-AGC GTG TCT ATG TTC TGC GTG T-3 Actin-F 5′-CAT CCG TAA AGA CCT CTA TGC CAA C-3 Actin-R 5′-ATG GAG CCA CCG ATC CAC A-3 表 1 引物序列
名称 试剂用量 目的基因 1 μL 正向引物(10 μmol/L) 0.4 μL 反向引物(10 μmol/L) 0.4 μL 2×TransStart Tip Green qPCR预混液 10 μL ROX相关染液(50×) 0.4 μL 无酶水 7.8 μL 总体系 20 μL 表 2 qPCR反应体系
-
取G1、S、G2和M四个时相的小鼠1-细胞期受精卵200个,按常规方法提取受精卵中的总蛋白,采用BCA法测定蛋白浓度,将蛋白置于提前加热的100 ℃水浴锅煮沸7~10 min。将变性蛋白与适量buffer混合稀释成适合的浓度,与marker分别加入十二烷基硫酸钠-聚丙烯酰胺凝胶点样孔内,每孔30 μL。完成点样后,进行电泳。于70 V 30 min、120 V 60 min的条件下跑胶。随后将凝胶取出,置于冰盒内4 ℃转膜2 h,将条带转移至NC膜上。随后用5%脱脂奶粉室温封闭1 h;将封闭处理的NC膜加入按1∶ 1 000稀释的Anti-SIRT2 antibody和Anti-βactin antibody中,4 ℃孵育过夜。第2天将NC膜移入1∶ 1 000 HRP-conjugated Goat Anti-Rabbit IgG中, 在室温条件下孵育2 h。随后使用TBST溶液对含有目的条带的NC膜进行脱色,重复3次, 每次20 min。按说明书加入ECL化学发光试剂,利用Bio-Rad显微成像系统,以β-actin为内参,分析蛋白质相对表达水平。
-
取1-细胞期G1、S、G2、M四个时相和即将进入2-细胞期G1期的受精卵用PBS洗液处理3遍,以去除细胞表面的透明带。向处理后的受精卵中加入适量的4%多聚甲醛固定,在室温条件下放置1 h;完成后加入PBST溶液将上述样品洗涤3次,每次处理时间为5 min;最后用0.1%Triton X-100透化,打孔30 min。PBS(含5%BSA)封闭液封闭1 h。
将处理完成的受精卵转入一抗,在4 ℃条件下处理5 min,再洗涤3次;将处理后的受精卵转入二抗中,在室温条件下避光处理,放置时间为1 h;再洗涤3次,之后用Hoechst33258对上述样品进行染色处理,静置时间为10 min,使核酸染色。在激光共聚焦扫描显微镜下,观察SIRT2和α-tubulin在受精卵中的定位及核酸染色情况,根据α-tubulin和核酸分布可确认纺锤体和染色质位置,从而确认M期进程。
-
采用方差分析和q检验。
-
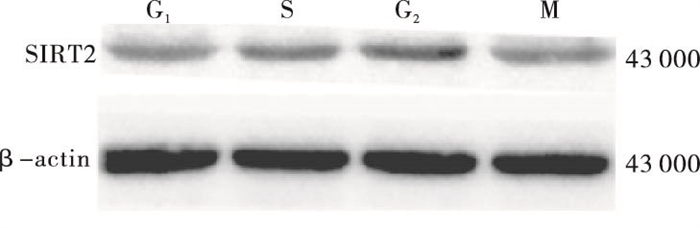
结果显示:S组、G2组、M组与G1期SIRT2 mRNA表达水平相比,S组和G2组高于G1组,G2组高于S组和M组,差异均有统计学意义(P < 0.05);SIRT2在1-细胞期受精卵的四个时期(G1、S、G2、M期)的蛋白相对表达水平,S组和G2组高于G1组,G2组高于M组,差异均有统计学意义(P < 0.05)(见表 3、图 1)。SIRT2蛋白与其mRNA的表达变化趋势一致,在G1期最低,从G1向G2过渡时持续增加,于G2期达到峰值, 随后向M期过渡时降低。
时期 n SIRT2 mRNA SIRT2蛋白表达 G1 200 0.781±0.005 0.632±0.018 S 200 1.362±0.010* 0.709±0.017* G2 200 1.812±0.006*△ 0.863±0.019*△ M 200 0.919±0.008*△# 0.650±0.014# F — 7 752.67 78.34 P — < 0.01 < 0.01 MS组内 — 0.651 0.034 q检验:与G1比较*P < 0.05;与S组比较△P < 0.05;与G2比较#P < 0.05 表 3 1-细胞期受精卵的SIRT2 mRNA和蛋白表达水平(x±s)
-
在转染的小鼠1-细胞期受精卵中,可见红色荧光标记的SIRT2与绿色荧光标记的α-tubulin定位一致。结果发现,SIRT2在G1期定位于细胞皮质且表达强度最弱(见图 2A),随着受精卵由G1期向G2期过渡,SIRT2逐渐由细胞皮质区域向细胞质转移,表达强度也随之增强,在G2早期表达强度达到最强峰(见图 2B、2C);而当受精卵由G2向M期过渡时,部分SIRT2入核向染色质凝集区聚集,在细胞质内表达强度逐渐减弱(见图 2D),根据α-tubulin和染色体的分布情况,入核的SIRT2和M中期纺锤体定位一致(见图 2E);随着M期结束,在向2-细胞期转变过程中,纺锤体消失,染色质移向两极,SIRT2在受精卵重新定位于细胞皮质区域(见图 2F、G、H)。推测SIRT2在某种条件下完成了核质穿梭并参与G2/M转换。在小鼠1-细胞期受精卵细胞周期中,SIRT2的亚细胞定位呈现出纺锤体动力学依赖性。
-
受精卵的有丝分裂停滞和及时恢复是哺乳动物有丝分裂的基本步骤。在酵母和甲壳类生物中,SIRT2是参与有丝分裂的关键蛋白质,在细胞周期时相转化中发挥重要作用[10-11]。在酵母细胞中,SIRT2通过和PR-Set7相互作用,在有丝分裂G2/M转换期中参与表观遗传标记H4K20me1的建立,从而影响S期进展和基因组稳定性[12]。SIRT2缺陷动物则表现出基因组不稳定性和染色体畸变,肿瘤易感性也随之增加[13-14]。而在哺乳动物受精卵中,SIRT2是否同样能够影响有丝分裂进程,目前相关研究较少。
本课题组通过qRT-PCR、Western blotting技术,证明SIRT2在小鼠1-细胞期受精卵细胞周期进程中存在,且SIRT2 mRNA和SIRT2蛋白的表达在细胞周期中呈时相依赖性变化。研究[15-16]表明,有丝分裂中纺锤体的形成与SIRT2修饰的微管蛋白的去乙酰化至关重要。在小鼠胚胎成纤维细胞中,当细胞处于G2/M过渡期时,SIRT2通过核质穿梭调节组蛋白H4 Lys16(H4K16Ac)脱乙酰化,从而调节染色体浓缩[17]。因此我们利用SIRT2和α-tubulin细胞免疫荧光共定位,发现在小鼠1-细胞期受精卵中,与常规亚细胞定位不同,SIRT2在有丝分裂期G2/M转化时由细胞质进入细胞核定位于纺锤体。我们推测在小鼠1-细胞期受精卵的G2/M转换期中,SIRT2在某种条件下通过核质穿梭调节纺锤体微管的动力学和动粒的功能,从而帮助实现有丝分裂间期向分裂期的转变。
综上所述,SIRT2在小鼠1-细胞期受精卵有丝分裂不同时相中存在表达差异和定位变化,或许能够作为哺乳动物受精卵细胞有丝分裂恢复的新的调节因子,这对于更好地理解有丝分裂的调控具有重要意义。由于实验条件限制,本课题组无法使用电镜观察中心粒的亚细胞定位,对于检测SIRT2在1-细胞期受精卵的纺锤体组装过程中的作用有待补充。在后续实验中,我们将通过构建SIRT2表达质粒, 过表达或沉默SIRT2后, 观察小鼠1-细胞期受精卵发育状态;筛选SIRT2蛋白下游的染色质蛋白及与靶蛋白具体的作用位点, 进一步证明SIRT2对1-细胞期受精卵的正向调控作用,确认SIRT2是否能够作为受精卵G2/M转换期检测点以检测细胞周期进程。
SIRT2在小鼠1-细胞期受精卵中的表达和定位研究
Expression and localization of SIRT2 in the 1-cell stage of mouse zygote
-
摘要:
目的探讨沉默信息调节蛋白2(SIRT2)在小鼠1-细胞期受精卵的表达和定位。 方法利用qRT-PCR、Western blotting分别检测SIRT2在小鼠1-细胞期受精卵发育全过程中mRNA和蛋白表达谱;采用细胞免疫荧光法观察SIRT2和α-tubulin的共定位情况。 结果小鼠1-细胞期受精卵SIRT2 mRNA和蛋白表达变化趋势一致,均由G1向G2期过渡时表达水平升高;由G2期向M期过渡时表达水平下降(P < 0.05)。在G2期向M期过渡过程中,SIRT2的定位由细胞质向细胞核转移,于M期中期进入细胞核并定位于纺锤体,在M期后期重新定位于细胞皮质。 结论SIRT2蛋白在小鼠1-细胞期受精卵中的表达呈细胞周期时相依赖性,在1-细胞期小鼠受精卵有丝分裂间期(G1、S、G2)中细胞质内表达增加,积累的SIRT2在某种条件下进入细胞核调节纺锤体微管动力学, 在G2/M过渡期发挥作用。 Abstract:ObjectiveTo investigate the expression and subcellular localization of sirtuins 2(SIRT2) in the mouse 1-cell stage zygote. MethodsThe mRNA and protein expression profiles of SIRT2 in the development of mouse 1-cell stage zygote were detected by qRT-PCR and Western blotting.The co-localization of SIRT2 and α-tubulin was observed by cell immunofluorescence method. ResultsIn the mouse 1-cell stage zygote, the expressions of SIRT2 at mRNA level had consistency with protein level.The expression level was increased during the transition from G1 phase to G2 phase, and decreased during the transition from G2 phase to M phase.During the transition from G2 phase to M phase, the localization of SIRT2 was gradually shifted from the cell cortex to the nucleus and localized in the spindle in the mid-M phase, when in the late M phase, it relocated to the cell cortex. ConclusionsThe expression of SIRT2 protein in mouse 1-cell stage zygote is cell cycle phase-dependent.The expression of SIRT2 protein increases in the cytoplasm of mouse 1-cell stage zygote mitotic interphase (G1, S, G2), and the accumulated SIRT2 regulates the dynamics of spindle microtubules under some certain condition and plays a role in the G2/M transition. -
Key words:
- 1-cell stage zygote /
- mitosis /
- sirtuins 2 /
- expression /
- subcellular localization
-
表 1 引物序列
引物名称 序列 SIRT2-F 5′-GGA ACC CTT CTT TGC CCT TG-3 SIRT2-R 5′-AGC GTG TCT ATG TTC TGC GTG T-3 Actin-F 5′-CAT CCG TAA AGA CCT CTA TGC CAA C-3 Actin-R 5′-ATG GAG CCA CCG ATC CAC A-3 表 2 qPCR反应体系
名称 试剂用量 目的基因 1 μL 正向引物(10 μmol/L) 0.4 μL 反向引物(10 μmol/L) 0.4 μL 2×TransStart Tip Green qPCR预混液 10 μL ROX相关染液(50×) 0.4 μL 无酶水 7.8 μL 总体系 20 μL 表 3 1-细胞期受精卵的SIRT2 mRNA和蛋白表达水平(x±s)
时期 n SIRT2 mRNA SIRT2蛋白表达 G1 200 0.781±0.005 0.632±0.018 S 200 1.362±0.010* 0.709±0.017* G2 200 1.812±0.006*△ 0.863±0.019*△ M 200 0.919±0.008*△# 0.650±0.014# F — 7 752.67 78.34 P — < 0.01 < 0.01 MS组内 — 0.651 0.034 q检验:与G1比较*P < 0.05;与S组比较△P < 0.05;与G2比较#P < 0.05 -
[1] LIU J, PENG Y, WEI W. Cell cycle on the crossroad of tumorigenesis and cancer therapy[J]. Trends Cell Biol, 2022, 32(1): 30. doi: 10.1016/j.tcb.2021.07.001 [2] LI C, ZHOU YN, KIM J, et al. Regulation of SIRT2 by Wnt/β-catenin signaling pathway in colorectal cancer cells[J]. Biochim Biophys Acta Mol Cell Res, 2021, 181(3): 475. [3] MAHDESSIAN D, CESNIK AJ, GNANN C, et al. Spatiotemporal dissection of the cell cycle with single-cell proteogenomics[J]. Nature, 2021, 590(7847): 649. doi: 10.1038/s41586-021-03232-9 [4] AMANO H, CHAUDHURY A, RODRIGUEZ-AGUAYO C, et al. Telomere dysfunction induces sirtuin repression that drives telomere-dependent disease[J]. Cell Metab, 2019, 29(6): 1274. doi: 10.1016/j.cmet.2019.03.001 [5] HUMPHREY K, ZHU LS, HICKMAN M, et al. Evolution of distinct responses to low NAD+ stress by rewiring the Sir2 deacetylase network in yeasts[J]. Genetics, 2020, 6(4): 855. [6] SMITH JT, WHITE JW, DUNGRAWALA H, et al. Yeast lifespan variation correlates with cell growth and SIR2 expression[J]. PLoS One, 2018, 18(7): 102. [7] LI MG, FINE R, DINDA M, et al. A Sir2-regulated locus control region in the recombination enhancer of Saccharomyces cerevisiae specifies chromosome Ⅲ structure[J]. PLoS Genet, 2019, 23(8): 5. [8] BEHRINGER R, GERTSENSTEIN M, NAGY KV, et al. Administration of gonadotropins for superovulation in mice[J]. Cold Spring Harb Protoc, 2018(1): 73. [9] 赵义清. 体外培养受精卵第一次卵裂的调控因素的研究[D]. 武汉: 华中科技大学, 2010. [10] WANG YZ, LI SY, LIU MG, et al. Rhodosporidiumtoruloides sir2-like genes remodelled the mitochondrial network to improve the phenotypes of ageing cells[J]. Free Radic Biol Med, 2018, 23(6): 64. [11] LI SY, FEI ZB, XU ZR, et al. Enterococcus faecalis sir2-like gene enhances aerobic metabolism of themselves and mitochondrial respiration of mammal cells to bring about improving metabolic syndrome through the PGC-1α pathway[J]. J Tissue Eng Regen Med, 2019, 14(2): 143. [12] SERRANO L, MARTÍNEZ-REDONDO P, MARAZUELA-DUQUE A, et al. The tumor suppressor SirT2 regulates cell cycle progression and genome stability by modulating the mitotic deposition of H4K20 methylation[J]. Genes Dev, 2013, 27(6): 639. doi: 10.1101/gad.211342.112 [13] YI F, ZHANG Y, WANG Z, et al. The deacetylation-phosphorylation regulation of SIRT2-SMC1A axis as a mechanism of antimitotic catastrophe in early tumorigenesis[J]. Sci Adv, 2021, 7(9): 5518. doi: 10.1126/sciadv.abe5518 [14] GU L, ZHU YH, LIN X, et al. Stabilization of FASN by ACAT1-mediated GNPAT acetylation promotes lipid metabolism and hepatocarcinogenesis[J]. Oncogene, 2020, 15(11): 2437. [15] JEON HJ, OH JS. RASSF1A regulates spindle organization by modulating tubulin acetylation via SIRT2 and HDAC6 in mouse oocytes[J]. Front Cell Dev Biol, 2020, 32(8): 998. [16] HE QK, CHEN K, YE RF, et al. Associations of sirtuins with clinicopathological variables and prognosis in human ovarian cancer[J]. Oncol Lett, 2020, 48(4): 3278. [17] VAQUERO A, SCHER MB, LEE DH, et al. SirT2 is a histone deacetylase with preference for histone H4 Lys 16 during mitosis[J]. Genes Dev, 2006, 20(10): 1256. doi: 10.1101/gad.1412706 -





 下载:
下载: