-
卒中后抑郁症(post-stroke depression,PSD)是一种卒中神经精神后遗症,是病人功能和治疗结果的重要指标[1]。PSD会干扰卒中的恢复,并与卒中的严重程度、认知障碍和死亡率增加有关[2]。因此,PSD的早期诊断和干预有利于卒中病人的功能恢复。然而,对临床人群中PSD病因机制的研究是有限的。情绪障碍的发生和发展与卒中引起的炎症因子密切相关[3]。研究[4]表明,白细胞介素(IL-10)可以通过降低细胞因子表达和抑制受体激活来限制炎症。IL-10被描述为一种细胞因子合成抑制因子,可以削弱效应器功能,使多个细胞失活,减少内皮细胞损伤,改善血管功能障碍。因此,IL-10在卒中后的炎症反应中发挥抗炎作用[5]。临床研究[6]表明,低IL-10水平与卒中后急性神经系统疾病的发生有关,表明其可能有助于预测PSD。过氧化氢酶(CAT)是一种细胞内抗氧化酶,可将活性氧代谢为毒性较小的分子,并将过氧化氢催化为水和氧气[7]。研究[8]报道,缺血性卒中病人血清CAT水平明显低于对照组,并且血清CAT水平降低可能是PSD发病率的独立预测因素。目前,PSD与IL-10和CAT水平之间的精确关系尚未深入研究,特别是在急性缺血性卒中病人临床随访的PSD发生方面。因此,本研究的主要目的是调查急性缺血性卒中病人入院时IL-10和CAT水平与PSD发生之间的具体关系。
-
本研究是基于医院的观察性队列研究。我们招募了151例于2020年6月至2021年5月在本院神经科病房住院的急性缺血性卒中病人,均符合世界卫生组织(WHO)标准的急性缺血性卒中诊断标准,其中不包括:(1)有任何中枢神经系统疾病史者,例如外伤、脑积水、痴呆、帕金森病、肿瘤和脑出血;(2)有精神或情绪障碍病史(临床诊断或既往治疗);(3)严重卒中、失语症和视觉或听觉障碍无法进行评估;(4)恶性肿瘤、严重急性感染、自身免疫性疾病等其他疾病,或者心力衰竭、肝肾功能不全等严重器官功能障碍。在纳入之前,从每位病人或其亲属获得知情同意书。
-
入院前72 h记录每例病人的基本信息,包括人口学统计数据(年龄、性别和受教育年限)、血管危险因素(吸烟、饮酒、高血压、高脂血症、糖尿病和心脏病)及体质量指数(BMI)。根据急性卒中Org10172治疗试验(TOAST)标准,卒中亚型大致分为4种亚型:动脉粥样硬化型、心源性栓塞型、腔隙型和其他病因类型[9]。
所有病人均在入院后72h内使用磁共振成像(MRI)扫描进行检查。收集MRI数据,使用公式A=0.5×a×b×c计算梗死区域的大小(a:最大纵向直径;b:垂直于a的最大横向直径;c:包含梗死的5 mm切片的数量)。
-
神经科医生在入院和出院后24 h内使用美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)评分评估卒中严重程度。轻度卒中定义为NIHSS评分 < 7。使用Barthel指数(Barthel index,BI)评估卒中的功能结果,该指数独立反映病人的生活能力。1个月后,使用改良的Rankin量表(modified rankin scale,mRS)对病人进行评估;mRS评分≥3表明恢复异常[10]。
由神经科医生或精神科医生使用17项汉密尔顿抑郁量表(Hamilton depression scale,HAMD)在病人被诊断为卒中后1个月内对病人进行抑郁症评估。根据精神疾病诊断和统计手册第5版(Diagnostic and statistical manual of mental disorders, 5th edition,DSM-V)标准,HAMD评分≥8被确认为PSD[11]。
-
入院后第2天早上收集病人的空腹血样,以3 000 r/min的转速离心10 min,分离血浆,并在测定前立即将等分试样-80 ℃储存。样品在分析前仅解冻一次。血清IL-10和CAT抗体浓度通过市售的酶联免疫吸附试验(上海信帆生物科技有限公司)测量。本研究中使用的所有程序都严格按照说明进行。通过酶标仪在450 nm波长处测量光密度值。然后,我们根据标准曲线计算了IL-10和CAT的浓度。所有标准品和样品均在双孔中进行测试。IL-10的批间和批内变异系数分别为11%和9%。CAT的批间和批内变异系数分别为11%和9%。其他实验室参数,如血小板和高敏C反应蛋白(hs-CRP),在医院的中央生化实验室使用AU2700全自动生化分析仪(美国Beckman Coulter公司)进行测试。
-
采用t检验、χ2检验、Mann-Whitney U检验、logistic回归分析和ROC曲线分析。
-
151例病人的平均年龄为(62.73±9.89)岁,其中89例(58.9%)为男性。入院时有28例(18.5%)患有严重卒中(NIHSS≥7),NIHSS评分中位数为3 (IQR:2~5)。病人的平均住院时间为9.00 d(IQR:7.00~12.00)。出院时BI评分为85.00 (IQR:75.00~100.00),出院时NIHSS评分为3.00 (IQR:1.00~5.00)。39例病人(27.1%)在1个月内出现不良结果(mRS评分≥3)。脑梗死后1个月开始随访,有51例(33.8%)病人被诊断为PSD。与非PSD病人相比,PSD组入院和出院时NIHSS评分较高,脑梗死体积较大,BI评分较低,mRS评分较高(P<0.05)(见表 1),血清CAT、IL-10水平较低(P<0.01)(见表 2)。
分组 n 年龄(x±s)/岁 男[n; 百分率(%)] 体质量(x±s)/kg 身高(x±s)/cm BMI(x±s)/(kg/m2) 受教育年限▲/年 PSD 51 62.10±9.70 31 (60.8) 63.49±10.08 163.65±8.15 23.65±2.91 3.00 (0.00~6.00) 非PSD 100 63.17±9.95 58 (58.0) 63.41±10.63 162.97±7.18 23.82±3.33 3.50 (0.00~6.00) t — 0.61 0.11△ 0.01 0.58 0.38 1.19* P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 血管危险因素[n; 百分率(%)] 高血压 高脂血症 糖尿病 心脏病 抽烟 饮酒 PSD 43 (84.3) 10 (19.6) 19 (37.3) 4 (7.8) 17 (33.3) 12 (23.5) 非PSD 85 (85.0) 17 (17.0) 30 (30.0) 14 (14.0) 30 (30.0) 27 (27.0) t 0.01△ 0.16△ 0.81△ 1.22△ 0.18△ 0.21△ P >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 病变部位[n; 百分率(%)] TOAST亚型[n; 百分率(%)] 脑叶 基底神经节和丘脑 脑干和小脑 多发性梗死 动脉粥样硬化型 心源性栓塞型 腔隙型 其他病因类型 PSD 3 (5.9) 25 (49.0) 11 (21.6) 12 (23.5) 40 (78.4) 2 (3.9) 9 (17.6) 0 (0) 非PSD 8 (8.0) 50 (50.0) 23 (23.0) 19 (19.0) 60 (60.0) 11 (11.0) 28 (28.0) 1 (1.0) t 0.58△ — P >0.05 <0.05 分组 梗死体积▲/cm3 入院时NIHSS▲评分 出院时NIHSS▲评分 住院时间▲/d 出院时BI▲ 1个月时mRS▲ PSD 1.95 (0.86~5.33) 5.00 (2.00~7.00) 4.00 (2.00~6.00) 9.00 (8.00~12.00) 80.00(70.00~90.00) 1.80(1.00~3.00) 非PSD 0.97 (0.38~2.15) 3.00 (2.00~4.00) 3.00 (1.00~4.00) 9.00 (7.00~11.00) 90.00(80.00~100.00) 1.60 (1.00~3.00) t 5.27* 4.91* 5.08* 1.44* 5.42* 5.41* P <0.05 <0.05 <0.05 >0.05 <0.01 <0.01 △示χ2值;*示Z值;▲示IQR值 表 1 缺血性卒中后PSD和非PSD病人的基线特征
分组 Hs-CRP▲/mmol/L) 血小板/(109/L) CAT/(U/L) IL-10/(pg/mL) PSD 5.32 (4.31~7.85) 232.02±69.11 0.60 (0.39~1.17) 1.55 (0.58~3.70) 非PSD 4.84 (4.23~5.91) 210.71±53.77 1.43 (0.65~2.83) 3.68 (2.52~5.08) t 1.43* 1.17 9.43* 12.77* P >0.05 >0.05 <0.01 <0.01 *示Z值;▲示IQR值 表 2 2组血生化指标比较(x±s)
-
通过单变量logistic回归分析,IL-10和CAT是PSD的保护性预测因子(P < 0.05)。在调整了包括一般人口学因素、入院和出院时的NIHSS评分、BI评分、1个月后mRS评分、TOAST亚型在内的潜在混杂因素(在单变量logistic回归分析中,P < 0.05)后,IL-10(OR=0.615,95%CI:0.410~0.923)和CAT(OR=0.757,95%CI:0.652~0.914)仍然是PSD的独立预测因子(见表 3)。
特征 模型1 模型2 B SE Waldχ2 OR(95%CI) P B SE Waldχ2 OR(95%CI) P TOAST亚型 0.671 0.260 2.58 0.648 (0.424~0.990) <0.05 — — — — — 入院时NIHSS评分 0.316 0.132 3.09 1.170 (1.043~1.314) <0.05 — — — — — 出院时NIHSS评分 0.198 0.062 3.20 1.192 (1.059~1.342) <0.05 — — — — — 出院时BI 0.576 0.308 3.32 0.944 (0.914~0.976) <0.05 — — — — — 1个月后的mRS 0.316 0.132 3.28 1.823 (1.269~2.617) <0.05 — — — — — CAT/(U/L) 0.107 0.048 2.24 0.706 (0.610~0.912) <0.05 0.283 0.037 2.14 0.757 (0.652~0.914) <0.05 IL-10 /(pg/mL) 0.147 0.050 3.14 0.529 (0.343~0.815) <0.05 0.021 0.023 2.43 0.615 (0.410-0.923) <0.05 注:模型1未调整,模型2调整 表 3 PSD患病情况的多因素logistic分析
-
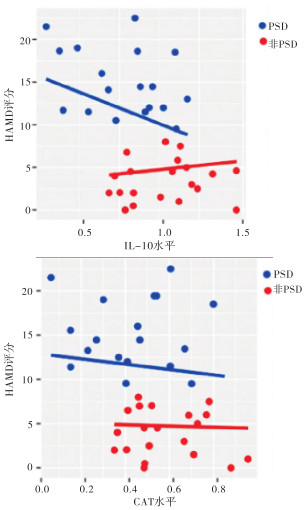
与非PSD病人相比,PSD病人的IL-10水平(1.55 pg/mL,IQR:0.58~3.70 pg/mL vs.3.68 pg/mL,IQR:2.52~5.08 pg/mL;P < 0.01)和CAT水平(0.60 U/L,IQR:0.39~1.17 U/L vs.1.43 U/L,IQR:0.65~2.83 U/L;P < 0.01)显著降低(见表 1)。此外,在双变量相关分析中,PSD病人的IL-10水平(r=0.394,P < 0.01)和CAT水平(r=0.306,P < 0.01)与HAMD评分呈负相关,非PSD病人中未观察到IL-10水平和CAT水平与HAMD评分存在相关性(见图 1)。
-
ROC分析结果发现血清IL-10水平的截止点为2.06 pg/mL,预测PSD的AUC为0.739;同时,CAT水平的截止点为1.07 U/L,预测PSD的AUC为0.630(见图 2)。PSD与CAT水平和IL-10水平之间的双变量分析显示,IL-10水平较低(< 2.06 pg/mL)的病人比对应组(≥2.06 pg/mL)更容易发生PSD (P < 0.01)。同样,CAT水平较低(< 1.07 U/L)的病人比对应组(≥1.07 U/L)更容易发生PSD(P < 0.05)(见表 4)。
变量 PSD 非PSD OR(95%CI) P n % n % IL-10/(pg/mL) < 2.06 40 78.4 14 14.0 9.750(2.671~35.534) < 0.01 ≥2.06 11 21.6 86 86.0 1.00 CAT/(U/L) < 2.06 28 54.9 35 35.0 5.052(1.256~20.322) < 0.05 ≥1.07 23 45.1 65 65.0 1.00 表 4 CAT水平和IL-10水平分类与PSD之间关联的双变量分析
-
在本研究中,CAT水平和IL-10水平与HAMD评分之间存在显著相关性。在调整潜在混杂因素后,IL-10、CAT是PSD的独立预测因子。此外,IL-10、CAT可能在卒中进展中发挥保护作用,因为非PSD病人的血清IL-10、CAT水平显著增加。因此,急性缺血性卒中病人血清IL-10、CAT水平降低促进PSD发展。
目前,PSD的机制尚未明确。炎症反应的失调被认为是参与PSD进展的最重要因素之一[12]。IL-10是一种炎性细胞因子,在卒中和脑损伤中起着至关重要的免疫调节作用[4, 13]。最近,越来越多的证据表明IL-10在情绪障碍的发病机制中的作用[14-15]。一项基于人群的研究评估了年轻受试者中与情绪障碍相关的细胞因子水平,包括重度抑郁症(MDD)和双相情感障碍(BD),并证实MDD和BD病人的血清IL-10水平低于健康对照组[14]。本研究显示IL-10与PSD呈负相关,这与以往研究[16]一致。然而,另一项研究[17]发现抑郁症病人和健康对照者的血清IL-10水平没有显著差异。此外,本研究发现IL-10水平与PSD病人的HAMD评分之间存在负相关,而与非PSD病人的HAMD评分之间无任何相关性。目前关于抑郁症病人IL-10水平的波动仍不清楚。一些研究假设前馈回路通过其免疫调节/抗炎作用抑制炎症过程,这可能是由IL-6驱动的IL-10释放诱导引起的。因此,在某些阶段,会出现涉及IL-10水平升高的炎症反应;然而,随着疾病的发展,IL-10水平会下降,这会加重症状[14]。
血清CAT在PSD病理生理学中的作用仍然未知。据报道,缺血性卒中会激活炎症通路,而促炎细胞因子反过来会放大氧化应激反应[18]。最近的研究表明,外源性CAT可能是通过结合或阻断负责胃炎症级联反应的相关信号来调节氧化应激诱导的胃炎的功能分子[19]。大脑以高耗氧量和低抗氧化防御为特征,特别容易受到氧化损伤。氧化性DNA损伤已被确定为与急性中枢神经系统损伤和神经系统疾病相关的神经退行性变的重要因素。特别是,已发现未经检查的氧化性DNA损伤与一系列信号事件的激活有关,例如p53和聚(ADP-核糖)聚合酶-1,它们已被证明可促进缺血性卒中后的神经元丢失[20]。在本研究中,PSD病人的血清CAT水平降低。降低的CAT水平可能与PSD病人在急性期过度产生的活性氧有关。我们的结果与最近支持血清CAT水平降低可能是急性抑郁症指标的证据一致[21]。
总之,本研究表明,在调整潜在混杂因素后,血清IL-10、CAT水平可用作急性缺血性卒中病人PSD的独立保护性预测因子。IL-10、CAT水平低的病人在卒中后1个月更有可能发生PSD。应监测卒中病人的低IL-10、CAT水平,并采取适当的干预措施。需要进一步的研究来证实这种关联,这可能为PSD的发展提供新的建议。
白细胞介素10和过氧化氢酶对急性缺血性卒中病人卒中后抑郁的预测价值
Predictive value of interleukin-10 and catalase for post-stroke depression in patients with acute ischemic stroke
-
摘要:
目的探讨白细胞介素10(IL-10)和过氧化氢酶(CAT)对急性缺血性卒中病人卒中后抑郁(PSD)的预测价值。 方法151例急性缺血性卒中病人入院后24 h内测定血清IL-10、CAT水平。使用17项汉密尔顿抑郁量表(HAMD-17)来评估抑郁症状;PSD定义为HAMD评分≥8。 结果脑梗死后1个月开始随访,有51例(33.8%) 被诊断为PSD。与非PSD病人相比,PSD组入院和出院时NIHSS评分较高,脑梗死体积较大,BI评分较低,mRS评分较高,血清CAT、IL-10水平较低(P < 0.05)。在调整了潜在混杂因素(在单变量逻辑回归分析中,P < 0.05)后,IL-10(OR=0.615,95%CI:0.410~0.923)和CAT(OR=0.757,95%CI:0.652~0.914)仍然是PSD的独立预测因子。PSD病人的IL-10水平(r=0.394,P < 0.01)和CAT水平(r=0.306,P < 0.01)与HAMD评分呈负相关。ROC分析显示,血清IL-10水平的截止点为2.06 pg/mL,预测PSD的AUC为0.739。同时,CAT水平的截止点为1.07 U/L,预测PSD的AUC为0.630。IL-10水平较低(< 2.06 pg/mL)的病人比对应组(≥2.06 pg/mL)更容易发生PSD (OR=9.750,95%CI=2.671~35.534,P < 0.01)。同样,CAT水平较低(< 1.07 U/L)的病人比对应组(≥1.07 U/L)更容易发生PSD (OR=5.052,95%CI=1.256~20.322,P < 0.05)。 结论血清IL-10、CAT可用作急性缺血性卒中病人PSD的独立保护性预测因子。IL-10、CAT水平低的病人在卒中后1个月更有可能发生PSD。 Abstract:ObjectiveTo investigate the predictive value of interleukin-10 (IL-10) and catalase (CAT) in post-stroke depression (PSD) in patients with acute ischemic stroke. MethodsSerum IL-10 and CAT levels in 151 patients with acute ischemic stroke within 24 h of hospital admission were measured.Depressive symptoms were assessed using the 17-item Hamilton depression scale (HAMD-17), and PSD was defined as a HAMD score ≥8. ResultsAt 1-month follow-up after stroke, 51 (33.8%) patients were diagnosed with PSD.Compared with non-PSD patients, the PSD group had higher NIHSS scores at admission and discharge, larger cerebral infarction volume, lower BI score, higher mRS score, and lower serum CAT and IL-10 levels (P < 0.05).After adjusting for potential confounders (P < 0.05 in univariate logistic regression analysis), IL-10 (OR=0.615, 95%CI: 0.410-0.923) and CAT (OR=0.757, 95%CI: 0.652-0.914) were independent predictors of PSD.IL-10 levels (r=0.394, P < 0.01) and CAT levels (r=0.306, P < 0.01) were negatively correlated with HAMD scores in PSD patients.ROC analysis showed that the cutoff point for serum IL-10 levels was 2.06 pg/mL, and the AUC for predicting PSD was 0.739.Meanwhile, the cutoff point for the CAT level was 1.07 U/L, and the AUC for predicting PSD was 0.630.Patients with lower IL-10 levels (< 2.06 pg/mL) were more likely to develop PSD than their counterparts (≥2.06 pg/mL) (OR=9.750, 95%CI=2.671-35.534, P < 0.01).Meanwhile, patients with lower CAT levels (< 1.07 U/L) were more likely to develop PSD than their counterparts (≥1.07 U/L) (OR=5.052, 95%CI=1.256-20.322, P < 0.05). ConclusionsSerum IL-10 and CAT can be used as independent protective predictors of PSD in patients with acute ischemic stroke.Patients with low levels of IL-10 and CAT are more likely to develop PSD 1 month after stroke. -
Key words:
- acute ischemic stroke /
- interleukin 10 /
- catalase /
- post-stroke depression
-
表 1 缺血性卒中后PSD和非PSD病人的基线特征
分组 n 年龄(x±s)/岁 男[n; 百分率(%)] 体质量(x±s)/kg 身高(x±s)/cm BMI(x±s)/(kg/m2) 受教育年限▲/年 PSD 51 62.10±9.70 31 (60.8) 63.49±10.08 163.65±8.15 23.65±2.91 3.00 (0.00~6.00) 非PSD 100 63.17±9.95 58 (58.0) 63.41±10.63 162.97±7.18 23.82±3.33 3.50 (0.00~6.00) t — 0.61 0.11△ 0.01 0.58 0.38 1.19* P — >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 血管危险因素[n; 百分率(%)] 高血压 高脂血症 糖尿病 心脏病 抽烟 饮酒 PSD 43 (84.3) 10 (19.6) 19 (37.3) 4 (7.8) 17 (33.3) 12 (23.5) 非PSD 85 (85.0) 17 (17.0) 30 (30.0) 14 (14.0) 30 (30.0) 27 (27.0) t 0.01△ 0.16△ 0.81△ 1.22△ 0.18△ 0.21△ P >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 分组 病变部位[n; 百分率(%)] TOAST亚型[n; 百分率(%)] 脑叶 基底神经节和丘脑 脑干和小脑 多发性梗死 动脉粥样硬化型 心源性栓塞型 腔隙型 其他病因类型 PSD 3 (5.9) 25 (49.0) 11 (21.6) 12 (23.5) 40 (78.4) 2 (3.9) 9 (17.6) 0 (0) 非PSD 8 (8.0) 50 (50.0) 23 (23.0) 19 (19.0) 60 (60.0) 11 (11.0) 28 (28.0) 1 (1.0) t 0.58△ — P >0.05 <0.05 分组 梗死体积▲/cm3 入院时NIHSS▲评分 出院时NIHSS▲评分 住院时间▲/d 出院时BI▲ 1个月时mRS▲ PSD 1.95 (0.86~5.33) 5.00 (2.00~7.00) 4.00 (2.00~6.00) 9.00 (8.00~12.00) 80.00(70.00~90.00) 1.80(1.00~3.00) 非PSD 0.97 (0.38~2.15) 3.00 (2.00~4.00) 3.00 (1.00~4.00) 9.00 (7.00~11.00) 90.00(80.00~100.00) 1.60 (1.00~3.00) t 5.27* 4.91* 5.08* 1.44* 5.42* 5.41* P <0.05 <0.05 <0.05 >0.05 <0.01 <0.01 △示χ2值;*示Z值;▲示IQR值 表 2 2组血生化指标比较(x±s)
分组 Hs-CRP▲/mmol/L) 血小板/(109/L) CAT/(U/L) IL-10/(pg/mL) PSD 5.32 (4.31~7.85) 232.02±69.11 0.60 (0.39~1.17) 1.55 (0.58~3.70) 非PSD 4.84 (4.23~5.91) 210.71±53.77 1.43 (0.65~2.83) 3.68 (2.52~5.08) t 1.43* 1.17 9.43* 12.77* P >0.05 >0.05 <0.01 <0.01 *示Z值;▲示IQR值 表 3 PSD患病情况的多因素logistic分析
特征 模型1 模型2 B SE Waldχ2 OR(95%CI) P B SE Waldχ2 OR(95%CI) P TOAST亚型 0.671 0.260 2.58 0.648 (0.424~0.990) <0.05 — — — — — 入院时NIHSS评分 0.316 0.132 3.09 1.170 (1.043~1.314) <0.05 — — — — — 出院时NIHSS评分 0.198 0.062 3.20 1.192 (1.059~1.342) <0.05 — — — — — 出院时BI 0.576 0.308 3.32 0.944 (0.914~0.976) <0.05 — — — — — 1个月后的mRS 0.316 0.132 3.28 1.823 (1.269~2.617) <0.05 — — — — — CAT/(U/L) 0.107 0.048 2.24 0.706 (0.610~0.912) <0.05 0.283 0.037 2.14 0.757 (0.652~0.914) <0.05 IL-10 /(pg/mL) 0.147 0.050 3.14 0.529 (0.343~0.815) <0.05 0.021 0.023 2.43 0.615 (0.410-0.923) <0.05 注:模型1未调整,模型2调整 表 4 CAT水平和IL-10水平分类与PSD之间关联的双变量分析
变量 PSD 非PSD OR(95%CI) P n % n % IL-10/(pg/mL) < 2.06 40 78.4 14 14.0 9.750(2.671~35.534) < 0.01 ≥2.06 11 21.6 86 86.0 1.00 CAT/(U/L) < 2.06 28 54.9 35 35.0 5.052(1.256~20.322) < 0.05 ≥1.07 23 45.1 65 65.0 1.00 -
[1] 孙函林, 柴震, 雷超, 等. 卒中后抑郁与抑郁症事件相关电位变化特点和对比研究[J]. 中国神经精神疾病杂志, 2020, 46(1): 33. [2] 湛清扬, 孔繁一, 吕亚男, 等. 综述脑卒中后抑郁发病机制的研究进展[J]. 中风与神经疾病杂志, 2022, 39(4): 369. [3] FENG Y, LI X, WANG J, et al. Pyruvate kinase M2 (PKM2) improve symptoms of post‐ischemic stroke depression by activating VEGF to mediate the MAPK/ERK pathway[J]. Brain Behav, 2022, 12(1): e2450. doi: 10.1002/brb3.2450 [4] LI X, FANG P, SUN Y, et al. Anti-inflammatory cytokines IL-35 and IL-10 block atherogenic lysophosphatidylcholine-induced, mitochondrial ROS-mediated innate immune activation, but spare innate immune memory signature in endothelial cells[J]. Redox Biol, 2020, 28: 101373. doi: 10.1016/j.redox.2019.101373 [5] ZHANG L, ZHANG L, SUI R. Ganoderic acid A-mediated modulation of microglial polarization is involved in depressive-like behaviors and neuroinflammation in a rat model of post-stroke depression[J]. Neuropsychiatr Dis Treat, 2021, 17: 2671. doi: 10.2147/NDT.S317207 [6] KULESH A, DROBAKHA V, KUKLINA E, et al. Cytokine response, tract-specific fractional anisotropy, and brain morphometry in post-stroke cognitive impairment[J]. J Stroke Cerebrovasc Dis, 2018, 27(7): 1752. doi: 10.1016/j.jstrokecerebrovasdis.2018.02.004 [7] DONG PT, JUSUF S, HUI J, et al. Photoinactivation of catalase sensitizes a wide range of bacteria to ROS-producing agents and immune cells[J]. JCI Insight, 2022, 7(10): e153079. doi: 10.1172/jci.insight.153079 [8] MACKENZIE JL, IVANOVA N, NELL HJ, et al. Microglial inflammation and cognitive dysfunction in comorbid rat models of striatal ischemic stroke and alzheimer's disease: effects of antioxidant catalase-SKL on behavioral and cellular pathology[J]. Neuroscience, 2022, 487: 47. doi: 10.1016/j.neuroscience.2022.01.026 [9] 徐昕, 张汤钦, 吴康飞, 等. 急性前循环大血管闭塞性卒中侧支循环不良患者机械取栓预后影响因素分析[J]. 中国脑血管病杂志, 2021, 18(8): 509. [10] YANG JL, LIN CM, HSU YL. Long-term functionality prediction for first time ischemic middle cerebral artery stroke patients receiving conventional medical treatment[J]. Neuropsychiatr Dis Treat, 2022, 18: 275. doi: 10.2147/NDT.S350266 [11] HUANG G, CHEN H, WANG Q, et al. High platelet-to-lymphocyte ratio are associated with post-stroke depression[J]. J Affect Disord, 2019, 246: 105. doi: 10.1016/j.jad.2018.12.012 [12] FENG B, MENG X, ZHOU H, et al. Identification of dysregulated mechanisms and potential biomarkers in ischemic stroke onset[J]. Int J Gen Med, 2021, 14: 4731. doi: 10.2147/IJGM.S327594 [13] 孙悦. LNG-IUS对子宫内膜息肉电切术病人雌孕激素, 炎性因子及子宫内膜组织中IGF-Ⅰ及受体的影响[J]. 蚌埠医学院学报, 2022, 47(7): 893. doi: 10.13898/j.cnki.issn.1000-2200.2022.07.013 [14] WIENER CD, MOREIRA FP, PORTELA LV, et al. Interleukin-6 and Interleukin-10 in mood disorders: a population-based study[J]. Psychiatry Res, 2019, 273: 685. doi: 10.1016/j.psychres.2019.01.100 [15] LAUMET G, EDRALIN JD, CHIANG ACA, et al. Resolution of inflammation-induced depression requires T lymphocytes and endogenous brain interleukin-10 signaling[J]. Neuropsychopharmacology, 2018, 43(13): 2597. doi: 10.1038/s41386-018-0154-1 [16] AL-FADHEL SZ, AL-HAKEIM HK, AL-DUJAILI AH, et al. IL-10 is associated with increased mu-opioid receptor levels in major depressive disorder[J]. Eur Psychiatry, 2019, 57: 46. doi: 10.1016/j.eurpsy.2018.10.001 [17] ENACHE D, PARIANTE CM, MONDELLI V. Markers of central inflammation in major depressive disorder: a systematic review and meta-analysis of studies examining cerebrospinal fluid, positron emission tomography and post-mortem brain tissue[J]. Brain Behav Immun, 2019, 81: 24. [18] 吴玉佳, 高健美, 龚其海. 过氧化物酶体增殖物激活受体PPAR在缺血性脑卒中作用的研究进展[J]. 中国药理学通报, 2022, 38(5): 655. [19] RAISH M, SHAHID M, BIN JARDAN YA, et al. Gastroprotective effect of sinapic acid on ethanol-induced gastric ulcers in rats: involvement of Nrf2/HO-1 and NF-κB signaling and antiapoptotic role[J]. Front Pharmacol, 2021, 12: 101. [20] DAVIS CK, VEMUGANTI R. DNA damage and repair following traumatic brain injury[J]. Neurobiol Dis, 2021, 147: 105143. doi: 10.1016/j.nbd.2020.105143 [21] LIU Z, CAI Y, HE J. High serum levels of 8-OHdG are an independent predictor of post-stroke depression in Chinese stroke survivors[J]. Neuropsychiatr Dis Treat, 2018, 14: 587. doi: 10.2147/NDT.S155144 -





 下载:
下载: