-
我国肺癌发病率与死亡率逐年上升,目前肺癌发病机制尚未完全阐明,长链非编码RNA(LncRNA)是一种长度超过220 nt的非编码RNA,LncRNA与微小RNA(miRNA)之间存在相互作用,其基因序列上含有多个miRNA的结合位点,并可通过调控miRNA转录过程从而参与肿瘤发生及发展过程,已知敲低LncRNA XIST通过激活miR-335/SOD2/ROS信号途径而抑制非小细胞肺癌的发展[1]。LncRNA Gm15290通过与肿瘤抑制因子miR-615-5p直接相互作用从而促进肺癌细胞的增殖和侵袭[2]。LncRNA MALAT1通过调节miR-124/STAT3轴促进非小细胞肺癌的发展[3]。LncRNA TUC338通过激活MAPK途径促进肺癌的侵袭[4]。LncRNA LRRC75A-AS1通过调控BAALC从而促进三阴性乳腺癌细胞的增殖和侵袭[5]。但LRRC75A-AS1在肺癌中的表达及其可能作用机制尚未阐明。靶基因预测显示miR-22-3p与LRRC75A-AS1存在结合位点,miR-22-3p在非小细胞肺癌中表达水平降低,LncRNA NNTAS1通过调节miR-22-3p/YAP1轴促进非小细胞肺癌的进展[6]。但LRRC75A-AS1/miR-22-3p分子轴在肺癌发生过程中的作用机制尚未阐明。因此,本研究主要探讨LRRC75A-AS1对肺癌细胞增殖、凋亡、迁移的影响及其对miR-22-3p的调控作用。
-
收集2018年3月至2019年2月期间于本院接受手术治疗的43例肺癌病人的肺癌组织及癌旁组织(>5 cm)标本,所有病人均经病理诊断为肺腺癌,TNM分期:Ⅰ期22例、Ⅱ期18例、Ⅲ期3例。其中男23例,女20例,年龄55~68岁,平均(62.38±6.32)岁。本研究经本院伦理委员会批准,所有病人知情且签署同意书。人肺癌细胞A549购自上海匹拓生物科技有限公司;DMEM培养基购自美国Gibco;胎牛血清购自美国Hyclone;Lipofectamine2000、凋亡检测试剂与MTT试剂购自北京索莱宝;Trizol试剂购自美国Invitrogen;反转录试剂盒、SYBR Green试剂盒购自北京天根生化;si-NC、si-LRRC75A-AS1、miR-NC、miR-22-3p mimics、si-LRRC75A-AS1与anti-miR-NC、si-LRRC75A-AS1与miR-22-3p inhibitor购自广州锐博生物。
-
A549细胞(2.5×105个/毫升)接种于96孔板(100微升/孔),按照Lipofectamine2000转染试剂说明书分别将si-NC、si-LRRC75A-AS1、si-LRRC75A-AS1与anti-miR-NC、si-LRRC75A-AS1与miR-22-3p inhibitor转染入A549细胞,分别记为si-NC组、si-LRRC75A-AS1组、si-LRRC75A-AS1+anti-miR-NC组、si-LRRC75A-AS1+miR-22-3p inhibitor组。
-
采用Trizol法提取癌旁组织、肺癌组织与各组A549细胞总RNA,反转录体系:5×Reaction Buffer 2 μL,10×King RT Buffer 2 μL,FastKing RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNA(2 μg),RNase-Free ddH2O补足体系至20 μL;反应条件:42 ℃ 15 min,95 ℃ 3 min。参照荧光定试剂盒说明书检测。
-
收集各组A549细胞(2.5×105个/毫升)接种于96孔板(100微升/孔),每孔加入MTT溶液20 μL,于培养箱内继续培养4 h后弃上清液,每孔加入150 μL DMSO后室温孵育5 min,应用多功能酶标仪检测各孔吸光度(OD)值并计算细胞存活率[实验组OD值/对照组OD值×100%]。
-
收集各组A549细胞接种于6孔板,每孔加入细胞数量为500个,于培养箱内继续培养14 d,每3 d更换一次培养液,培养结束后弃培养液,加入甲醇500 μL,将其置于-20 ℃冰箱内孵育20 min,弃甲醇后加入1%结晶紫染色液400 μL,染色时间为15 min,采用蒸馏水洗涤后晾干。
-
收集各组A549细胞加入预冷PBS洗涤,弃上清后收集细胞沉淀,将500 μL结合缓冲液加入其中后分别加入5 μL Annexin V-FITC、5 μL PI,室温振荡孵育10 min后应用FACS Calibur流式细胞仪检测细胞凋亡率。
-
取对数生长期A549细胞(2.5×105个/毫升)接种于6孔板(100微升/孔),在培养板底部水平画线,继续培养48 h后测量细胞迁移距离。
-
LncBase v.2预测显示LRRC75A-AS1与miR-22-3p存在结合位点,构建野生型载体WT-LRRC75A-AS1、突变型载体MUT-LRRC75A-AS1,miR-NC、miR-22-3p mimics分别与WT-LRRC75A-AS1、MUT-LRRC75A-AS1共转染入A549细胞后继续培养48 h,收集细胞后检测荧光素酶活性。
-
提取各组A549细胞总蛋白,并检测蛋白浓度,检测方法参照BCA蛋白定量检测试剂盒说明书,蛋白变性后进行SDS-PAGE,转膜后使用5%脱脂奶粉封闭2 h,加入一抗稀释液(1∶1 000)(美国Santa Cruz)后置于4 ℃冰箱内孵育24 h,加入二抗稀释液(1∶2 000)(武汉艾美捷),将其置于室温条件下孵育1 h,滴加ECL,应用ImageJ软件分析各条带灰度值。
-
采用t检验和单因素方差分析。
-
与癌旁组织比较,肺癌组织中LRRC75A-AS1的表达水平升高(P < 0.01),miR-22-3p的表达水平降低(P < 0.01)(见表 1)。
分组 n LRRC75A-AS1 miR-22-3p 癌旁组织 43 1.01±0.13 1.00±0.12 肺癌组织 43 4.59±0.34 0.28±0.04 t — 64.49 37.33 P — < 0.01 < 0.01 表 1 LRRC75A-AS1和miR-22-3p在肺癌中的表达比较(x±s)
-
与si-NC组比较,si-LRRC75A-AS1组细胞存活率降低(P < 0.01),克隆形成数减少(P < 0.01),凋亡率升高(P < 0.01),Cleaved-caspase3蛋白水平升高(P < 0.01)(见表 2)。
分组 存活率/% 克隆形成数/个 凋亡率/% Cleaved-caspase3 si-NC 100.00 121.00±5.10 8.42±0.34 0.20±0.01 si-LRRC75A-AS1 54.45±2.21 58.67±2.49 25.59±0.80 0.68±0.05 t 35.70 19.02 34.21 16.31 P < 0.01 < 0.01 < 0.01 < 0.01 表 2 干扰LRRC75A-AS1对A549增殖凋亡的影响(x±s; ni=3)
-
与si-NC组比较,si-LRRC75A-AS1组划痕愈合率降低(P < 0.01),miR-22-3p的表达水平升高(P < 0.01)(见表 3)。
分组 LRRC75A-AS1 miR-22-3p 划痕愈合率/% si-NC 0.99±0.05 0.99±0.04 66.71±1.43 si-LRRC75A-AS1 0.23±0.01 3.47±0.07 32.56±0.95 t 25.82 53.28 34.45 P < 0.01 < 0.01 < 0.01 表 3 干扰LRRC75A-AS1对A549迁移的影响(x±s; ni=3)
-
LncBase v.2预测显示LRRC75A-AS1与miR-22-3p存在结合位点(见图 1)。miR-22-3p过表达可降低野生型载体WT-LRRC75A-AS1的荧光素酶活性(P < 0.01),而对突变型载体MUT-LRRC75A-AS1的荧光素酶活性无明显影响(P>0.05)(见表 4)。
分组 WT-LRRC75A-AS1 MUT-LRRC75A-AS1 miR-NC 0.98±0.05 1.00±0.05 miR-22-3p 0.24±0.01 0.99±0.03 t 25.14 0.30 P < 0.01 >0.05 表 4 双荧光素酶报告实验(x±s; ni=3)
-
与si-LRRC75A-AS1+anti-miR-NC组比较,si-LRRC75A-AS1+miR-22-3p inhibitor组细胞存活率升高(P < 0.01),克隆形成数增多(P < 0.01),凋亡率降低(P < 0.05),划痕愈合率升高(P < 0.01),Cleaved-caspase3蛋白水平降低(P < 0.01)(见表 5)。
分组 存活率/% 克隆形成数/个 凋亡率/% 划痕愈合率/% Cleaved-caspase3 si-LRRC75A-AS1+anti-miR-NC 54.61±2.28 57.67±2.49 25.63±0.99 32.52±0.98 0.67±0.06 si-LRRC75A-AS1+miR-22-3p inhibitor 88.75±3.22 106.67±3.68 13.11±0.55 55.30±1.18 0.30±0.03 t 14.99 19.10 19.15 25.72 9.55 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 表 5 抑制miR-22-3p可逆转干扰LRRC75A-AS1对A549增殖、凋亡、迁移的影响(x±s; ni=3)
-
LncRNA-miRNA-mRNA分子轴在肺癌发生及发展过程中的作用机制尚未完全阐明,LncRNA MALAT1通过调节miR-200a-3p促进非小细胞肺癌的进展[7]。LncRNA FEZF1-AS1通过调节WNT途径而增强非小细胞肺癌细胞上皮-间质转化(EMT)[8]。LncRNA linc00673通过充当miR-150-5p的海绵分子而调节非小细胞肺癌细胞增殖、迁移、侵袭及EMT[9]。LncRNA LINC00342通过靶向miR-203a-3p调节非小细胞肺癌细胞生长和转移[10]。但仍有部分LncRNA在肺癌中的作用机制尚未阐明。
LRRC75A-AS1在结直肠癌中表达水平降低,但相关研究[11-12]表明LRRC75A-AS1在急性髓细胞性白血病中表达水平升高。本研究结果显示,肺癌组织中LRRC75A-AS1的表达水平升高,干扰LRRC75A-AS1表达可明显降低肺癌细胞存活率,还可减少克隆形成数,提示干扰LRRC75A-AS1表达可抑制肺癌细胞增殖及克隆形成能力。caspase3激活后形成Cleaved-caspase3从而诱导细胞凋亡[13-14]。本研究结果显示,干扰LRRC75A-AS1表达可提高肺癌细胞凋亡率及Cleaved-caspase3的表达水平,提示干扰LRRC75A-AS1表达可促进肺癌细胞凋亡。同时本研究结果显示,干扰LRRC75A-AS1表达可明显降低划痕愈合率,提示干扰LRRC75A-AS1表达可抑制肺癌细胞迁移。
本研究证实LRRC75A-AS1可充当miR-22-3p的海绵分子,并可负向调控miR-22-3p的表达。LncRNA LINC00858通过充当miR-22-3p的竞争性内源RNA而促进结肠直肠癌细胞增殖、迁移和侵袭[15]。LncRNA DGCR5通过抑制miR-22-3p促进肺腺癌发展进程[16]。LncRNA NCK1-AS1通过miR-22-3p/IGF1R途径增强神经胶质瘤细胞的增殖[17]。LncRNA H19通过miR-22-3p/Snail1轴调控胃癌的细胞生长和转移[18]。本研究结果显示,肺癌组织中miR-22-3p的表达水平降低,抑制miR-22-3p可逆转干扰LRRC75A-AS1对肺癌细胞增殖、凋亡及迁移的作用。
综上所述,肺癌组织中LRRC75A-AS1的表达水平升高,而miR-22-3p的表达水平降低,干扰LRRC75A-AS1表达可通过上调miR-22-3p的表达从而抑制肺癌细胞增殖、迁移及克隆形成能力,并可促进肺癌细胞凋亡。但LRRC75A-AS1是否可通过调控miR-22-3p及其靶基因表达从而发挥抗肺癌作用仍需进一步探究。
干扰LncRNA LRRC75A-AS1抑制肺癌细胞发生发展研究
Effect of Inhibition of LncRNA LRRC75A-AS1 on the development of lung cancer cells
-
摘要:
目的探讨LncRNA LRRC75A-AS1/miR-22-3p对肺癌细胞增殖、凋亡、迁移的影响及其可能作用机制。 方法采用qRT-PCR法检测肺癌组织与癌旁组织中LRRC75A-AS1、miR-22-3p的表达水平;体外培养人肺癌细胞A549,si-NC、si-LRRC75A-AS1、si-LRRC75A-AS1与anti-miR-NC、si-LRRC75A-AS1与miR-22-3p inhibitor转染入A549细胞;采用qRT-PCR法检测A549细胞中LRRC75A-AS1、miR-22-3p的表达水平;采用MTT实验与平板克隆形成实验分别检测细胞增殖及克隆形成能力;采用流式细胞术检测细胞凋亡率;采用划痕实验检测细胞迁移能力;双荧光素酶报告实验检测LRRC75A-AS1与miR-22-3p的靶向关系;Western blotting法检测Cleaved-caspase3蛋白表达量。 结果与癌旁组织比较,肺癌组织中LRRC75A-AS1的表达水平[(1.01±0.13)vs(4.59±0.34)]升高(P < 0.01),miR-22-3p的表达水平[(1.00±0.12)vs(0.28±0.04)]降低(P < 0.01);与si-NC组比较,si-LRRC75A-AS1组细胞存活率[100%vs(54.45±2.21)%]降低(P < 0.01),克隆形成数[(121.00±5.10)个vs(58.67±2.49)个]减少(P < 0.01),凋亡率[(8.42±0.34)%vs(25.59±0.80)%]升高(P < 0.01),Cleaved-caspase3蛋白水平[(0.20±0.01)vs(0.68±0.05)]升高(P < 0.01),划痕愈合率[(66.71±1.43)%vs(32.56±0.95)%]降低(P < 0.01);双荧光素酶报告实验证实LRRC75A-AS1可充当miR-22-3p的竞争性内源RNA;与si-LRRC75A-AS1+anti-miR-NC组比较,si-LRRC75A-AS1+miR-22-3p inhibitor组细胞存活率[(54.61±2.28)%vs(88.75±3.22)%]升高(P < 0.01),克隆形成数[(57.67±2.49)个vs(106.67±3.68)个]增多(P < 0.01),凋亡率[(25.63±0.99)%vs(13.11±0.55)%]降低(P < 0.01),划痕愈合率[(32.52±0.98)%vs(55.30±1.18)%]升高(P < 0.01),Cleaved-caspase3蛋白水平[(0.67±0.06)vs(0.30±0.03)]降低(P < 0.01)。 结论干扰LRRC75A-AS1表达可能通过上调miR-22-3p从而减弱肺癌细胞增殖、迁移及克隆形成能力,并能够诱导细胞凋亡。 Abstract:ObjectiveTo explore the effect of LncRNA LRRC75A-AS1/miR-22-3p on the proliferation, apoptosis and migration in lung cancer cells. MethodsThe qRT-PCR method was used to detect the expressions of LRRC75A-AS1 and miR-22-3p in lung cancer tissues and adjacent tissues.Human lung cancer cells A549 were cultured in vitrol, si-NC, si-LRRC75A-AS1, si-LRRC75A-AS1 and anti-miR-NC, si-LRRC75A-AS1 and miR-22-3p inhibitor were transfected into A549 cells.The qRT-PCR method was used to detect the expressions of LRRC75A-AS1 and miR-22-3p in A549 cells.MTT assay and plate clone formation experiment were used to detect cell proliferation and clone formation ability, respectively.Flow cytometry was used to detect the apoptosis rate.Scratch test was used to detect cell migration ability.The dual luciferase reporter experiment was used to detect the targeting relationship between LRRC75A-AS1 and miR-22-3p.Western blotting was used to detect the expression of cleaved-caspase3 protein. ResultsCompared with adjacent tissues, the expression of LRRC75A-AS1 in lung cancer tissues was increased [(1.01±0.13) vs(4.59±0.34)](P < 0.01), and the expression level of miR-22-3p was decreased [(1.00±0.12)vs(0.28±0.04)](P < 0.01).Compared with the si-NC group, the cell survival rate of the si-LRRC75A-AS1 group was reduced[100%vs(54.45±2.21)%](P < 0.01), the number of clone formation was reduced[(121.00±5.10) vs(58.67±2.49)](P < 0.01), the apoptosis rate was increased[(8.42±0.34)%vs(25.59±0.80)%](P < 0.01), the protein level of cleaved-caspase3 was increased [(0.20±0.01)vs(0.68±0.05)](P < 0.01), and the rate of scratch healing was decreased [(66.71±1.43)%vs(32.56±0.95)%](P < 0.01).The dual luciferase report experiment confirmed that LRRC75A-AS1 could act as a competitive endogenous RNA for miR-22-3p.Compared with the si-LRRC75A-AS1+anti-miR-NC group, the cell survival rate of the si-LRRC75A-AS1+miR-22-3p inhibitor group was increased[(54.61±2.28)%vs(88.75±3.22)%](P < 0.01), the number of clones was increased [(57.67±2.49)vs(106.67±3.68)](P < 0.01), the apoptosis rate was decreased [(25.63±0.99)%vs(13.11±0.55)%](P < 0.01), the scratch healing rate was increased [(32.52±0.98)%vs(55.30±1.18)%](P < 0.01), and the protein level of cleaved-caspase3 was decreased[(0.67±0.06)vs(0.30±0.03)](P < 0.01). ConclusionsInhibiting the expression of LRRC75A-AS1 may reduce the proliferation, migration and clone formation ability of lung cancer cells by up-regulating miR-22-3p, which can induce cell apoptosis. -
Key words:
- lung neoplasms /
- LncRNA LRRC75A-AS1 /
- miR-22-3p /
- proliferation /
- apoptosis /
- migration
-
表 1 LRRC75A-AS1和miR-22-3p在肺癌中的表达比较(x±s)
分组 n LRRC75A-AS1 miR-22-3p 癌旁组织 43 1.01±0.13 1.00±0.12 肺癌组织 43 4.59±0.34 0.28±0.04 t — 64.49 37.33 P — < 0.01 < 0.01 表 2 干扰LRRC75A-AS1对A549增殖凋亡的影响(x±s; ni=3)
分组 存活率/% 克隆形成数/个 凋亡率/% Cleaved-caspase3 si-NC 100.00 121.00±5.10 8.42±0.34 0.20±0.01 si-LRRC75A-AS1 54.45±2.21 58.67±2.49 25.59±0.80 0.68±0.05 t 35.70 19.02 34.21 16.31 P < 0.01 < 0.01 < 0.01 < 0.01 表 3 干扰LRRC75A-AS1对A549迁移的影响(x±s; ni=3)
分组 LRRC75A-AS1 miR-22-3p 划痕愈合率/% si-NC 0.99±0.05 0.99±0.04 66.71±1.43 si-LRRC75A-AS1 0.23±0.01 3.47±0.07 32.56±0.95 t 25.82 53.28 34.45 P < 0.01 < 0.01 < 0.01 表 4 双荧光素酶报告实验(x±s; ni=3)
分组 WT-LRRC75A-AS1 MUT-LRRC75A-AS1 miR-NC 0.98±0.05 1.00±0.05 miR-22-3p 0.24±0.01 0.99±0.03 t 25.14 0.30 P < 0.01 >0.05 表 5 抑制miR-22-3p可逆转干扰LRRC75A-AS1对A549增殖、凋亡、迁移的影响(x±s; ni=3)
分组 存活率/% 克隆形成数/个 凋亡率/% 划痕愈合率/% Cleaved-caspase3 si-LRRC75A-AS1+anti-miR-NC 54.61±2.28 57.67±2.49 25.63±0.99 32.52±0.98 0.67±0.06 si-LRRC75A-AS1+miR-22-3p inhibitor 88.75±3.22 106.67±3.68 13.11±0.55 55.30±1.18 0.30±0.03 t 14.99 19.10 19.15 25.72 9.55 P < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 -
[1] LIU J, YAO L, ZHANG M, et al. Downregulation of LncRNA-XIST inhibited development of non-small cell lung cancer by activating miR-335/SOD2/ROS signal pathway mediated pyroptotic cell death[J]. Aging(Albany NY), 2019, 11(18): 7830. [2] DONG Y, HUO X, SUN R, et al. lncRNA Gm15290 promotes cell proliferation and invasion in lung cancer through directly interacting with and suppressing the tumor suppressor miR-615-5p[J]. Biosci Rep, 2018, 38(5): 1. [3] LI S, MEI Z, HU HB, et al. The lncRNA MALAT1 contributes to non-small cell lung cancer development via modulating miR-124/STAT3 axis[J]. J Cell Physiol, 2018, 233(9): 6679. doi: 10.1002/jcp.26325 [4] ZHANG YX, YUAN J, GAO ZM, et al. LncRNA TUC338 promotes invasion of lung cancer by activating MAPK pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(2): 443. [5] LI S, WU D, JIA H, et al. Long non-coding RNA LRRC75A-AS1 facilitates triple negative breast cancer cell proliferation and invasion via functioning as a ceRNA to modulate BAALC[J]. Cell Death Dis, 2020, 11(8): 643. doi: 10.1038/s41419-020-02821-2 [6] HE W, ZHANG Y, XIA S. LncRNA NNT‐AS1 promotes non‐small cell lung cancer progression through regulating miR-22-3p/YAP1 axis[J]. Thorac Cancer, 2020, 11(3): 549. doi: 10.1111/1759-7714.13280 [7] WEI S, WANG K, HUANG X, et al. LncRNA MALAT1 contributes to non-small cell lung cancer progression via modulating miR-200a-3p/programmed death-ligand 1 axis[J]. Int J Immunopathol Pharmacol, 2019, 33(1): 1. [8] HE R, ZHANG FH, SHEN N. LncRNA FEZF1-AS1 enhances epithelial-mesenchymal transition(EMT) through suppressing E-cadherin and regulating WNT pathway in non-small cell lung cancer(NSCLC)[J]. Biomed Pharmacother, 2017, 95(1): 331. [9] LU W, ZHANG H, NIU Y, et al. Long non-coding RNA linc00673 regulated non-small cell lung cancer proliferation, migration, invasion and epithelial mesenchymal transition by sponging miR-150-5p[J]. Mol Cancer, 2017, 16(1): 118. doi: 10.1186/s12943-017-0685-9 [10] CHEN QF, KONG JL, ZOU SC, et al. LncRNA LINC00342 regulated cell growth and metastasis in non-small cell lung cancer via targeting miR-203a-3p[J]. Eur Rev Med Pharmacol Sci, 2019, 23(17): 7408. [11] CHEN J, LAN J, YE Z, et al. Long noncoding RNA LRRC75A-AS1 inhibits cell proliferation and migration in colorectal carcinoma[J]. Exp Biol Med(Maywood), 2019, 244(14): 1137. doi: 10.1177/1535370219874339 [12] WANG F, TIAN X, ZHOU J, et al. A three-lncRNA signature for prognosis prediction of acute myeloid leukemia in patients[J]. Mol Med Rep, 2018, 18(2): 1473. [13] ZHANG L, LIU B. Sapylin inhibits lung cancer cell proliferation and promotes apoptosis by attenuating PI3K/AKT signaling[J]. J Cell Biochem, 2019, 120(9): 14679. doi: 10.1002/jcb.28729 [14] LIANG H, WANG C, GAO K, et al. MicroRNA 421 promotes the progression of non-small cell lung cancer by targeting HOPX and regulating the Wnt/β-catenin signaling pathway[J]. Mol Med Rep, 2019, 20(1): 151. [15] SHA QK, CHEN L, XI JZ, et al. Long non-coding RNA LINC00858 promotes cells proliferation, migration and invasion by acting as a ceRNA of miR-22-3p in colorectal cancer[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 1057. doi: 10.1080/21691401.2018.1544143 [16] DONG HX, WANG R, JIN XY, et al. LncRNA DGCR5 promotes lung adenocarcinoma(LUAD) progression via inhibiting hsa-mir-22-3p[J]. J Cell Physiol, 2018, 233(5): 4126. doi: 10.1002/jcp.26215 [17] WANG B, WANG K, JIN T, et al. NCK1-AS1 enhances glioma cell proliferation, radioresistance and chemoresistance via miR-22-3p/IGF1R ceRNA pathway[J]. Biomed Pharmacother, 2020, 129(1): 110395. [18] GAN L, LV L, LIAO S. Long non coding RNA H19 regulates cell growth and metastasis via the miR-22-3p/Snail1 axis in gastric cancer[J]. Int J Oncol, 2019, 54(6): 2157. -




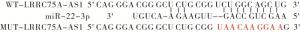
 下载:
下载:


