-
癌症是严重影响人类生命健康的疾病。据统计肺癌在中国[1]乃至全球[2]的发病和死亡率均位于各种恶性肿瘤之首。其中,非小细胞型肺癌(non-small cell lung carcinoma,NSCLC)占80%~85%,超过70%的肺癌病人确诊时已属晚期,此时发生的肺癌细胞向脑、肝、骨等重要器官的转移是癌症死亡的重要原因之一。肿瘤细胞的转移是一个复杂而多变的过程,包括脱落的肿瘤细胞在局部组织的浸润、向淋巴管和血管侵袭、进入血液循环并从微血管渗出到达新的转移部位定植与增殖等过程[3]。
转化生长因子(transforming growth factor, TGF)-β1是一种多功能细胞调节因子,在癌症的发生过程中发挥了双向调节作用,不同肿瘤细胞的组织表达水平有差异。研究[4]表明在Ⅲ、Ⅳ期及有淋巴转移的NSCLC组织中,TGF-β1的表达较Ⅰ、Ⅱ期及无淋巴结转移的NSCLC组织相比显著增加,TGF-β1的高表达可能提示NSCLC的进展或转移。而上皮-间充质转化(Epithelial-mesenchymal transition, EMT)是早期肿瘤转移和进展过程中发生的一项关键事件。多种肿瘤细胞都可以通过EMT失去细胞间接触和细胞极性等上皮细胞样的表型特征,从而获得侵袭和迁移能力[5-6]。TGF-β1作为最早被发现的能诱导EMT发生的多功能细胞因子之一[7],可通过诱导EMT参与多种生物学过程,如纤维化疾病、胚胎发育和癌症的发生等,且TGF-β1已被证实参与了肺腺癌EMT的发生。
中药在防止肿瘤复发和转移方面有一定的疗效。黄连素,又名小檗碱,是一种异喹啉生物碱[8],存在于黄连和其他多种植物中,具有多种生物活性,研究[9]表明,黄连素在肠道、口腔、乳腺等多种肿瘤中能起到一定的预防和抗肿瘤的作用。在乳腺癌和黑素瘤等[10-11]细胞中黄连素已被证明可以抑制肿瘤细胞的侵袭和迁移。本研究观察黄连素对TGF-β1诱导的肺癌细胞侵袭和迁移的影响。
-
肺癌A549细胞株购于ATCC公司;TGF-β1购于Proteintech公司;RPMI 1640培养基、胎牛血清、胰蛋白酶购自Gibco公司;黄连素、磺胺霍丹明B、三氯乙酸(TCA)、乙酸、二甲基亚砜(DMSO)购自美国Sigma-Aldrich公司。
-
将细胞接种到96孔板中,分别暴露于2.5、5.0、10.0、20.0、40.0、80.0、160.0 μmol/L浓度的黄连素48 h后,将细胞在4 ℃下用TCA固定1 h后风干,室温下用0.4%SRB溶液染色30 min后,弃上清,1%乙酸洗涤细胞5次,随后添加10 mmol/L Tris碱溶液(pH 10.5),振荡混匀后孵育10 min。使用酶标仪(MRX;Dynex Technologies,Chantilly,VA,美国)测定OD 570 nm波长下各孔的吸光度值,每个浓度下设3个复孔,实验重复3次。
-
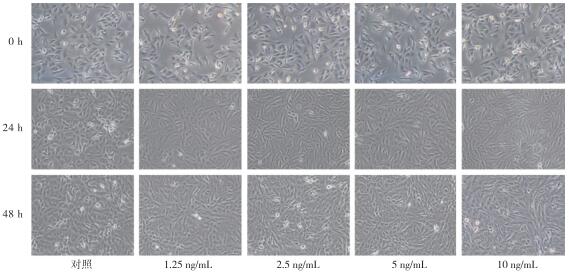
取对数生长期细胞按每孔5×105个细胞数加入6孔板中培养,待生长至80%融合时用200 μL无菌枪头垂直于板面划痕。随后,将细胞用PBS洗涤2次,换无血清的新鲜培养基,加入不同浓度TGF-β1(1.25、2.50、5.00、10.00 ng/mL)后分别在0 h和48 h使用倒置显微镜(Nikon Eclipse TS100 1064;Nikon,日本)在同一视野中拍照,实验重复3次。
-
用1 mg/mL Matrigel胶包被Transwell小室的内室(观察迁移时无需包被),将小室放置于24孔板(孔径8 μmol/L)中。取对数期A549细胞用无血清培养基制成细胞悬液,TGF-β1对A549细胞侵袭能力的影响采用不同浓度的TGF-β1(1.25、2.50、5.00、10.00 ng/mL)处理,黄连素对TGF-β1诱导的侵袭能力影响采用TGF-β1 5 ng/mg联合不同浓度黄连素(0、2.5、5、10 μmol/L)进行干预,随后按5×104个细胞/200 μL加入上室中(观察迁移时需将上室细胞数调整为2.5×104个/200 μL),下室加入800 μL含10%胎牛血清的RPMI 1640培养基。37 ℃培养48 h,4%多聚甲醛中固定,0.1%结晶紫染色,棉签轻拭下上室Matrigel胶和细胞,于倒置显微镜(MF53,奥林巴斯)下观察下室中各组细胞的侵袭情况,随机选择5个视野进行计数,实验重复3次。
-
采用方差分析和q检验。
-
A549暴露于较高剂量的TGF-β1(5.00 ng/mL和10.00 ng/mL)48 h后,细胞发生了EMT的形态学变化,产生了有纺锤样的成纤维细胞表型,并且细胞间的接触减少(见图 1)。
-
结果表明,与空白对照组相比,2.50~10.00 ng/mL TGF-β1处理后的A549细胞,侵袭和迁移能力明显增强(见图 2、3及表 1)。结合细胞形态学的结果,在浓度为5 ng/mL TGF-β1的作用下,A549细胞即可发生显著的EMT形态学改变,侵袭和迁移能力也显著增强。
分组 相对迁移率/% 侵袭细胞数/个 TGF-β1/(ng/mL) 0.00 9.27±4.56 66.67±11.93 1.25 15.95±1.70 179.00±7.94 2.50 8.18±3.08* 364.00±31.19* 5.00 31.66±1.85** 419.00±19.92* 10.00 35.73±2.39** 484.67±104.84* F 43.79 36.23 P <0.01 <0.01 MS组内 8.477 2 513.530 q检验:与TGF-β1 0.00 ng/mL组比较*P < 0.05, **P < 0.01 表 1 TGF-β1对A549细胞的侵袭和迁移能力的影响(ni=3;x±s)
-
结果显示10.0 μmol/L黄连素刺激A549细胞48 h后,细胞存活率为(96.19±1.05)%, 表明10.0 μmol/L以内的黄连素对A549细胞无毒性。当黄连素浓度高于10.0 μmol/L时,随着药物浓度的增加,黄连素对A549细胞的生长抑制作用明显增加,且各浓度组对A549细胞的存活率与空白对照组比较,差异均有统计学意义(P < 0.01)(见表 2)。
分组/(μmol/L) 存活率/% F P MS组内 0.0 100.00±0.00 2.5 100.71±2.77 5.0 99.77±3.83 10.0 96.19±1.05 100.98 <0.01 4.880 20.0 90.19±1.19* 40.0 77.45±0.84** 80.0 73.10±1.81** 160.0 70.60±3.18** q检验:与0.0 μmol/L组比较*P < 0.05,**P < 0.01 表 2 不同浓度黄连素对A549细胞存活率的影响(ni=3;x±s)
-
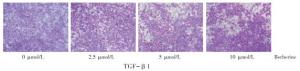
2.5~10.0 μmol/L的黄连素与5.00 ng/mL TGF-β1共同作用于A549细胞48 h后,通过Transwell实验观察到与单加5.00 ng/mL TGF-β1组相比,10 μmol/L的黄连素能显著抑制TGF-β1诱导的A549细胞的迁移,而2.5~10.0 μmol/L的黄连素均对TGF-β1诱导的A549细胞的侵袭能力有抑制作用,差异有统计学意义(P < 0.01)(见表 3)。结果表明非细胞毒性的黄连素可能为A549细胞侵袭和迁移的有效抑制剂(见图 4、5)。
分组 迁移细胞数/个 侵袭细胞数/个 TGF-β1/(5.00 ng/mL) 576.67±30.24 484.33±22.05 黄连素/(μmol/L) 2.5 568.00±31.61 246.00±20.66** 5.0 537.00±26.96 110.33±8.74** 10.0 473.20±133.94* 89.00±14.00** F 11.91 334.39 P <0.01 <0.01 MS组内 843.080 296.420 q检验:与单加TGF-β1 5.00 ng/mL组比较*P < 0.05, **P < 0.01 表 3 黄连素对TGF-β1诱导A549细胞的侵袭和迁移能力的影响(ni=3;x±s)
-
肿瘤转移是始于肿瘤细胞迁移和侵袭的一系列复杂过程,EMT在其中发挥了重要作用[12-13]。EMT发生时,极化良好且黏附力强的上皮细胞会失去极性和细胞间黏附力,从而使这些细胞获得了高度运动的成纤维细胞或间充质表型[13]。TGF-β1是EMT的主要诱导剂,研究[14]表明,TGF-β1可以上调锌指蛋白转录因子snail和slug的表达,抑制EMT相关标志分子E-cadherin的转录,促进EMT的发生。我们的研究也证实了5.00 ng/mL TGF-β1显著增强了A549细胞的侵袭和迁移能力,并能诱导A549细胞获得EMT样纺锤状成纤维细胞表型,将其用于后续黄连素对A549细胞侵袭和迁移作用的影响以探讨黄连素可能作用机制。
黄连素在以往研究中已被证实可单独或联合其他抗肿瘤药物发挥抗肿瘤作用,但其具体作用机制仍待进一步阐明。既往研究[15]中黄连素对A549细胞侵袭转移的作用浓度多集中于20.0~100.0 μmol/L,而我们的研究表明黄连素浓度自20.0 μmol/L起就会对A549细胞产生杀伤作用,这就有可能会对A549细胞迁移、侵袭本身产生影响,这是以往研究中所忽略的。所以为探索黄连素的可能作用机制,我们选取非细胞毒性作用的黄连素(2.5~10.0 μmol/L)来进行研究,探讨其是否是作用于TGF-β1所致。结果表明,非细胞毒性的黄连素能显著抑制TGF-β1诱导的A549细胞侵袭和迁移。
综上所述,非细胞毒性的黄连素在体外能显著抑制TGF-β1诱导的肺癌A549细胞的侵袭和迁移,表明黄连素可以作为预防人肺癌侵袭和迁移的潜在抑制剂,这为晚期转移性肺癌的治疗提供了新的方向,具体机制有待进一步探讨。
黄连素对TGF-β1诱导的肺癌A549细胞侵袭和迁移的影响
Effect of berberine on invasion and migration induced by transforming growth factor-β1 in lung cancer A549 cells
-
摘要:
目的观察黄连素对转化生长因子(TGF)-β1诱导的肺癌A549细胞侵袭、迁移的影响。 方法以肺腺癌A549细胞为研究对象,观察1.25、2.5、5、10 ng/mL TGF-β1分别在24、48 h对A549细胞形态的影响,采用划痕实验和Transwell法检测浓度下TGF-β1作用于A549细胞48 h后迁移和侵袭能力的变化,通过SRB法评价0~160 μmol/L黄连素体外对A549细胞毒活性以筛选出黄连素的安全浓度,观察安全浓度内的黄连素对TGF-β1诱导的肺癌A549细胞迁移和侵袭能力的影响。 结果在5 ng/mL TGF-β1刺激48 h后,A549细胞株表现出明显的上皮-间充质转化形态学变化和更强的侵袭、迁移能力。10 μmol/L浓度范围内的黄连素对A549细胞无细胞毒性。与TGF-β1组相比,2.5、5、10 μmol/L黄连素可以显著抑制A549细胞的侵袭,10 μmol/L黄连素可以显著抑制A549细胞的迁移。 结论黄连素对TGF-β1诱导的肺癌A549细胞的侵袭和迁移具有抑制作用。 Abstract:ObjectiveTo observe the effect of berberine on the invasion and migration of lung cancer A549 cells induced by transforming growth factor (TGF)-β1. MethodsThe effects of 1.25, 2.5, 5.0 and 10 ng/mL TGF-β1 on the morphology of A549 cells were observed at 24 and 48 h, respectively.Wound scratch assay and Transwell assay were applied to detect the changes of migration and invasion ability of A549 cells treated with different concentrations of TGF-β1 for 48 h.The cytotoxic activity of berberine at the concentration of 0-160 μmol/L in vitro was evaluated by SRB assay to find the safe concentration of berberine, then the effects of berberine at safe concentrations on the migration and invasion induced by TGF-β1 in A549 cells were determined. ResultsA549 cells showed significant epithelial-mesenchymal transition morphological changes and stronger invasion and migration ability after 5 ng/mL TGF-β1 treatment for 48 h.Berberine within the concentration range of 10 μmol/L exhibited no cytotoxicity to A549 cells.Compared with TGF-β1 group, 2.5, 5, 10 μmol/L berberine significantly inhibited the invasion of A549 cells, and 10 μmol/L berberine obviously suppressed the migration of A549 cells. ConclusionBerberine inhibits the invasion and migration of lung cancer A549 cells induced by TGF-β1. -
Key words:
- lung neoplasms /
- berberine /
- transforming growth factor -β1 /
- invasion /
- migration
-
表 1 TGF-β1对A549细胞的侵袭和迁移能力的影响(ni=3;x±s)
分组 相对迁移率/% 侵袭细胞数/个 TGF-β1/(ng/mL) 0.00 9.27±4.56 66.67±11.93 1.25 15.95±1.70 179.00±7.94 2.50 8.18±3.08* 364.00±31.19* 5.00 31.66±1.85** 419.00±19.92* 10.00 35.73±2.39** 484.67±104.84* F 43.79 36.23 P <0.01 <0.01 MS组内 8.477 2 513.530 q检验:与TGF-β1 0.00 ng/mL组比较*P < 0.05, **P < 0.01 表 2 不同浓度黄连素对A549细胞存活率的影响(ni=3;x±s)
分组/(μmol/L) 存活率/% F P MS组内 0.0 100.00±0.00 2.5 100.71±2.77 5.0 99.77±3.83 10.0 96.19±1.05 100.98 <0.01 4.880 20.0 90.19±1.19* 40.0 77.45±0.84** 80.0 73.10±1.81** 160.0 70.60±3.18** q检验:与0.0 μmol/L组比较*P < 0.05,**P < 0.01 表 3 黄连素对TGF-β1诱导A549细胞的侵袭和迁移能力的影响(ni=3;x±s)
分组 迁移细胞数/个 侵袭细胞数/个 TGF-β1/(5.00 ng/mL) 576.67±30.24 484.33±22.05 黄连素/(μmol/L) 2.5 568.00±31.61 246.00±20.66** 5.0 537.00±26.96 110.33±8.74** 10.0 473.20±133.94* 89.00±14.00** F 11.91 334.39 P <0.01 <0.01 MS组内 843.080 296.420 q检验:与单加TGF-β1 5.00 ng/mL组比较*P < 0.05, **P < 0.01 -
[1] 孙可欣, 郑荣寿, 张思维, 等.2015年中国分地区恶性肿瘤发病和死亡分析[J]中国肿瘤, 2019, 28(1):4. [2] BRAY F, FERLAY J, SOERJOMATARAM I, et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2018, 68(6):394. [3] CHAFFER CL, WEINBERG RA.A perspective on cancer cell metastasis[J].Science, 2011, 331(6024):1559. [4] 吴新天, 周韶璋, 莫娟梅, 等.HIF-1α、VEGF和TGF-β1在非小细胞肺癌中的表达及其临床意义[J].中国癌症防治杂志, 2013, 27(1):46. [5] YE X, BRABLETZ T, KANG Y, et al.Upholding a role for EMT in breast cancer metastasis[J].Nature, 2017, 547(7661):E1. [6] AIELLO N M, BRABLETZ T, KANG Y, et al.Upholding a role for EMT in pancreatic cancer metastasis[J].Nature, 2017, 547(7661):E7. [7] YANG J, WEINBERG RA.Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J].Dev Cell, 2008, 14(6):818. [8] BISHAYEE A, BLOCK K.A broad-spectrum integrative design for cancer prevention and therapy:The challenge ahead[J].Semin Cancer Biol, 2015, 35(Suppl):S1. [9] YARLA NS, BISHAYEE A, SETHI G, et al.Targeting arachidonic acid pathway by natural products for cancer prevention and therapy[J]Semin Cancer Biol, 2016, 40:48. [10] KIM S, CHOI JH, KIM JB, et al.Berberine suppresses TNF-alpha-induced MMP-9 and cell invasion through inhibition of AP-1 activity in MDA-MB-231 human breast cancer cells[J].Molecules, 2008, 13(12):2975. [11] KIM HS, KIM MJ, KIM EJ, et al.Berberine-induced AMPK activation inhibits the metastatic potential of melanoma cells via reduction of ERK activity and COX-2 protein expression[J].Biochem Pharmacol, 2012, 83(3):385. [12] CHEN J, LI Q, AN Y, et al.CEACAM6 induces epithelial-mesenchymal transition and mediates invasion and metastasis in pancreatic cancer[J].Int J Oncol, 2013, 43(3):877. [13] CREIGHTON CJ, GIBBONS DL, KURIE JM.The role of epithelial-mesenchymal transition programming in invasion and metastasis:a clinical perspective[J].Cancer Manag Res, 2013, 5:187. [14] THIERY JP, ACLOQUE H, HUANG RY, et al.Epithelial-mesenchymal transitions in development and disease[J].Cell, 2009, 139(5):871. [15] 辛灵艳, 范理宏.黄连素对肺腺癌A549细胞增殖、迁移和侵袭的影响[J].现代肿瘤医学, 2014, 22(5):998. -





 下载:
下载: